
- •Лабораторна робота №1 Комплексонометричне визначення сульфат-іонів у воді
- •Лабораторна робота №2 Окиснюваність води
- •Дослід 1. Визначення перманганатної окиснюваності.
- •Дослід 2. Визначення біохімічного споживання кисню (бск)
- •Лабораторна робота №3 Визначення оптимальної дози коагулянту для обробки води
- •Лабораторна робота №4 Визначення активного й залишкового хлору
- •Дослід 1. Визначення активного хлору.
- •Дослід 2. Визначення хлоропоглинання
- •Лабораторна робота № 5 Дослідження складу активного мулу
- •Додаток 1 Коротка характеристика систематичних ознак організмів активного мулу і біоплівки
- •Додаток 2 Індикаторні організми активного мулу
- •Додаток 3 Біологічний контроль за санітарним станом водойм
- •Рекомендована література
Дослід 1. Визначення перманганатної окиснюваності.
В конічну колбу місткістю 250 см3 наливають 100 см3 води, додають 5 см3 сульфатної кислоти (розведення 1:3) і розчин калій перманганату (Секв= 0,01 моль/л) у кількості Vn = 10 см3. Накривши колбу лійкою кип’ятять 10 хвилин від моменту закипання.
Калій перманганат, як сильний окислювач, реагує з присутніми у воді відновниками:
МnО4–
+ 8Н+
+ 5![]() → Мn2+
+ 4Н2О.
→ Мn2+
+ 4Н2О.
Оскільки перманганат додають з надлишком, його залишок забарвлює досліджувану пробу води і реагує з оксалатною кислотою, яку додають у кількості 10 см3 (Секв=0,01 моль/л) у зняту з нагрівального приладу колбу:
2МnО4– + 5С2О42– + 16Н+ → 2Мn2+ + 10СО2 + 8Н2О.
Гарячий розчин після введення оксалатної кислоти втрачає колір. Щоб визначити залишок оксалатної кислоти пробу у колбі відразу титрують розчином КМnО4 (Секв=0,01 моль/л) до слаборожевого кольору. Кількість витраченого розчину КМnО4 позначаємо V1 (перше титрування). Таким чином, на реакції з органічними речовинами досліджуваної води і 10 см3 оксалатної кислоти витрачено (Vn + V1) см3 розчину КМnО4.
Для визначення кількості розчину калій перманганату, який витрачається на титрування 10 см3 оксалатної кислоти (Секв=0,01 моль/л), тобто для визначення титру КМnО4 в ту саму колбу в ще гарячий розчин доливають 10 см3 розчину оксалатної кислоти і знову відтитровують калій перманганатом до слаборожевого кольору, який зберігається протягом 1 хвилини. Кількість витраченого розчину КМnО4 позначаємо V2 (друге титрування). Об'єм розчину КМnО4, який витрачено на реакції з органічними домішками досліджуваної води, становить (Vn + V1 – V2) cм3.
Перманганатну окиснюваність, Ок, обчислюють за формулою:
Ок
=
![]() ,
мгО2/л,
,
мгО2/л,
де k – поправочний коефіцієнт, k = 10/V2 ;
mекв(О) – молярна маса еквівалента кисню, mекв(О) = 8 г/моль;
VВ – об'єм досліджуваної води, см3.
Дослід 2. Визначення біохімічного споживання кисню (бск)
Досліджувану воду наливають у колбу місткістю 1 дм3, підігрівають (або охолоджують) до 20°С та сильно струшують протягом 1 хв. для насичення киснем. Коли бульбашки кисню вийдуть, воду наливають у дві склянки з притертими пробками. В одній з них визначають розчинений кисень [О2]0. Другу склянку з досліджуваною водою (інкубаційну) ставлять у термостат і витримують при температурі 20°С 5 діб. Потому в ній, як і в першій склянці, визначають розчинений кисень [О2]5. БСК розраховують за формулою:
БСК = [О2]0 – [О2]5, мгО2/л
де [О2]0 – початковий вміст кисню, розчиненого у воді, мгО2/л;
[О2]5 – кількість кисню у воді після п'яти діб інкубації, мгО2/л.
Запитання для самоконтролю.
1. Що таке окиснюваність води, в яких одиницях вимірюється?
2. Присутність яких речовин у воді обумовлює ХСК води?
3. Назвіть головні види окиснюваності.
4. Як за значенням окиснюваності оцінити ступінь забруднення води?
5. Складіть рівняння окисно-відновної реакції взаємодії калій дихромату з оксалатною кислотою в присутності сульфатної кислоти.
Лабораторна робота №3 Визначення оптимальної дози коагулянту для обробки води
Мета роботи: ознайомлення з методом очищення води коагуляцією, з видами коагулянтів, оволодіння методикою визначення оптимальної дози коагулянту.
Матеріальне забезпечення:
циліндри місткістю 500 або 1000 см3 – 7-10 шт.;
фотоелектроколориметр, кювети;
рН-метр;
терези лабораторні загального призначення з похибкою зважування 0,0002г;
муфельна піч;
сифон, скляні палички;
колби мірні на 100; 1000 см3;
колби конічні скляні лабораторні місткістю 250 см3;
піпетки з поділками на 1; 2; 5; 10 см3;
циліндри мірні на 10; 25; 50 і 100см3;
ступка;
прилади для визначення кольоровості, каламутності та лужності води (див. відповідні лабораторні роботи).
Реактиви:
алюміній сульфат, 5%-ний розчин;
кальцій
 гідроксид, 0,5%-ний розчин. 5 г прожареного
кальцій оксиду розтирають у ступці,
змивають киплячою дистильованою водою
в мірну колбу на 1000 см3
і доводять об'єм розчину до позначки;
гідроксид, 0,5%-ний розчин. 5 г прожареного
кальцій оксиду розтирають у ступці,
змивають киплячою дистильованою водою
в мірну колбу на 1000 см3
і доводять об'єм розчину до позначки;реактиви для визначення кольоровості, каламутності та лужності води (див. відповідні лабораторні роботи).
Методичні вказівки.
Коагуляцією називається процес укрупнення колоїдних і завислих частинок, який відбувається в результаті їх взаємодії і об'єднання в агрегати (пластівці). Завершується цей процес відокремленням агрегатів від води в результаті їх осадження. Для очищення води від домішок, які надають їй кольоровості і каламутності використовують солі – коагулянти. Кольоровість води обумовлюється присутністю в ній гумінових речовин, каламутність – найдрібніших глинистих і ґрунтових часточок, а також кремнієвої(силікатної) кислоти. Всі вони являють собою негативно заряджені колоїдні частинки. В якості коагулянтів на станціях водопідготовки застосовують алюміній сульфат, ферум(III) хлорид і змішаний коагулянт, що складається з алюміній сульфату та ферум(III) хлориду у співвідношенні 1:1. Рідше використовують ферум(III) і ферум(IІ) сульфати.
Очищення води методом коагуляції полягає у гідролізі коагулянтів, при якому утворюються колоїдні алюміній та ферум гідроксиди. Колоїдні частинки адсорбують різноманітні забарвлені домішки води, внаслідок чого вода знебарвлюється. Завдяки коагуляції відбувається також прояснення води, адже видаляються дрібні завислі частинки, які захоплюються пластівцями алюміній чи ферум(III) гідроксидів під час їх осідання і прилипають до них. Процес видалення дрібних частинок з розчину внаслідок захоплення їх крупними осідаючими частинками називається ортокінетичною коагуляцією.
Коагулянти – це солі сильних кислот і слабких основ. При введенні у воду вони гідролізують з утворенням основних солей, основ і кислот. Наприклад, гідроліз алюміній сульфату відбувається ступінчато з утворенням проміжних сполук – основних солей:
Al2(SO4)3 + 2H2O 2Al(OH)SO4 + H2SO4 ;
2Al(OH)SO4 + 2H2O [Al(OH)2 ]2SO4 + H2SO4 ;
[Al(OH)2 ]2SO4 + 2H2O 2Al(OH)3 + H2SO4 ,
або в іонному вигляді:
Al3+ + H2O AlOH2+ + H+ ;
AlOH2+ + H2O Al(OH)2+ + H+ ;
Al(OH)2+ + H2O Al(OH)3 + H+ .
Сумарний процес гідролізу:
Al2(SO4)3 + 6H2O 2Al(OH)3 + 3H2SO4 .
Аналогічно проходить гідроліз ферум(ІІІ) хлориду:
FeCl3 + 3H2O Fe(OH)3 + 3HCl.
Процес гідролізу є оборотним. Поява у розчині кислоти в результаті реакції і пов’язане з цим збільшення концентрації іонів Н+ гальмує гідроліз. Необхідною умовою для перебігу цього процесу в напрямку утворення алюміній і ферум(III) гідроксидів є зв’язування утвореної кислоти в малодисоційовану сполуку. У природних водах цьому сприяє наявність так званого лужного резерву води, тобто певної кількості гідрокарбонату кальцію (іонів НСО3–).
Кальцій гідрокарбонат зв’язує кислоту (H2SO4 або HCl), що утворюється при гідролізі, в малодисоційовану карбонатну кислоту, яка розпадається на вуглекислий газ і воду:
Ca(HCO3)2 + H2SO4 = CaSO4 + 2H2CO3 ;
H2CO3 = CO2 + H2O,
або в іонному вигляді: HCO3– + H+ =H2O + CO2 .
При гідролізі 1 мг алюміній сульфату витрачається 0,0175, а при гідролізі 1 мг ферум(III) хлориду – 0,0185 ммоль лужного резерву води (іонів НСО3–).
Гідроліз коагулянтів протікає доволі швидко. Протягом перших 30c після введення коагулянту у воду гідроліз закінчується утворенням колоїдних алюміній і ферум(III) гідроксидів. Колоїдні частинки гідроксидів мають величезну активну поверхню. Гумінові колоїдні речовини, які забарвлюють воду, адсорбуються на цій поверхні, і вода знебарвлюється. Колоїдні частинки гідроксидів об’єднуються в більш великі агрегати (утворюються пластівці), внаслідок чого порушується їх седиментаційна стійкість і вони осідають під дією сили тяжіння, тобто відбувається коагуляція.
У
процесі осідання пластівці захоплюють
дрібні глинисті і ґрунтові часточки,
які прилипають до поверхні пластівців
алюміній і ферум гідроксидів. Невелика
концентрація гідрокарбонатів у воді
не забезпечує повного зв'язування
утвореної при 

 гідролізі
кислоти (за великих доз коагулянту).
Через це гідроліз проходить не повністю,
погіршується процес пластівцеутворення
й у воді з’являються залишкові сполуки
Алюмінію чи Феруму.
гідролізі
кислоти (за великих доз коагулянту).
Через це гідроліз проходить не повністю,
погіршується процес пластівцеутворення
й у воді з’являються залишкові сполуки
Алюмінію чи Феруму.
Для збільшення лужного резерву (лужності) води проводять її вапнування – додають в процесі коагуляції вапняне молоко, яке нейтралізує кислоту, що виділяється при гідролізі. Вапняне молоко потрібно добавляти в точно розрахованій кількості, адже надлишок його може призвести до розчинення амфотерного алюміній гідроксиду.
За наявності у воді великої кількості органічних забруднень коагуляція проходить незадовільно і витрата коагулянту значно зростає. В цьому випадку одночасно із коагулянтами у воду добавляють хлор (прехлорування), який руйнує органічні речовини і поліпшує очищення води. Для інтенсифікації процесів коагуляції і осадження пластівців алюміній і ферум(III) гідроксидів використовують флокулянти – високомолекуярні речовини, які утворюють додаткові структури з пластівцями гідроксидів і з домішками води, прискорюють процес утворення пластівців і збільшують швидкість їх осідання. Флокулянти бувають мінеральні й органічні. Із мінеральних флокулянтів найчастіше застосовується активована кремнієва кислота, а з органічних – поліакриламід.
Кількість коагулянту, яка вводиться в воду, називається дозою. Оптимальна доза – це найменша кількість коагулянту, яка після випадання в осад внаслідок коагуляції завислих речовин протягом певного проміжку часу забезпечує залишкову кольоровість води рівну 20 град, і каламутність менше 1,5 мг/л. При визначенні оптимальної дози коагулянту потрібно враховувати залишкові концентрації Алюмінію і Феруму. Якщо оптимальна доза вибрана правильно, то в очищеній воді не повинні міститись сполуки Алюмінію чи Феруму.
Оптимальна доза коагулянту залежить від величини і природи кольоровості води, її каламутності і лужного резерву. Оптимальну дозу визначають експериментально, поступово збільшуючи дозу коагулянту, що вводиться у воду. Починаючи з певного моменту (коли лужний резерв води рівний 0) збільшення дози коагулянту приводить до уповільнення процесів утворення і осідання пластівців, а інколи й до повного їх припинення, збільшення кольоровості й каламутності води.
Отже, оптимальна доза коагулянту визначається здебільшого кольоровістю і каламутністю води, що поступає на очищення. Величина граничної дози коагулянту обмежується лужним резервом води.
Граничні дози коагулянтів Al2(SO4)3 (Дгр1) і FeCl3 (Дгр2), при яких процес коагуляції перебігає нормально, обчислюють відповідно за формулами:
Дгр1
=
![]() ;
Дгр2
=
;
Дгр2
=
![]() ,
,
де Л – лужний резерв води, ммоль/л; Лз – заданий залишковий лужний резерв води після очищення, ммоль/л.
При виборі оптимальної дози коагулянту можливі два випадки:
1. Лужний резерв води достатній для нейтралізації кислоти, яка утворюється при гідролізі коагулянту: Л ≥ 0,0175 Дгр1; Л ≥ 0,0185 Дгр2 .
2. Лужний резерв води недостатній для нейтралізації кислоти, що утворюється при гідролізі дози коагулянту.
В цьому випадку для підвищення лужного резерву води її підлужують, що дозволяє ввести такі дози коагулянту, які забезпечать необхідні кольоровість і каламутність води.
Хід визначення.
Попередньо визначають кольоровість, каламутність, лужність і рН досліджуваної води.
Оптимальну дозу коагулянту визначають таким чином. В 14 циліндрів місткістю 1000 см3 наливають досліджувану воду до мітки. В 7 з них піпеткою додають розчин алюміній сульфату чи ферум(III) хлориду (5%-ний) в таких кількостях:
Номер циліндра |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
Об'єм розчину коагулянту, добавленого в циліндр , мл |
0,5 |
1,0 |
2,0 |
3,0 |
4,0 |
6,0 |
8,0 |
Доза коагулянту, яка відповідає прийнятому об’єму, мг/л |
25 |
50 |
100 |
150 |
200 |
300 |
400 |
Воду
перемішують швидким (~20 с), а потім
повільним (~5 хв.) обертанням скляної
палички. Після осідання пластівців (~30
хв.) із верхнього шару води сифоном
відбирають по 200 мл  води.
В кожній з відібраних проб визначають
кольоровість, каламутність, лужність
і рН. В інші 7 циліндрів разом із розчином
коагулянту добавляють вапняне молоко
(0,5%-ний розчин) для нейтралізації кислоти,
яка утворюється при гідролізі коагулянту,
в таких кількостях:
води.
В кожній з відібраних проб визначають
кольоровість, каламутність, лужність
і рН. В інші 7 циліндрів разом із розчином
коагулянту добавляють вапняне молоко
(0,5%-ний розчин) для нейтралізації кислоти,
яка утворюється при гідролізі коагулянту,
в таких кількостях:
Номер циліндра |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
Об'єм розчину вапняного молока, добавленого в циліндр з коагу-лянтом алюміній сульфатом, мл |
2,4 |
4,8 |
9,6 |
14,4 |
19,2 |
28,8 |
38,4 |
Доза вапна, мг/л |
12 |
24 |
48 |
72 |
96 |
144 |
192 |
Об'єм розчину вапняного молока, добавленого в циліндр з коагу-лянтом ферум(ІІІ) хлоридом, мл |
2,5 |
5,0 |
10,0 |
15,0 |
20,0 |
30,0 |
40,0 |
Доза вапна, мг/л |
12,5 |
25 |
50,0 |
75,0 |
100 |
150 |
200 |
Д ля
нейтралізації кислоти, яка виділяється
при гідролізі 1 мг алюміній сульфату,
необхідно 0,48 мг СаО, а при гідролізі 1
мг ферум(III)
хлориду – 0,504 мг СаО.
ля
нейтралізації кислоти, яка виділяється
при гідролізі 1 мг алюміній сульфату,
необхідно 0,48 мг СаО, а при гідролізі 1
мг ферум(III)
хлориду – 0,504 мг СаО.
Воду перемішують так, як і в перших семи циліндрах. Через 30 хвилин відстоювання з верхнього шару води сифоном відбирають по 200 мл води. В кожній з відібраних проб теж визначають кольоровість, каламутність, лужність і рН.
При відстоюванні води в циліндрах відмічають час початку пластівцеутворення, час початку і закінчення осідання пластівців, а також їх вигляд (рихлі, крупні, дрібні).
Спостереження здійснюють через кожні 15 хвилин і проводять 2 години.
За одержаними експериментальними результатами будують графіки в координатах: кольоровість води – доза коагулянту; каламутність води – доза коагулянту; лужність води – доза коагулянту; час повного осідання пластівців – доза коагулянту (з моменту введення коагулянту до кінця осідання).
За графіками «кольоровість води – доза коагулянту», «каламутність води – доза коагулянту» визначають оптимальну дозу коагулянту.
Якщо кольоровість очищеної води у всіх циліндрах вище 20 град або каламутність перевищує 1,5 мг/л, то оптимальну дозу коагулянту визначають з графічних залежностей кольоровості води від дози коагулянту з використанням вапнування.
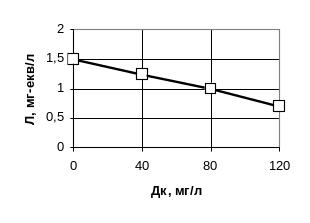
Приклад графічних залежностей каламутності, кольоровості і лужності води від дози коагулянту наведений на рис.1, 2 і 3.
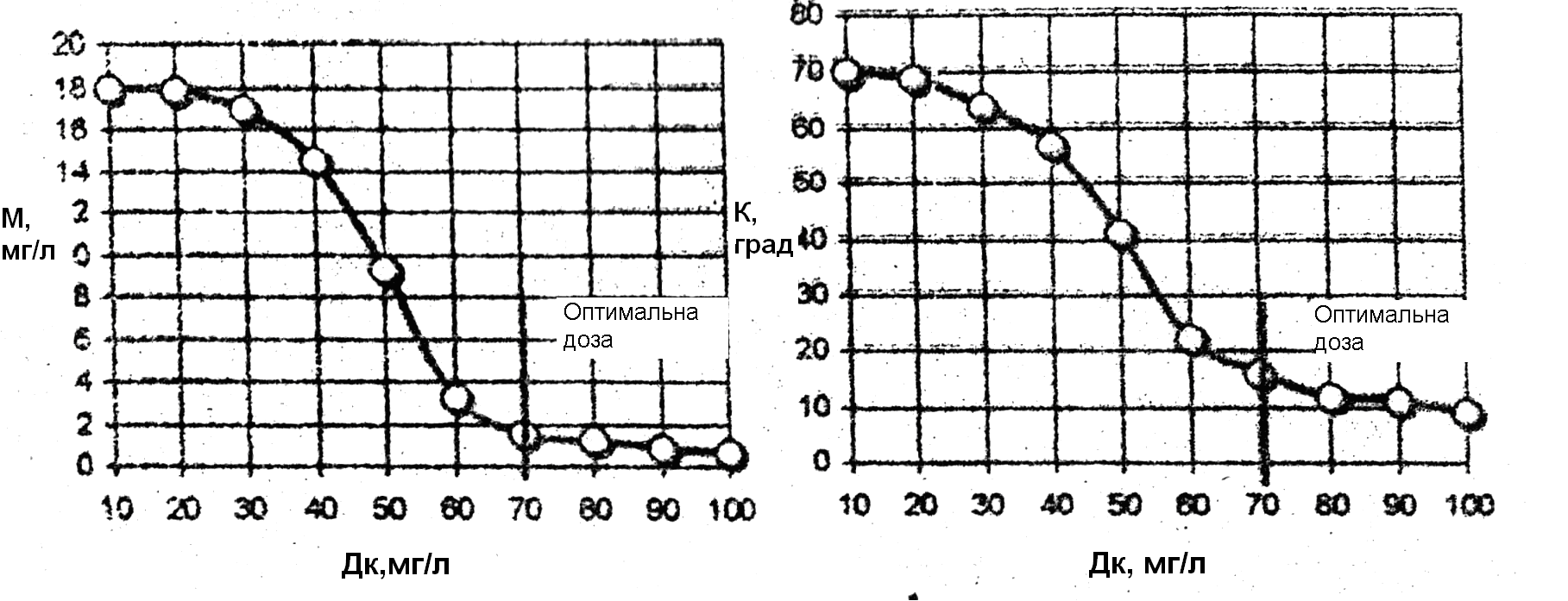
Рис. 1. Залежність каламутності води (М) від дози коагулянту (Дк)
Рис. 2. Залежність кольоровості води (К) від дози коагулянту (Дк)
Л, ммоль,л
Рис. 3. Залежність лужності води (Л) від дози коагулянту (Дк)
Графіки (рис.1-3) побудовані на підставі експериментальних даних, одержаних в результаті аналізу дніпровської води з кольоровістю 70 град, лужним резервом 1,5 ммоль/л, каламутністю 18 мг/л і рН=7,3. Оптимальна доза коагулянту становить 70 мг/л.
Обчислення результатів вимірювань.
Результати проведених дослідів записують у формі таблиці:
Номер циліндра |
Назва й доза коагулянту, мг/л |
Доза вапна, мг/л |
Час, хвилини |
Показники очищеної води |
Оптимальна доза коагулянту, мг/л |
Примітки (характер пластівців) |
|||||
початку утворення пластівців |
початку осідання пластівців |
закінчення осідання пластівців |
кольоровість, град |
каламутність, мг/л |
лужність, ммоль/л |
рН |
|||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
|
|
|
|
|
|
|
|
|
|
|
У звіті вказати місце відбору проби води, температуру води, лужність, рН, кольоровість, каламутність.
