
- •Лекція №1 зміст, предмет та задачі дисципліни.
- •Лекція №2-4 природні α-амінокислоти. Будова класифікація стереоізомерія хімічні властивості
- •Лекція №5 білки. Загальні відомості, функції білків
- •Білки загальні відомості.
- •2. Функції білків,зміст білків в органах і тканинах
- •Лекція № 6-9. Фізико-хімічні властивості білків, їх структурна організація, класифікація білків
- •1. Фізико-хімічні властивості білків. Поняття структурної організації білків
- •2. Первинна й вторинна структура білка
- •3. Третинна й четвертинна структура білка
- •4. Класифікація білків, хімія простих білків, природні пептиди
- •Лекція № 10-12. Особливості білкового обміну, переварювання білків.
- •1. Особливості білкового обміну
- •2. Особливості переварювання білків, эндопептидазы
- •3. Переварювання білків у шлунку й кишечнику
- •4. Усмоктування продуктів гідролізу білків
- •Лекція № 13-15. Знешкодження аміаку в організмі, орнітіновий цикл, специфічні шляхи обміну амінокислот.
- •1. Знешкодження аміаку в організмі
- •2. Специфічні шляхи обміну амінокислот
- •Лекція № 16-18. Складні білки хромопротеины й нуклеопротеины
- •1. Визначення хромопротеинов. Гемо- і флавопротеины
- •2. Нуклеопротеины й липопротеины
- •3. Фосфопротеины й гликопротеины
- •Властивості імуноглобулінів людину
- •Лекція № 19-21. Хімічний склад і структура нуклеиновых кислот
- •1. Хімічний склад нуклеиновых кислот
- •2. Особливості структури нуклеиновых кислот
- •3. Первинна структура нуклеиновых кислот
- •4. Вторинна й третинна структура нуклеиновых кислот
Лекція № 13-15. Знешкодження аміаку в організмі, орнітіновий цикл, специфічні шляхи обміну амінокислот.
1. Знешкодження аміаку в організмі
Знешкодження аміаку в організмі, що утворюється при дезаминировании амінокислот ( головним чином глутаминовой), меншою мірою при дезаминировании пуринових підстав, біогенних амінів, амідів амінокислот, розпаді пиримидиновых підстав, відбувається наступним шляхом:
відбудовне аминирование відбувається в малому об'ємі аміаку, але забезпечує утвір глутаминовой кислоти;
утвір амідів аспарагіновому й глутаминовой кислот (аспарагина й глутамина) протікає переважно в нервовій тканині, каталізаторами є аспарагинатсинтетаза й глутаминсинтетаза;
утвір амонійних солей відбувається в бруньковій тканині, куди аміак доставляється у вигляді амідів аспарагінової й глутаминовой кислот.
Аміди гидролизуются глутаминазой і аспарагиназой, утворюючи аспартат, глутамат і аміак, який нейтралізується з утвором солей амонію (вони віддаляються із сечею);
синтез сечовини — основний шлях знешкодження й видалення амиака — здійснюється в печінці. Сечовина виводиться із мочой у якості головного кінцевого продукту білкового, відповідно амінокислотного, обміну. На частку мочевины доводиться до 80–85% від усього азота мочи. Основним і, можливо, єдиним місцем синтезу мочевины є печень. Уперше Г. Кребс і К. Гензеляйт в 1932 р. вивели рівняння реакций синтезу мочевины, які представлені у вигляді циклу, що одержав у літературі назва орнитинового цикла мочевинообразования КребсазГензеляйта. Слід указати, що в биохимии це була перша циклічна система метаболизма, опис якої майже на 5 років опеределило відкриття Г. Кребсом іншого метаболического процесу – цикла трикарбоновых кислот. Подальші дослідження в основному підтвердили циклічний характер биосинтеза мочевины у печени. Завдяки дослідженням Г. Коена, С. Ратнер і сотр. були уточнені проміжні етапи й ферментні системи, катализирующие утвір мочевины.
Таким чином, увесь цикл мочевинообразования може бути представлений у такий спосіб. На першому етапі синтезується макроергирческое сполука карбамоилфосфат – метаболически активна форма аммиака, використовувана в якості вихідного продукту для синтезу пи-римидиновых нуклеотидов (відповідно ДНК і РНК) і аргинина (відповідно белка і мочевины):

До теперішнього часу відкрито три різні шляхи синтезу карбамоил-фосфату de novo, катализируемые трьома різними ферментами. Першу необратимую реакцию катализирует регуляторний фермент – аммиакзавиксимая карбамоилфосфатсинтетаза (КФ 6.3.4.16):
![]()
Реакция вимагає витрати двох молекул АТФ, відкрита в митохондриях клеток печени і використовується переважно для синтезу аргинина і мочевины. У цій реакции у якості активного стимулюючого червонийолостерического эффектора діє NаАцетилглутамат.
Другу, також необоротну, реакцию катализирует глутаминзависимая карбамоилфосфатсинтетаза (КФ 6.3.5.5):
![]()
Дана реакция відкрита в цитозоле клеток тварин і вимагає наявності ионов Mg2+. Слід указати, що завдяки включенню гидролитической стадії вона використовується переважно для синтезу пиримидиновых нуклеотидов (см. далі). Фермент широко розповсюджений у клетках тварин.
Третю оборотну реакцию катализирует карбаматкиназа (КФ 2.7.2.2):
![]()
Реакция відкрита в різних микроорганизмов і, можливо, використовується скоріше для ресинтеза АТФ, чим для синтезу карбамоилфосфата.
На другому етапі циклу мочевинообразования відбувається конденсация конденсаціясфата й орнитина с утвором цитруллина; реакцию катализирует орнитиннкарбамоилтрансфераза (КФ 2.1.3.3).
На наступній стадії цитруллин перетворюється в аргинин у результаті двох реакций. Перша з них, энергозавиосимая,– це конденсация цитруллина й аспарагінової кислоты с утвором аргининосукцината (цю реакцию катализирует аргининосукцинатусинтетаза). Аргининосукцинат розпадається в наступній реакции на аргинин і фумарат при участі іншого фермента – аргининосукцинатлиазы. На останньому етапі аргинин розщеплюється на мочевину і орнитин під дією аргінази.
Необхідно підкреслити, що аргіназа втримується в печени тих тварин, які экскретируют із мочой мочевину як основний і кінцевий продукт азотистого обміну. У печени печінцінаприклад, аргіназа відсутня, оскільки птаха замість мочевины виділяють мочевую кислоту. ОрнинТиновый цикл мочевинообразования з урахуванням нових даних представлений на мал. 1
Сумарна реакция синтезу мочевины без обліку всіх проміжних продуктів може бути представлена в наступному виді:

Дана реакция супроводжується зниженням вільної енергії (ΔG0 = –40 кДж), тому процес завжди протікає в напрямку синтезу мочевины. Слід указати, що синтез мочевины енергетично дорого обходиться организму. На синтез однієї молекулы мочевины потрібно
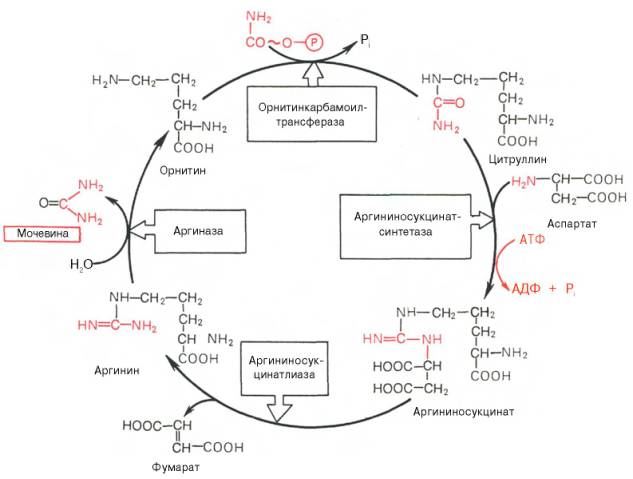
Рис. 1 Орнитиновый цикл синтезу мочевины у печени.
витрата чотирьох високоенергетичні фосфатні груп: дві молекулы АТФ витрачаються на синтез карбамоилфосфата й одна – на утвір аргининоянтарной кислоты, при цьому АТФ розщеплюється на АМФ і РРi, який при гидролизе також утворює дві молекулы Рi.
З наведеної схеми процесу мочевинообразования неважко бачити, що один з атомов азота мочевины має своїм джерелом вільний аммиак ( через карбамоилфосфат); другий атом азота надходить із ас-партата. Аммиак утворюється головним чином у процесі глутаматдедгидрогеназной реакции. У процесі поповнення запасів аспартата беруть участь три сопряженные реакции: сполученіарат під дією фумаразы приєднує воду і перетворюється в малат, який окиснить при участі малатдегидрогеназы с утвором оксалоацетата; останній у реакции трансаминирования с глутаматом знову утворює аспартат.
Враховуючи відомі фактичні дані про механізми обезвреживания аммиака в организме, можна зробити наступний висновок. Частина аммиака використовується на биосинтез аминокислот шляхом восстановительного аминирования α-кетокислот по механизму реакции трансаминирования. Аммиак зв'язується при биосинтезе глутамина і аспарагина. Деяка кількість аммиака виводиться із мочой у вигляді амонійних солей. У формі креатинина, який утворюється із креатину й креатинфосфата, виділяється з организма значна частина азота аминокислот. Найбільша кількість аммиака витрачається на синтез мочевины, яка виводиться із мочой у якості головного кінцевого продукту білкового обміну в организме людину й тварин. Підраховане, що в стані азотистої равновесия организм дорослої здоровішої людину споживає й відповідно виділяє приблизно 15 г азота у добу; з экскретируемого із мочой кількості азота на частку мочевины доводиться близько 85%, креатинина – близько 5%, амонійних солей – 3%, мочевой кислоты – 1% і на інші форми – близько 6%.
У процесі эволюции живі организмы виробили різні типи азотистого обміну. Це аммониотелический тип, при якім головним кінцевим продуктом азотистого обміну є аммиак; він свойствен переважно рибам. При уреотелическом типі обміну основним кінцевим продуктом обміну белков є мочевина; такий тип характерний для людини й тварин. Урикотелический тип характерний для птахів і рептилій; головним кінцевим продуктом даного типу обміну є мочевая кислота.
