
- •Лекція №1 зміст, предмет та задачі дисципліни.
- •Лекція №2-4 природні α-амінокислоти. Будова класифікація стереоізомерія хімічні властивості
- •Лекція №5 білки. Загальні відомості, функції білків
- •Білки загальні відомості.
- •2. Функції білків,зміст білків в органах і тканинах
- •Лекція № 6-9. Фізико-хімічні властивості білків, їх структурна організація, класифікація білків
- •1. Фізико-хімічні властивості білків. Поняття структурної організації білків
- •2. Первинна й вторинна структура білка
- •3. Третинна й четвертинна структура білка
- •4. Класифікація білків, хімія простих білків, природні пептиди
- •Лекція № 10-12. Особливості білкового обміну, переварювання білків.
- •1. Особливості білкового обміну
- •2. Особливості переварювання білків, эндопептидазы
- •3. Переварювання білків у шлунку й кишечнику
- •4. Усмоктування продуктів гідролізу білків
- •Лекція № 13-15. Знешкодження аміаку в організмі, орнітіновий цикл, специфічні шляхи обміну амінокислот.
- •1. Знешкодження аміаку в організмі
- •2. Специфічні шляхи обміну амінокислот
- •Лекція № 16-18. Складні білки хромопротеины й нуклеопротеины
- •1. Визначення хромопротеинов. Гемо- і флавопротеины
- •2. Нуклеопротеины й липопротеины
- •3. Фосфопротеины й гликопротеины
- •Властивості імуноглобулінів людину
- •Лекція № 19-21. Хімічний склад і структура нуклеиновых кислот
- •1. Хімічний склад нуклеиновых кислот
- •2. Особливості структури нуклеиновых кислот
- •3. Первинна структура нуклеиновых кислот
- •4. Вторинна й третинна структура нуклеиновых кислот
2. Первинна й вторинна структура білка
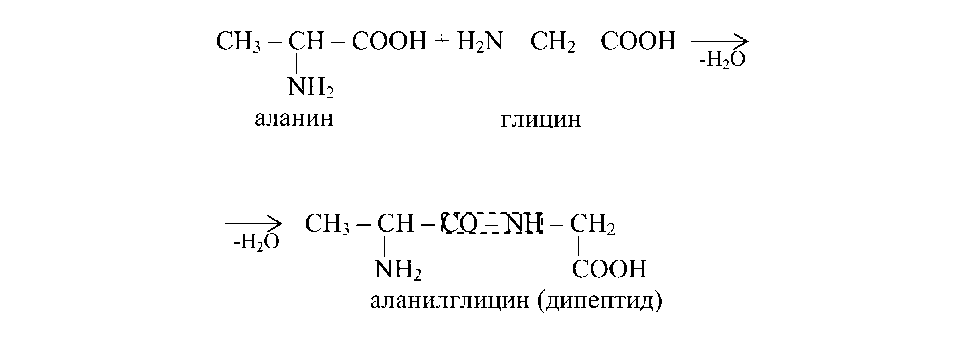
Первинна структура білка — послідовність розташування амінокислотних залишків у поліпептиді. Для визначення первинної структури білка за допомогою гідролізу з'ясовують кількісне співвідношення амінокислот у молекулі білка. Потім визначають хімічну природу кінцевих амінокислот поліпептидному ланцюга, який містить по одній вільної NH2- і CoohрГрупі. Для визначення Nо Кінцевої амінокислоти використовуються метод Сэнджера й фенилгидантоиновый метод, для визначення Зо Кінцевої амінокислоти — метод Акабори.
Первинна структура білка характеризується рядом особливостей.
Первинна структура білка генетично детермінована й унікальна, заміна амінокислот усередині поліпептидного ланцюга приводить до зміни структури й функції білка.
Первинна структура білка стабільна, що забезпечується дипептидными й меншою мірою дисульфидными зв'язками.
Число комбінацій амінокислот у поліпептиді дуже велик послідовності, що повторюються, амінокислот рідкі. Ідентичні послідовності амінокислот можуть зустрічатися в області активних центрів ферментів.
Первинна структура білка детермінує вторинну, третинну й четвертинну структуру білкової молекули.
Вторинна структура білка — конфігурація поліпептидному ланцюга, більш компактне її впакування в спіральну або яку-небудь іншу конформацію. Процес конфігурації йде відповідно до програми, закладеної в первинній структурі білка. Існує дві основні конфігурації поліпептидного ланцюга: αлспіраль і β-сладчатый шар.
//
Діючим початком утвору α- і βрструктури є здатність амінокислот утворювати водневі зв'язки. Стабільність вторинної структури забезпечується в основному водневими й меншою мірою пептидными й дисульфидными зв'язками.
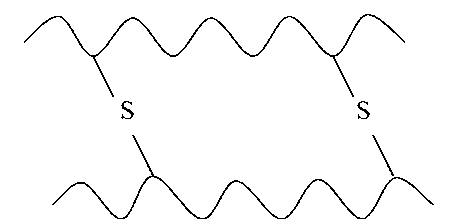
Водневий зв'язок — слабка електростатична взаємодія між електронегативним атомом (O або N) і атомом водню, ковалентно пов'язаним з іншим електронегативним атомом. Основні типи водневих зв'язків:
між ВінпГрупою серина й пептидной зв'язком
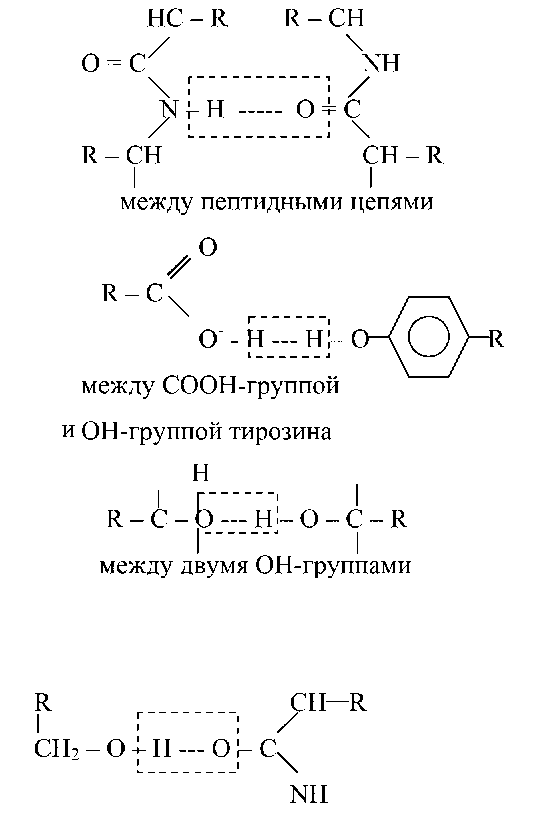
Структурі αлспирали властивий ряд закономірностей. На кожний крок спирали доводиться 3,6 амінокислотних залишку, крок спирали рівний 0,54 нм на виток і 0,15 нм на один амінокислотний залишок. Кут підйому спирали 26, через кожні п'ять витків повторюється структурна конформація поліпептиду. При утворі βрструктури дві або більш лінійні поліпептидні ланцюги, розташовані паралельно або антипаралельно, зв'язуються між собою водневими зв'язками між пептидными зв'язками. У природі встреччаются білки, вторинна структура яких не є ні α-, ні βоструктурою (наприклад, коллаген). У цей час доведене існування двох проміжних рівнів організації білкової молекули між вторинною й третинною структурою — надвторинні структури й структурні домены.
3. Третинна й четвертинна структура білка
Третинна структура білка — це просторова орієнтація поліпептидної спіралі спосіб, що випливає за вторинною структурою, компактизации білкової молекули. Процес укладання поліпептидному ланцюга — фолдинг.
Просторова структура білків залежить від іонної сили й ph розчину, температури й інших факторів. У стабілізації просторової структури білків поряд з ковалентними зв'язками (пептидными й дисульфидными) беруть участь так звані нековалентні зв'язки, до яких ставляться водневі зв'язки, електростатичні взаємодії заряджених груп, вандерваальсовы сили, взаємодії неполярних бічних радикалів амінокислот, гидрофильно-гідрофобні взаємодії й ін. При цьому нековалентні зв'язки відіграють основну роль. Третинна структура білка формується мимовільно й повністю детерминируется первинною структурою білка. Основним рушійним моментом у виникненні тривимірної структури є взаємодія радикалів амінокислот з молекулами води, що полягає в тому, що гідрофобні радикали амінокислот орієнтуються усередину молекули білка, у той час як гідрофільний радикали орієнтуються назовні. У результаті утворюється термодинамически найбільш вигідна конформація молекули білка, що характеризується найменшої вільною енергією. Конформації білків стабільні, основні форми конформаций — TмФорма (tensed — «напружена») і RмФорма (relaxed — «розслаблена»). Тривимірна структура білка містить функціональну інформацію, що визначає всі біологічні властивості білків. Порушення третинної структури білка спричиняє втрату його біологічних властивостей.
Четвертинна структура білка — просторова орієнтація декількох поліпептидних ланцюгів, що володіють власною первинною, вторинною або третинною структурою, з утвором макромолекулярного утвору.
Окремі поліпептидні ланцюги — протомеры (мономери, субъединицы) — не мають біологічну активність і здобувають її при певному способі просторового об'єднання. молекула, що утворювався, є олигомером (мультимером).
Четвертинна структура стабілізується за рахунок нековалентних зв'язків між контактними майданчиками протомеров, комплементарних один одному. Четвертинна структура виявлена в декількох сотень білків. Молекула гемоглобіну являє собою тетрамер — складається із двох α- і двох βеланцюгів. Фермент фосфорилаза a складається із двох ідентичних субъединиц по дві пептидные ланцюги. Фермент лактатдегидрогеназа містить два типи поліпептидних ланцюгів — M (muscle — «м'яз») і B (brain — «мозок») і може існувати в п'яти формах, називаних ізоферментами, або множинними формами ферментів.
