
- •Лекція №1 зміст, предмет та задачі дисципліни.
- •Лекція №2-4 природні α-амінокислоти. Будова класифікація стереоізомерія хімічні властивості
- •Лекція №5 білки. Загальні відомості, функції білків
- •Білки загальні відомості.
- •2. Функції білків,зміст білків в органах і тканинах
- •Лекція № 6-9. Фізико-хімічні властивості білків, їх структурна організація, класифікація білків
- •1. Фізико-хімічні властивості білків. Поняття структурної організації білків
- •2. Первинна й вторинна структура білка
- •3. Третинна й четвертинна структура білка
- •4. Класифікація білків, хімія простих білків, природні пептиди
- •Лекція № 10-12. Особливості білкового обміну, переварювання білків.
- •1. Особливості білкового обміну
- •2. Особливості переварювання білків, эндопептидазы
- •3. Переварювання білків у шлунку й кишечнику
- •4. Усмоктування продуктів гідролізу білків
- •Лекція № 13-15. Знешкодження аміаку в організмі, орнітіновий цикл, специфічні шляхи обміну амінокислот.
- •1. Знешкодження аміаку в організмі
- •2. Специфічні шляхи обміну амінокислот
- •Лекція № 16-18. Складні білки хромопротеины й нуклеопротеины
- •1. Визначення хромопротеинов. Гемо- і флавопротеины
- •2. Нуклеопротеины й липопротеины
- •3. Фосфопротеины й гликопротеины
- •Властивості імуноглобулінів людину
- •Лекція № 19-21. Хімічний склад і структура нуклеиновых кислот
- •1. Хімічний склад нуклеиновых кислот
- •2. Особливості структури нуклеиновых кислот
- •3. Первинна структура нуклеиновых кислот
- •4. Вторинна й третинна структура нуклеиновых кислот
Лекція № 16-18. Складні білки хромопротеины й нуклеопротеины
1. Визначення хромопротеинов. Гемо- і флавопротеины
Хромопротеины — складні білки, що полягають із простого білка й пофарбованого небілкового компонента. Серед них виділяють гемопротеины, магнийпорфирины й флавопротеины. Хромопротеины беруть участь у фотосинтезі, клітинному подиху, окисно-відновних реакціях, забезпечують перенос кисню й вуглекислого газу, свето- і цветовосприятие й ін.
Гемопротеины — це хромопротеины, що містять у якості простетической групи залізо. До них ставляться гемоглобін і його похідні, міоглобін, ферменти (система цитохромів, каталаза й пероксидаза) і хлорофиллсодержащие білки. Гемоглобін — складний білок, що містить у якості білкового компонента глобин, а в якості простетической групи — гем. Гем однаковий у всіх видів гемоглобіну, його основу становить порфириновое кільце.
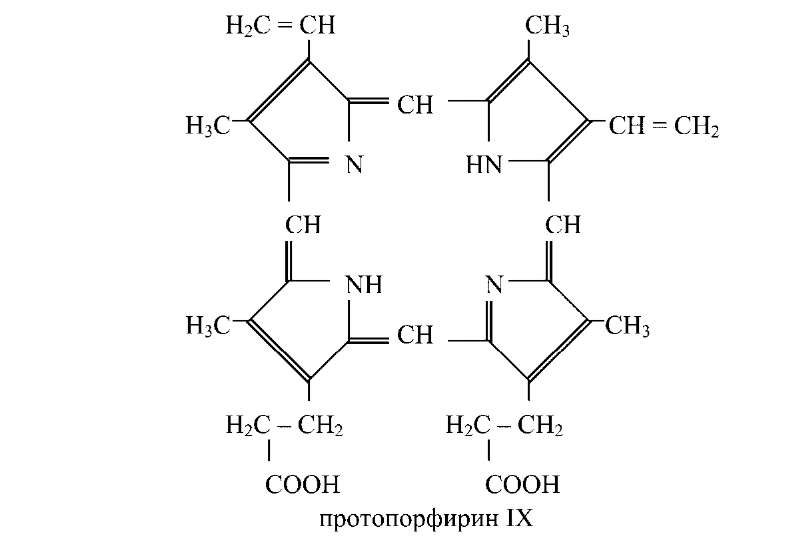

Залізо пов'язане із двома атомами азоту молекули протопор фирина ковалентно й із двома — координаційними зв'язками.
Гем у вигляді гемпорфирина є простетической групою гемоглобіну і його похідних, міоглобіну, каталази, пероксидазы й цитохромів b, c і c1. У цитохромах a і a3 гем утримується у вигляді формилпорфирина. На кожні чотири молекули гема доводиться 1 поліпептидний ланцюг. У молекулі гемоглобіну дорослої людину Hba (з англ. adult — «дорослий») утримуються чотири поліпептидні ланцюги, що становлять білкову частину молекули — глобин: дві РпЛанцюги по 141 амінокислотному залишку й дві αпланцюги по 146 амінокислотних залишків. У крові дорослої людини також утримується Hba2, що полягає із двох δеланцюгів і двох αеланцюгів, а в крові немовляти — Hbf (80%), що полягає із двох αеланцюгів і двох γеланцюгів.
Існує ряд аномальних гемоглобінів, що виникають внаслідок мутацій генів: Hbc, Hbda, Hbde, Hbe, Hbg, Hbg
Hbi, Hbm, Hbo і Hbs. Хвороби гемоглобінів — гемоглобинозы — підрозділяються на гемоглобинопатии (в основі лежить спадкоємне порушення структури ланцюги гемоглобіну) і талассемии (обумовлені спадкоємним порушенням синтезу ланцюги гемоглобіну). Класичний приклад спадкоємної гемоглобинопатии — серповидно-клітинна анемія, при якій Hbs деформує еритроцити, що ухвалюють форму серпа, і приводить до масивного гемолізу. У результаті сполуки молекулярного кисню з гемоглобіном утворюється оксигемоглобін. Кисень приєднується до гему за допомогою координаційного зв'язку заліза. Приєднання однієї молекули кисню до гему полегшує приєднання наступної. Гемоглобін також легко зв'язується із чадним газом з утвором карбоксигемоглобина й з оксидами азоту з утвором метгемоглобіну, що містить іони Fe. Нагромадження цих видів гемоглобіну в крові приводить до зниження постачання тканин кров'ю. Метод якісного визначення похідних гемоглобіну — дослідження їх спектрів поглинання. Трансферрины (сидерофилины) — складні білки, що характеризуються здатністю специфічно, міцно й необоротно зв'язувати іони Fe і інших перехідних металів. Трансферрин сироватки крові транспортує іони Fe у ретикулоциты, де відбувається синтез гемоглобіну.
Флавопротеины — складні білки, простетические групи яких представлені изоаллоксазиновыми похідними — флавинмононуклеотидом (ФМН) і флавинадениндинуклеотодом (ФАД). Флавопротеины входять до складу ферментів, катализирующих окисно-відновні реакції в клітці (оксидоредуктаз). До них ставляться ксантиноксидазы, альдегидоксидазы, сукцинатдегидрогеназы, дигидрооротатдегидрогеназы, ацилекоаедегидрогеназы й транспортуючого електрони флавопротеина.
