
- •Лекція №1 зміст, предмет та задачі дисципліни.
- •Лекція №2-4 природні α-амінокислоти. Будова класифікація стереоізомерія хімічні властивості
- •Лекція №5 білки. Загальні відомості, функції білків
- •Білки загальні відомості.
- •2. Функції білків,зміст білків в органах і тканинах
- •Лекція № 6-9. Фізико-хімічні властивості білків, їх структурна організація, класифікація білків
- •1. Фізико-хімічні властивості білків. Поняття структурної організації білків
- •2. Первинна й вторинна структура білка
- •3. Третинна й четвертинна структура білка
- •4. Класифікація білків, хімія простих білків, природні пептиди
- •Лекція № 10-12. Особливості білкового обміну, переварювання білків.
- •1. Особливості білкового обміну
- •2. Особливості переварювання білків, эндопептидазы
- •3. Переварювання білків у шлунку й кишечнику
- •4. Усмоктування продуктів гідролізу білків
- •Лекція № 13-15. Знешкодження аміаку в організмі, орнітіновий цикл, специфічні шляхи обміну амінокислот.
- •1. Знешкодження аміаку в організмі
- •2. Специфічні шляхи обміну амінокислот
- •Лекція № 16-18. Складні білки хромопротеины й нуклеопротеины
- •1. Визначення хромопротеинов. Гемо- і флавопротеины
- •2. Нуклеопротеины й липопротеины
- •3. Фосфопротеины й гликопротеины
- •Властивості імуноглобулінів людину
- •Лекція № 19-21. Хімічний склад і структура нуклеиновых кислот
- •1. Хімічний склад нуклеиновых кислот
- •2. Особливості структури нуклеиновых кислот
- •3. Первинна структура нуклеиновых кислот
- •4. Вторинна й третинна структура нуклеиновых кислот
3. Переварювання білків у шлунку й кишечнику
Панкреатичний сік має слабощелочную реакцію, містить неактивні попередники протеаз: трипсиноген, химотрипсиноген прокарбоксипептидазы А, У и проэластазу. Слизова кишечнику виробляє энтеропептидазу, яка перетворює трипсиноген у трипсин. Трипсин забезпечує аутокатализ і активує всі неактивні попередники протеаз панкреатичного соку. Энтеропептидаза виділяється у вигляді попередника киназогена. Активація трипсиногена відбувається шляхом відщіплення NгКінцевого гексапептида, активація химотрипсина — шляхом розщеплення однієї пептидной зв'язки з наступною перебудовою молекули й формуванням активного центру в ній. Трипсин гидролизует у поліпептидах пептидные зв'язки, утворені гідроксильними групами аргініну й лізина, химотрипсин розщеплює пептидные зв'язки, утворені карбоксильными групами фенилаланина, тирозину й триптофану. Пепсин підсилює дія й приводить до більш глибокого розщеплення білків. Экзопептидазы (экзопептидазы) беруть активну участь у переварюванні білків у тонкому кишечнику. Карбоксипептидаза А швидко розщеплює ЗыКінцеві амінокислоти з ароматичними або алифатическими бічними ланцюгами; карбоксипептидаза В діє на пептиди, що мають ІзыКінцеві залишки аргініну й лізина.
Эластаза — эндопептидаза, синтезується в підшлунковій залозі, перетворення проферменту катализируются трипсином, переважно гидролизует пептидные зв'язки, утворені амінокислотами з невеликими гідрофобними радикалами, зокрема гліцином, аланином, серином. Ферменти, гидролизующие пептиди, функціонують переважно внутриклеточно. Кінцевий результат дії протеолитических ферментів шлунку й кишечнику — розщеплення харчових білків до вільних амінокислот.
4. Усмоктування продуктів гідролізу білків
Кінцевий результат дії протеолитических ферментів шлунку й кишечнику — розщеплення практично всієї маси харчових білків до вільних амінокислот.
Усмоктування вільних амінокислот з кишечнику відбувається досить швидко — максимальний приріст їх змісту в крові відбувається через 30—50 хв послу прийому до їжі білка. Усмоктування відбувається головним чином у тонкому кишечнику, це активний процес зі споживанням енергії.
Основний механізм транспорту амінокислот через клітинні мембрани — гамма-глутамильный цикл за участю шести ферментів (один з них мембраносзв'язаний, інші перебувають у цитозоле) і трипептид глутатион (гамма-глутамилцистеинилглицин).
Ключовий фермент процесу— гамма-глутамилтрансфераза, катализирующая перенос глутамильного залишку глутатиона на кислоту, що транспортується:

Вільна амінокислота, що участвующая в цій реакції, надходить із зовнішньої поверхні клітини, глутатион перебуває усередині. Після реакції глутамиламинокислота виявляється в клітині разом із цистеинилглицином.
Далі ця кислота розщеплюється ферментом цитозоля глутамиламинотрансферазой:
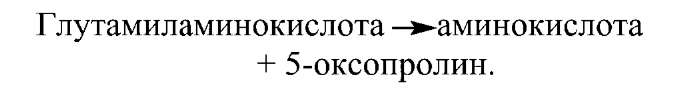
Одночасно відбувається гідроліз цистеинилглицина на цистеин і гліцин. У підсумку молекула амінокислоти виявляється в цитозоле. Вступ енергії, необхідної для переносу, забезпечується за рахунок гідролізу двох пептидных зв'язків у глутатионе на першій і другій стадії процесу.
Перенос однієї молекули супроводжується споживанням однієї молекули глутатиона. Для продовження процесу глута- тион регенерує в ході трьох послідовних перетворень:

Першу реакцію катализирует оксопролиназа, другу — глутамилцистеинсинтетаза, третю — глутатион-синтетаза. У реакції використовуються три молекули АТФ. Усмоктувані амінокислоти попадають у портальний кровоток, печінка, загальний кровоток. Особливо інтенсивно поглинають амінокислоти печінка й бруньки, а мозок вибірково швидко — метіонін, цистидин, гліцин, аргінін, глутамин, тирозин. Мікрофлора кишечнику має у своєму розпорядженні набір ферментних систем, катализирующих різноманітні перетворення харчових амінокислот, не властивих організму людину, завдяки чому створюються оптимальні умови для утвору отрутних продуктів розпаду амінокислот — фенолу, індолу, крезолу, скатолу, сірководню, метилмеркаптана.
Усі ці перетворення амінокислот називаються гниттям. Розпад серосодержащих амінокислот (аминокислотцистеина, метіоніну) приводить до утвору сірководню, метилмеркаптана. Диамино- кислоти (орнитин, лізин) зазнають декарбоксилированию з утвором амінів, відповідно путресцина й кадаверина. З ароматичних амінокислот — фенилаланина, тирозину, триптофану при бактеріальному декарбоксилировании утворюються аміни: фенилэтиламин, тирамин, триптамин. Мікробні ферменти кишечнику руйнують бічні ланцюги циклічних амінокислот, тирозину й триптофану з утвором отрутних продуктів обміну, відповідно крезолу й фенолу, скатолу, індолу.
Після усмоктування ці продукти через воротную вену попадають у печінку, де зазнають знешкодженню шляхом хімічного зв'язування із сарною або глюуроновой кислотою з утвором нетоксичних кислот.2. Проміжний обмін амінокислот
Розщеплення амінокислот, що не використовуються в процесі біосинтезу, дезаминирование, трансаминирование, декарбок силирование.
Дезаминирование, або відщіплення, аміногрупи катализируется оксидазами амінокислот, ці ферменти катализируют дезаминирование, що супроводжується окисненням (окисне дезаминирование).
![]()
Аминооксидазы специфічні й малоактивні, єдиним високоактивний фермент — глутаматдегидрогеназа, широко представлена в печінці й мозку, катализирует перетворення глутаминовой кислоти в αукетоглутаровую.
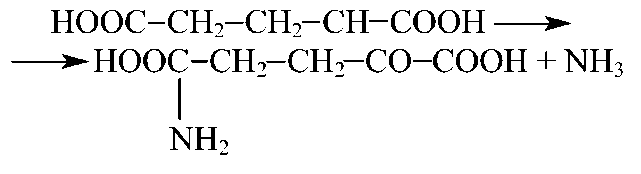
Переаминирование амінокислот — реакція, у якій відбувається обмін аміногрупи на кетогруппу між амінокислотою й кетокислотою.
Так, глутаминовая кислота, взаємодіючи з пировиноградной без проміжного утвору аміаку, перетворюється в αукетоглутаровую, а пировиноградная — в аланин.
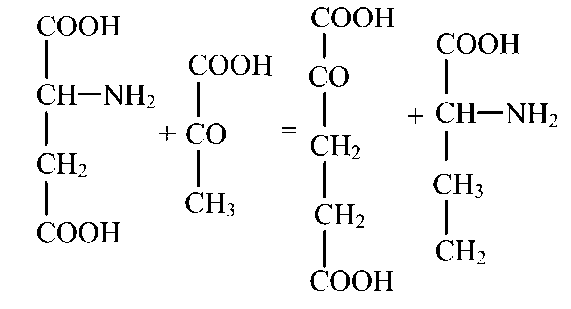
Ферменти, катализирующие цю реакцію, утримуються в м'язах, мозку, серці, печінці, вони специфічні, головні з них — глутамат-пируваттрансаминаза й аспартат-пируваттрансаминаза.
Кофермент трансаминаз — похідне пиридоксаля (вітаміну В6) — пиридоксальфосфат, який, взаємодіючи в складі трансаминазы з амінокислотою, ухвалює на себе аміногрупу. Потім він перетворюється в пиридоксаминфосфат, який передає аміногрупу αткетокислоті, перетворюючи її в амінокислоту й відновлюючись у вигляді пиридоксальфосфата. Прореагировавшая амінокислота, втрачаючи аміногрупу, переходить у кетокислоту. Мають значення дві реакції переаминирования:
амінокислота + αакетоглутаровая кислота — αткетокислота + глутаминовая кислота, яка активно утягується в дезаминирование з перетворенням у кетоглутаровую кислоту, і вивільняється аміак;
амінокислота + щавлево-оцтова кислота — αткетокислота + аспарагінова кислота, яка. Як і аміак, бере участь в утворі сечовини.
Кетокислоти, що утворюються при переаминировании, залежно від структури, служать попередниками глюкози й глікогену або кетонових тел. У результаті переаминирования з амінокислот утворюються кетокислоти — вуглецеві кістяки амінокислот, які утягуються в цикл трикарбонових кислот: аланин, гліцин, лейцин, серин, треонин, лізин, триптофан — через ацетилткоа; фенилаланин і тирозин — через ацетилткоа безпосередньо у фумарат; аргінін, гистидин, глутамин, глутаминовая кислота, пролин — в 2аоксоглутарат; аспарагин і аспарагінова кислота — в оксалоацетат; валин і метіонін — у сукцинол-Коа.
Розщеплюючись у ЦТК до вуглекислоти й води, амінокислоти вивільняють стільки ж енергії, скільки глюкоза. При інтенсивному розпаді амінокислот за рахунок посиленого утвору ацетилткоа прискорюється синтез кетонових тіл у печінці. Проміжний продукт розпаду амінокислотних радикалів (оксалоацетат) може використовуватися в процесі глюконеогенеза.
Декарбоксилирование амінокислот — реакція, катализируемая декарбоксилазами:
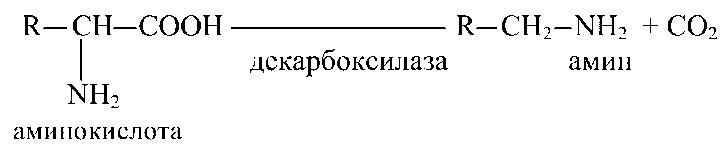
Аміни (продукти декарбоксилирования) мають високу біологічну активність, до цієї групи з'єднань ставляться багато медіаторів.
Гамма-аминомасляная кислота утворюється в результаті декарбоксилирования глутаминовой кислоти, катализируемой глутаматдекарбоксиазой, кофермент якої (фосфопиридоксаль) в основному утворюється в тканині головного мозку. Вона є гальмівним медіатором у нервовій системі. Вона викликає перехід іонів хлору в постсинаптическую мембрану, що тягне гіперполяризацію постсинаптической мембрани, і сигнал від збудливого нерва не досягає граничного рівня.
Усувається гамма-аминомасляная кислота в реакції переаминирования з αокетоглутаратом, що веде до утвору сукцината, що включається в ЦТК.
Гистамин — продукт декарбоксилирования гистидина, катализируемого специфічної декарбоксилазой, яка поширена в гладких клітинах, усувається гистамин диаминооксидазой, що перетворює його в альдегід і аміак.
У гладких клітинах гистамин пов'язаний з білками, вивільняється під дією либераторов. У слизовій шлунку гистамин активує секрецію пепсиногена й соляної кислоти, у більших кількостях вивільняється з депо при шоку, у зоні запалення. Це сильний судинорозширювальний агент, медіатор алергійних реакцій.
Серотонин ( 5-окситриптамин) утворюється із триптофану в результаті його гидроксилирования триптофанк5кмонооксигеназой (кофактор — тетрагидроптеридин) в 5аокситриптофан з наступним декарбоксилированием під дією окситриптофанздекарбоксилазы. Утворюється переважно нейронами гіпоталамуса й стовбура мозку. Функціонує як медіатор цих нейронів, аксони яких закінчуються на нейронах багатьох інших відділів головного й спинного мозку, на провідних шляхах. Вони мають відношення до процесів сну й сенсорного сприйняття. Серотонин взаємодіє з αмрецепторами пре- і постсинаптической мембран. Його антагоніст на рівні постсинаптичесой мембрани — диэтиламид лизергиновой кислоти — сильний галюциноген. Серотонин — сильний судинозвужувальний агент, підвищує згортання крові. Усувається під дією моноаминооксидазы: відбувається окиснення до альдегіду й далі до оксииндолуксусной кислоти.
Дофамин (3, 4-диоксифенилэтиламин) — похідне тирозину. Під дією тирозиназы тирозин гидроксилируется в положенні З-3, перетворюючись в 3, 4идиоксифенилаланин (ДОФА). Він декарбоксилируется декарбоксилазой ароматичних амінокислот, перетворюючись у дофамин — медіатор ингибирующего типу одного з великих провідних шляхів (тіла нейронів, що утворюють ці шляхи, перебувають у чорній субстанції верхнього відділу стовбура мозку, а аксони утворюють густу мережу в смугастім тілі).
Дофамин — також медіатор нейронів, аксони яких закінчуються в лимбических структурах переднього мозку й зонах деяких, що контролюють вивільнення, гипоталамических гормонів. Дофамин — попередник меланина, норадреналина, адреналіну.
Таурин — амін, що утворюється із цистеина, бере участь в утворі конъюгированных жовчних кислот, можливо, виконує медиаторную функцію на рівні синапсов.
Норадреналин утворюється з дофамина під дією дофамин- 3-монооксигеназы, катализирующей гидроксилирование βгвуглецевого атома бічного ланцюга (у реакції беруть участь аскорбінова кислота й молекулярний кисень). Норадреналин виконує роль медіатора в постганглионарных волокнах симпатичної нервової системи, що приводить до нагромадження цамф і активації киназы, катализирующей фосфорилирование білка в постсинаптической тканини, змінюючи активність ферментів.
Адреналін — продукт N-Метилювання норадреналина фенилеталонаміну-метилтрансферазой.
Як і норадреналин, адреналін активує аденилатциклазу, запускаючи розщеплення глікогену й липолиз.
Трансметилирование — перенос одновуглецевого фрагмента (-СН3).
Рухлива СН3 група метіоніну, донором якої служить похідне метіоніну ( S-Аденозілметіонин, що утворюється з метіоніну й АТФ), який бере участь у метилюванні ряду субстратів, забезпечує синтез біологічно активних сполук.
