
- •Лекція №1 зміст, предмет та задачі дисципліни.
- •Лекція №2-4 природні α-амінокислоти. Будова класифікація стереоізомерія хімічні властивості
- •Лекція №5 білки. Загальні відомості, функції білків
- •Білки загальні відомості.
- •2. Функції білків,зміст білків в органах і тканинах
- •Лекція № 6-9. Фізико-хімічні властивості білків, їх структурна організація, класифікація білків
- •1. Фізико-хімічні властивості білків. Поняття структурної організації білків
- •2. Первинна й вторинна структура білка
- •3. Третинна й четвертинна структура білка
- •4. Класифікація білків, хімія простих білків, природні пептиди
- •Лекція № 10-12. Особливості білкового обміну, переварювання білків.
- •1. Особливості білкового обміну
- •2. Особливості переварювання білків, эндопептидазы
- •3. Переварювання білків у шлунку й кишечнику
- •4. Усмоктування продуктів гідролізу білків
- •Лекція № 13-15. Знешкодження аміаку в організмі, орнітіновий цикл, специфічні шляхи обміну амінокислот.
- •1. Знешкодження аміаку в організмі
- •2. Специфічні шляхи обміну амінокислот
- •Лекція № 16-18. Складні білки хромопротеины й нуклеопротеины
- •1. Визначення хромопротеинов. Гемо- і флавопротеины
- •2. Нуклеопротеины й липопротеины
- •3. Фосфопротеины й гликопротеины
- •Властивості імуноглобулінів людину
- •Лекція № 19-21. Хімічний склад і структура нуклеиновых кислот
- •1. Хімічний склад нуклеиновых кислот
- •2. Особливості структури нуклеиновых кислот
- •3. Первинна структура нуклеиновых кислот
- •4. Вторинна й третинна структура нуклеиновых кислот
Лекція №2-4 природні α-амінокислоти. Будова класифікація стереоізомерія хімічні властивості
Α-Амінокислоти є мономерними одиницями біополимерів - пептидів та білків. Білки - основа всього живого. Функції білків у природі різноманітні. Це ферменти й гормони, що виконують регуляторну функцію, структурні білки (кератин, коллаген), транспортні (гемоглобін), захисні (імуноглобуліни). Деякі амінокислоти використовуються як лікарські засоби, наприклад, глутаминова кислота - при захворюваннях ЦНС, метіонін - для лікування захворювань печінки, цістеїн - як радіопротектор, а також в очній практиці.
У природі у вільному й зв'язаному виді виявлені сотні амінокислот, 20-25 з них постійно зустрічаються у всіх білках.
Будова й класифікація природних αоамінокислот
Загальна формула αоамінокислот (виключення - пролін і оксипролін):
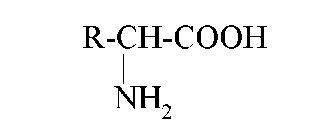
В основному використовують тривіальні назви α- амінокислот. У біохімії часто користуються скороченими трибуквеними назвами.
Згідно із загальною формулою, амінокислоти відрізняються лише будовою радикала, відповідно до чого вони класифікуються на алифатичні, ароматичні й гетероциклічні. Серед алифатичних амінокислот залежно від наявності в радикалів функціональної групи виділяють підгрупи гидрокси- і сірковмісних амінокислот.
Приклади алифатичних амінокислот:

Прикладами ароматичних амінокислот є фенилаланін і тирозин:
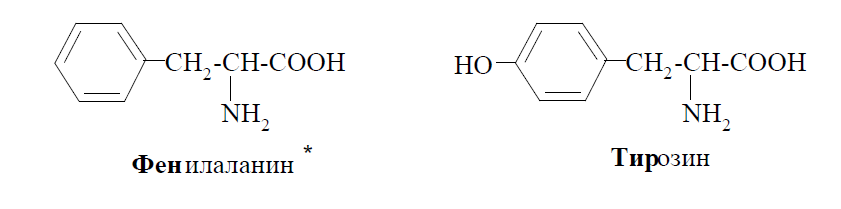
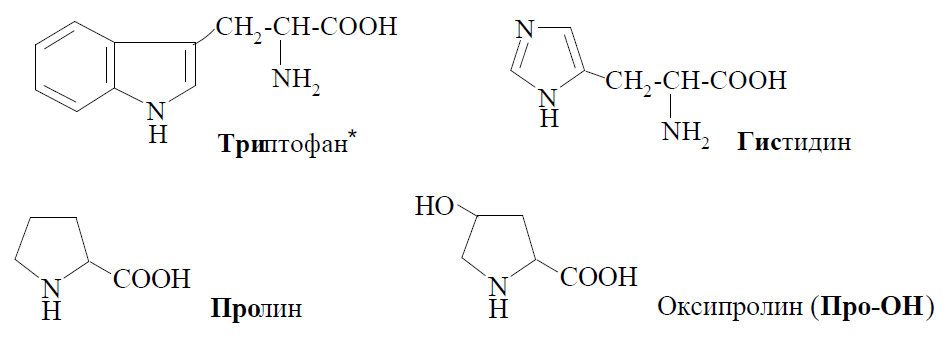
До гетероциклічних амінокислот ставляться:
Залежно від співвідношення кількості карбоксильних і аміногруп у молекулах розрізняють нейтральні (моноаміномонокарбонові) - гліцин, аланин і ін., кислі (моноамінодикарбонові) - аспарагінова, глютаминовая кислоти, основні (диаміномонокарбонові) амінокислоти - лізин, орнітин, аргінін.
Природа радикала в молекулах амінокислот значно впливає на властивості білків. Наприклад, наявність полярних груп (-SH, NH2, -OH, COOH, фенольного гідроксилу) збільшує розчинність білків. Крім того, ці групи беруть участь в утворі зв'язків, що формують просторову структуру білка. За рахунок карбоксильной і аміногрупи багато ферментів забезпечують кислотний або основный каталіз ряду біохімічних процесів. Більшість αоамінокислот синтезується в організмі, але деякі організм не здатний синтезувати, вони повинні надходити з їжею. Ці амінокислоти називають незамінними, у нормі їх вісім: валин, лейцин, ізолейцин, треонин, метіонін, фенилаланин, триптофан, лізин.
Стереоізомерія α-амінокислот
Усі αтамінокислоти, за винятком гліцину, мають у своїй структурі хоча б один хиральный центр, виходить, для них характерна оптична ізомерія. Наприклад, аланин існує у вигляді пари энантиомеров:
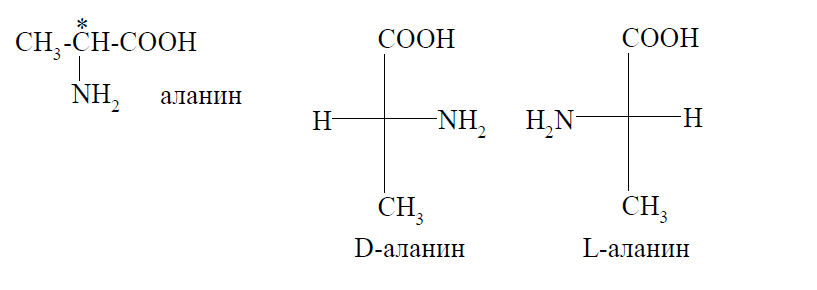
Відносна конфігурація стереоізомерів визначається в порівнянні з конфігураційним стандартом - стереоізомерами гліцеринового альдегіду.
Усі αтамінокислоти, що участвующие в побудові молекул білків тварин і людину, мають LиКонфігурацію. D-амінокислоти зустрічаються в деяких грибах і мікроорганізмах.
αтамінокислоти являють собою кристалічні речовини з високою температурою плавлення, розчинні у воді, але не розчинні в неполярних розчинниках. Ці властивості результат того, що й у кристалічному стані, і у водяних розчинах амінокислоти існують у вигляді біполярних іонів ( цвиттереіонів). Можливість утвору біполярних іонів пов'язана з амфотерностью амінокислот, у молекулах яких присутні й кислотні CООН групи, і основні NH2 групи. Близькість цих груп в αоамінокислот полегшує перехід протона від карбоксильної групи.
Практично αтамінокислоти у водяному розчині існують у вигляді рівноважної суміші зі цвиттер-іонів, катіонної й аніонної форм:
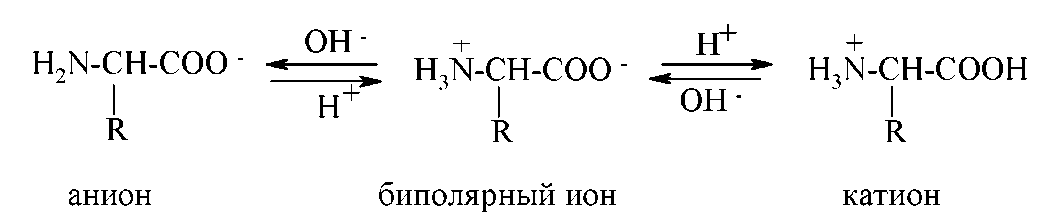
Положення такої рівноваги суттєво залежить від pН середовища: у сильнокислому середовищі (pН=1-2) переважає катіонна форма, у сильнолужному (pН=13-14) - аніонна.
Якщо помістити розчин амінокислоти в електричне поле, то в кислих розчинах вона буде мігрувати до катода, а в лужних - до анода. При деякому значенні ph, характерному для даної амінокислоти, вона не буде переміщатися в електричнім полі. Це значення pН, має назву Ізоэлектрична крапкою (ІЕК, pi), амінокислота існує у вигляді біполярного іона й у цілому электронейтральна. Отже, изоэлектрична крапка амінокислоти - це те значення ph розчину, при якім більшість молекул даної амінокислоти існують у вигляді біполярних іонів, а концентрації аніонної й катіонної форм мінімальні й рівні. Изоэлектрична крапка залежить від співвідношення кислотних і основних груп у молекулі: у кислих амінокислот має значення <7, у основних амінокислот >7.
При пропусканні електричного струму через розчин, що містить суміш амінокислот, кожна з них буде рухатися до катода або анода зі швидкістю, що залежить від природи амінокислоти й pН середовища. Це явище використовують для поділу й аналізу суміші амінокислот методом електрофорезу.
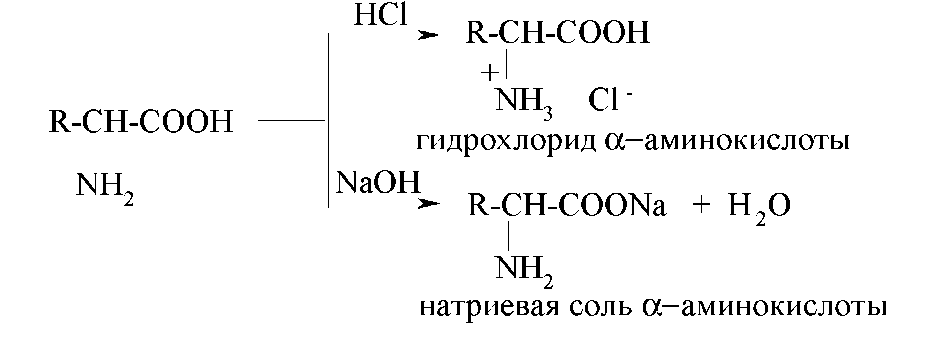
Хімічні властивості Будучи амфотерними сполуками, амінокислоти реагують і з кислотами, і з лугами:
Характерною рисою αоамінокислот є здатність утворювати комплексні солі з іонами важких металів:
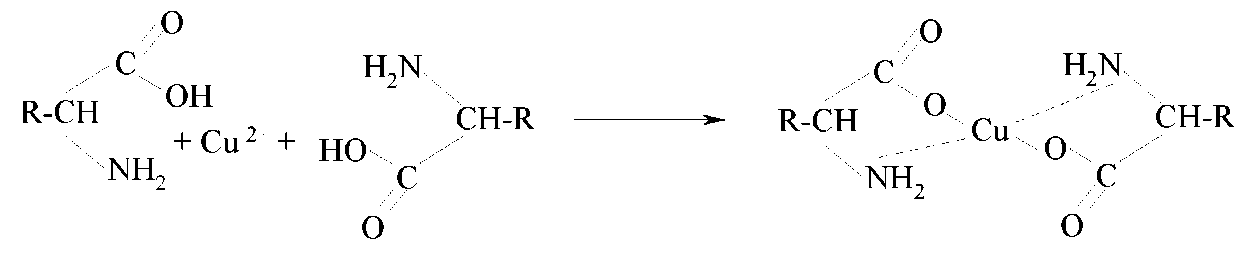
Мідні солі амінокислот нерозчинні у воді, мають інтенсивне синє фарбування. Ця реакція використовується для виявлення αоамінокислот.
Іншою загальною якісною реакцією αоамінокислот є їхня взаємодія з нінгидрином з утвором продукту синьо-фіолетового цвіту:
Як
карбонові кислоти, αтамінокислоти
утворюють
складні ефіри при взаємодії
зі
спиртами й хлорангидриды
при взаємодії
з тионилхлоридом
або хлоридами фосфору: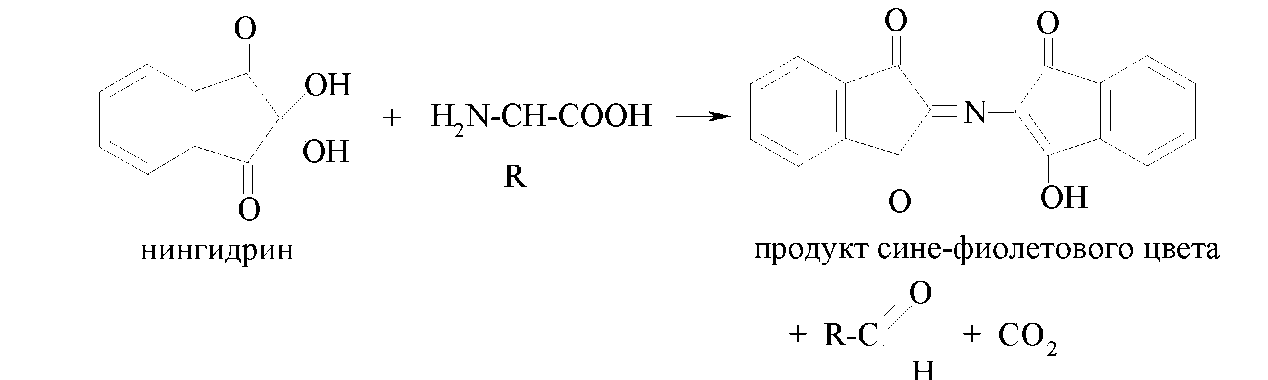

Складні ефіри αоамінокислот летучі, вони мають порівняно низькі температури кипіння. Це їхня властивість використовується для поділу суміші амінокислот у білкових гидролізатах (ефірний метод Фішера). Із цією метою амінокислоти спочатку етерифікують, а потім піддають перегонці.
За рахунок аміногрупи αтамінокислоти зазнають реакціям ацилирования й алкилирования, взаємодіють із оксо- сполуками. Так, при ацилировании амінокислоти оцтовим ангідридом утворюється N-Ацетильне похідне. При взаємодії з формальдегідом утворюється продукт нуклеофильного приєднання – N-Метилольне похідне, яке досить стійко (з іншими оксосполуками протікає реакція нуклеофильного приєднання-відщіплення).
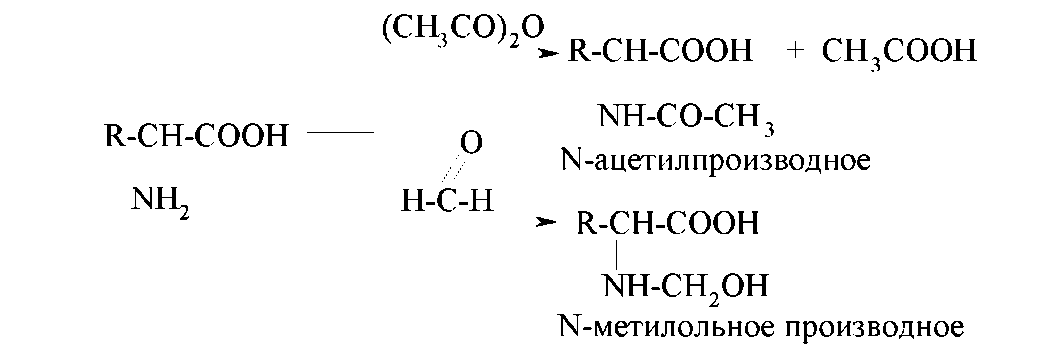
Реакцію ацилирования раніше використовували для захисту аміногрупи в синтезі пептидів. Реакція з формальдегідом лежить в основі методу кількісного аналізу амінокислот (метод формольного титрування, метод Зеренсена). Сутність методу формольного титрування полягає в наступному: до взаємодії з формальдегідом розчини більшості амінокислот мають реакцію, близьку до нейтральної; NоМетилольное похідне проявляє кислотні властивості й може бути оттитровано розчином лугу з відомою концентрацією.
Як первинні алифатические аміни αтамінокислоти зазнають дії азотистої кислоти з утвором відповідних αооксикислот і виділенням азоту:
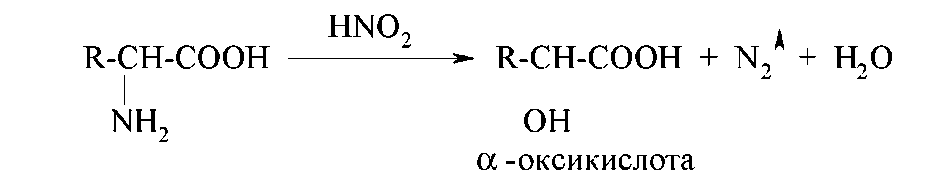
Цю реакцію називають реакцією дезаминирования in vitro. Її використовують і як якісну реакцію для доказу наявності первинної алифатической аміногрупи (спостерігають виділення пухирців газу), і для кількісного аналізу (метод ВанаСлайка) - за обсягом азоту, що виділився, розраховують кількість амінокислоти, що вступила в реакцію.
Специфічною властивістю αоамінокислот є їхня здатність до декарбоксилированию при нагріванні в присутності гидроксида барію:
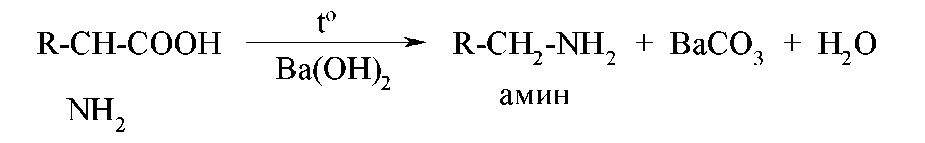
Розглянуті вище реакції характерні для всіх α- амінокислот.
Існують також реакції на певні групи амінокислот.
Серосодержащие амінокислоти (цистеин цистин, метіонін) виявляють по реакції з ацетатом свинцю (реакція Фоля).
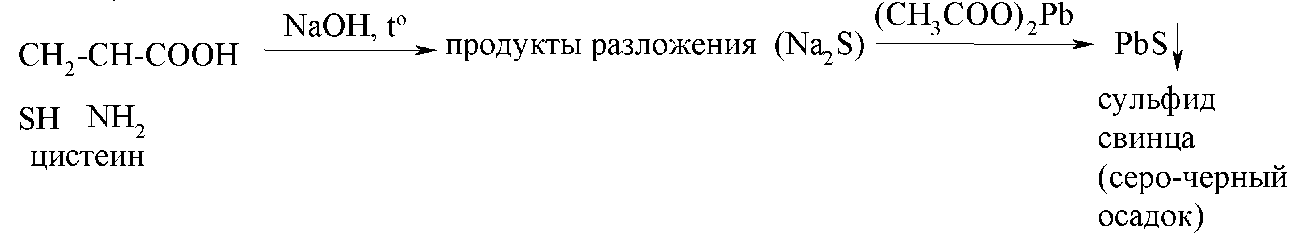
При нагріванні з лугом серосодержащие амінокислоти розкладають, одним із продуктів розкладання є сульфід натрію. При подальшім додаванні ацетату свинцю утворюється осад сульфіду свинцю сіро-чорного цвіту.
Для виявлення ароматичних амінокислот використовують так звану ксантопротеиновую реакцію. При нагріванні цих амінокислот (або білків, у структурі яких присутні їхні залишки) з концентрованою азотною кислотою утворюються продукти нитрования жовтого цвіту, які в лужнім середовищі здобувають жовтогаряче фарбування: /
