
- •Лекція №1 зміст, предмет та задачі дисципліни.
- •Лекція №2-4 природні α-амінокислоти. Будова класифікація стереоізомерія хімічні властивості
- •Лекція №5 білки. Загальні відомості, функції білків
- •Білки загальні відомості.
- •2. Функції білків,зміст білків в органах і тканинах
- •Лекція № 6-9. Фізико-хімічні властивості білків, їх структурна організація, класифікація білків
- •1. Фізико-хімічні властивості білків. Поняття структурної організації білків
- •2. Первинна й вторинна структура білка
- •3. Третинна й четвертинна структура білка
- •4. Класифікація білків, хімія простих білків, природні пептиди
- •Лекція № 10-12. Особливості білкового обміну, переварювання білків.
- •1. Особливості білкового обміну
- •2. Особливості переварювання білків, эндопептидазы
- •3. Переварювання білків у шлунку й кишечнику
- •4. Усмоктування продуктів гідролізу білків
- •Лекція № 13-15. Знешкодження аміаку в організмі, орнітіновий цикл, специфічні шляхи обміну амінокислот.
- •1. Знешкодження аміаку в організмі
- •2. Специфічні шляхи обміну амінокислот
- •Лекція № 16-18. Складні білки хромопротеины й нуклеопротеины
- •1. Визначення хромопротеинов. Гемо- і флавопротеины
- •2. Нуклеопротеины й липопротеины
- •3. Фосфопротеины й гликопротеины
- •Властивості імуноглобулінів людину
- •Лекція № 19-21. Хімічний склад і структура нуклеиновых кислот
- •1. Хімічний склад нуклеиновых кислот
- •2. Особливості структури нуклеиновых кислот
- •3. Первинна структура нуклеиновых кислот
- •4. Вторинна й третинна структура нуклеиновых кислот
Лекція № 6-9. Фізико-хімічні властивості білків, їх структурна організація, класифікація білків
1. Фізико-хімічні властивості білків. Поняття структурної організації білків
Характерними фізичними властивостями білків є висока в'язкість розчинів, обмежена здатність до дифузії, здатність до значного набрякання, оптична активність, рухливість в електричнім полі. Білки мають велику гидрофильностью, чим обумовлене високе онкотическое тиск білків. Розчини білків мають низьке осмотическое тиск.
Білки здатні до поглинання ультрафилетового випромінювання з довжиною хвилі менш 280 нм.
Білкові молекули мають велику молекулярну масу (6000—1 000 000) і не здатні проникати через напівпроникні штучні мембрани й біомембрани здоровіших живих організмів.
Форма білкових молекул
У природі існує два види білкових молекул: ниткоподібні (фибриллярные) і кулясті (глобулярні). Фізико-хімічні й біологічні властивості білків у вільнім або зв'язаному стані визначаються їхньою просторовою структурою.
Денатурація білків — порушення загального плану будови білкової молекули, що приводить до втрати характерних для неї властивостей під впливом різних фізичних і хімічних факторів. Зовні денатурація проявляється втратою розчинності, підвищенням в'язкості, різким зниженням біологічної активності білка.
Ренатурация білка (зворотний процес із повним відновленням структури й функції молекули білка) можлива при нетривалій дії денатурирующего агента. Денатурація необоротна при порушенні первинної структури білка.
Изоэлектрическая й изоионная крапки білків
Значення ph розчину, при якім сумарний заряд білкових молекул дорівнює нулю, — це изоэлектрическая крапка білка (pi). Вона визначається амінокислотним складом білка. В изоэлектрической крапці білки найменш стійкі в розчині, легко осаджуються.
Изоионный розчин білка — розчин, що містить тільки іонізовані залишки амінокислот і іони, що утворюються при дисоціації води.
Изоионной крапкою білка називається значення ph изоионного розчину цього білка.
Поняття про структурну організацію білка Поліпептидна теорія
Поліпептидна теорія розвинена й експериментально доведена Є.Фишером (1902-1919) на основі висловленого раніше А.Я. Данилевським припущення, що пептидная група є основним зв'язком у білковій молекулі.
Особливості пептидной зв'язки.
1. Амінокислоти з'єднуються в поліпептидні ланцюги в реакції поліконденсації з утвором пептидной зв'язки за рахунок αокарбоксильной
групи однієї амінокислоти й αпаміногрупи іншої.
2. Повторювані групи –NH-CH-CO- утворюють пептидный ост.
Атоми N і С у ньому розташовуються приблизно в одній площині, а атоми Н и радикали -CH-R угруповань спрямовані до цієї площини під кутом 109°. При цьому в сусідніх амінокислотних залишках розташування атомів Н и радикалів (R) протилежно.

3. Пептидная зв'язок є проміжним між простий і подвійний зв'язками, тому що відстань між С и N у ній менше (0,1325 нм), чому між Сα і N тієї ж ланцюга (0,146 нм). Але воно більше, ніж відстань між С и N, з'єднаних подвійний зв'язком (0,127нм). Тому по місці пептидных зв'язків легко здійснюється перегрупування атомів і перехід пептидной зв'язки з кето-форми в енольную, яка відрізняється підвищеною реакційною здатністю.
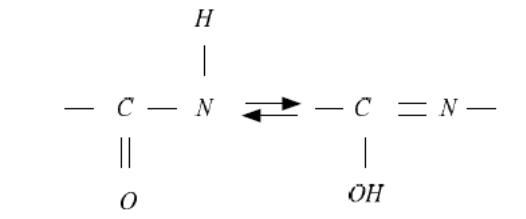
4. Обертання навколо З – N зв'язки є заборонним. Тому всі чотири атоми пептидной зв'язки лежать в одній площині, утворюючи досить тверду планарную ( площинну) структуру. Однак можливе обертання між N і сусіднім Сα (зв'язок N - Сα ) і З пептидной зв'язки й сусіднім Сα (зв'язок ЗсСα). Завдяки цьому лінійна структура поліпептидного ланцюга може здобувати більш складну просторову конфігурацію.
5. Пептидная зв'язок має трансуконфігурацію, т.е СαоАтоми розташовуються по різні сторони від пептидной зв'язки. Така структура енергетично більш вигідна. Утворюються міцні ковалентні зв'язки, що формують енергетичний кістяк молекули.
6. Кожна пептидная зв'язок може утворювати по два водневі зв'язки з іншими групами, у тому числі пептидными. Виключення становлять пептидные зв'язки, в утворі яких бере участь пролин (формується один водневий зв'язок). Там, де перебуває пролин, поліпептидний ланцюг легко звивається.
Полімери, що полягають із амінокислот, утворюють пептиди або білки залежно від числа вхідних у них аминокислоных залишків. Але перехід від пептиду до просторово структурованої молекули білка визначається не механічним подовженням ланцюга, а специфічною послідовністю амінокислот. До білок відносять поліпептиди, здатні мимовільно формувати й утримувати певну просторову структуру. Таким чином, відмітна ознака білків – це самоскладання просторової структури, стабілізація якої вимагає добре розвитому системи нековалентних взаємодій. Це може бути досягнуте лише починаючи з деякої довжини поліпептидного ланцюга.
Лінійна послідовність розташування амінокислот у поліпептиді являє собою первинну структуру білка.
Усього існує чотири рівні структурної організації білка — первинна, вторинна, третинна й четвертинна структура. Структура більшості білків складається із трьох рівнів.
