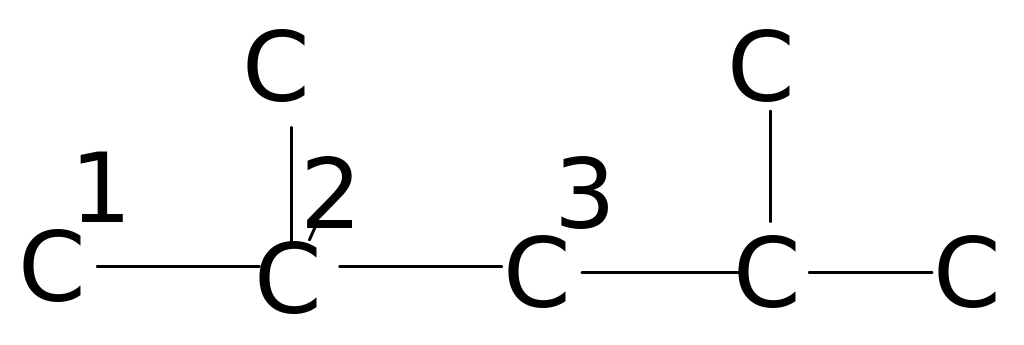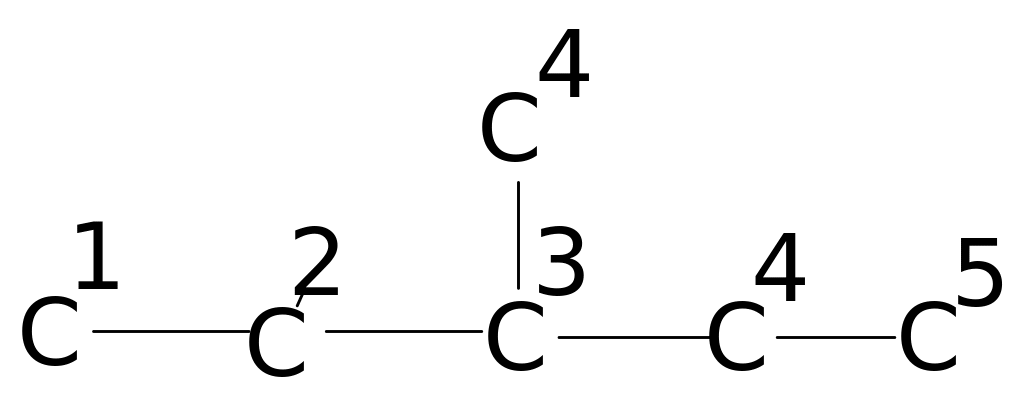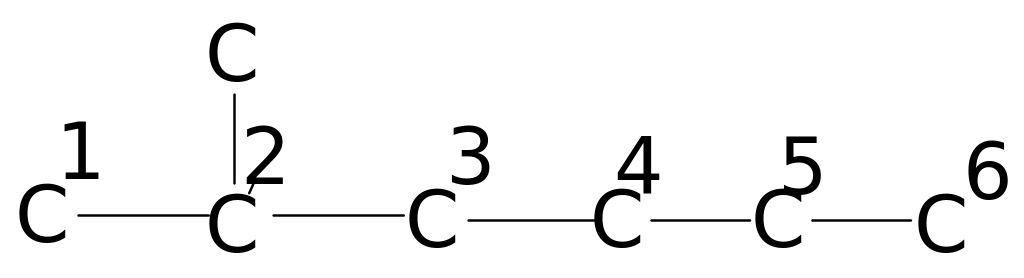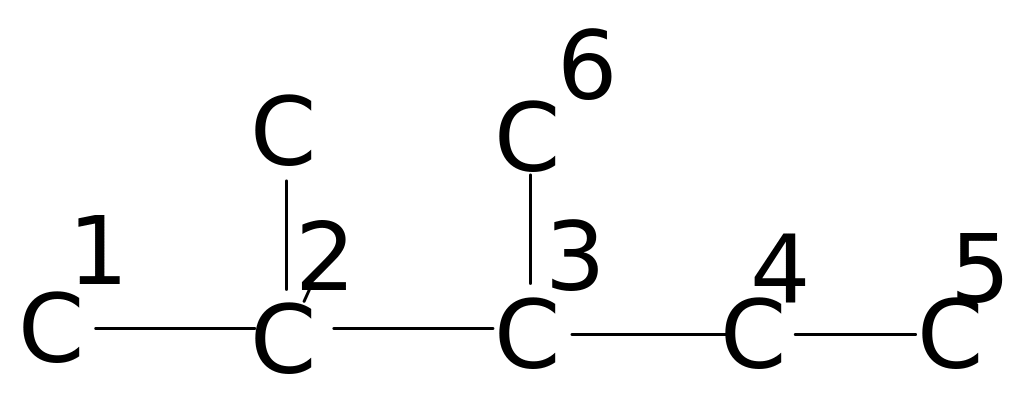- •Движение магнитных моментов в магнитном поле.
- •Ширина линии в спектрах ямр.
- •Основные параметры спектров ямр.
- •Ямр. Лекция №2.
- •Δν или δη расстояние до интересующей нас линии от стандарта, измеренное в Гц или Гс.
- •Механизмы экранирования.
- •Молекулярная составляющая σм.
- •Спин-спиновые взаимодействия.
- •Спектроскопия ямр. Лекция № 3 Связь между удаленными протонами (дальняя связь).
- •Графический анализ.
- •Структурные корреляции.
- •Водород, связанный с неуглеродными атомами.
- •Спектры ямр 13 с.
- •Спектроскопия ямр. Лекция 4.
- •Двойной ядерный магнитный резонанс.
Водород, связанный с неуглеродными атомами.
Спирты. Гидроксильный водород при обычных условиях (10-90 моль % в инертном растворителе) дает сигнал ЯМР около 4-5,5 м.д. При сильном разбавлении положение ЯМР-сигнала гидроксильного протона смещается к более высоким полям (в парах при 220 оС δ = 0,71 м.д.). Сдвиг в сторону сильного поля наблюдается и при увеличении температуры, при которой снимается спектр.
Фенолы. Протоны ОН-группы фенолов при обычных концентрациях дают сигналы около 6,0-7,7 м.д. Также как и для спиртов положение сигнала зависит от концентрации и температуры.
С, % 100 20 10 5 2 1 |
δ, м.д. 7,75 6,75 6,45 5,95 4,88 4,37 |
Изменение концентрации не влияет на местоположение сигналов ОН-группы фенолов, способных образовывать внутримолекулярную водородную связь. Например:
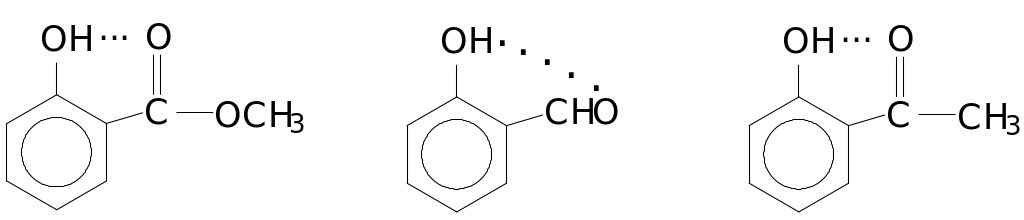
δ(H) = 10,58 δ(H) = 10,95 δ(H) = 12,05
Енолы.
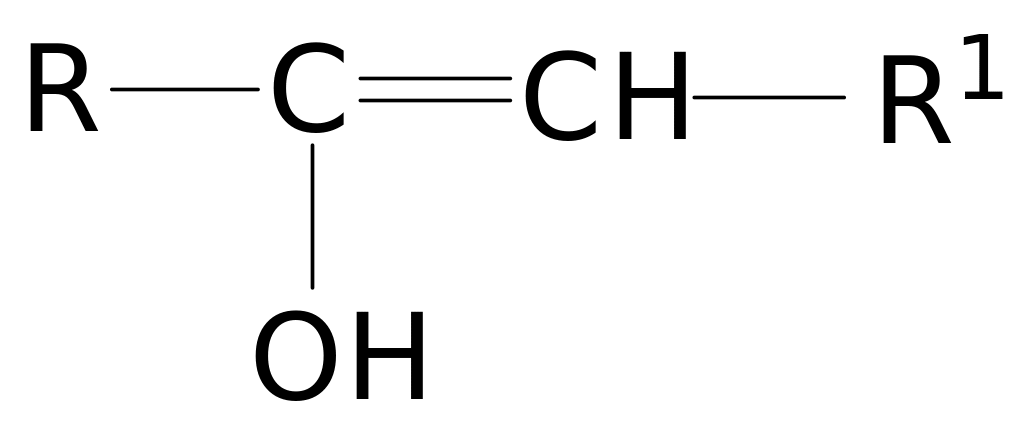 Протон
гидроксильной группы наблюдается в
очень сильных полях ~ 16 м.д. и местоположение
его обычно не зависит от разбавления.
Протон
гидроксильной группы наблюдается в
очень сильных полях ~ 16 м.д. и местоположение
его обычно не зависит от разбавления.
Карбоновые кислоты дают сигнал от ОН-протона в области 10,5-12 м.д. Он не смещается заметно при разбавлении раствора инертными растворителями, т.к. кислоты образуют димеры.
Амины. Аминные протоны обычно дают в спектре узкие синглеты, что как и в случае спиртов, указывает на быстрый химический обмен этими протонами. Аминные протоны алифатических аминов дают пики при 0,3-2,2 м.д., а ароматических при –2,6-4,7 м.д. Эти пики смещаются при разбавлении в более сильное поле. Теоретически, поскольку спин ядра атома азота равен 1, то сигнал протона, соединенного с ним должен представлять триплет. В действительности же, только в кислых растворах протоны рядом с аминогруппой имеют характер триплета, в нейтральных и щелочных растворах происходит быстрый обмен между NH- или ОН- и NH2-группами и за счёт этого сигналы усредняются, и имеют вид уширенного синглета.
Амиды. Н–N – в амидах дают уширенные сигналы в области – 5-8,5 м.д. Амидные протоны не участвуют в быстром химическом обмене и поэтому имеет место расщепление протонов у соседних с ними алкильных групп.
Тиолы. S–H – поглощение проявляется при 2,2-2,6 м.д., для ароматических S–H – при 3,6 м.д.
Спектры ямр 13 с.
Наличие в природном углероде 1,108 % изотопа 13С, обладающего магнитным моментом и спином ½ позволяет получать спектр ЯМР на его ядрах. Значения констант взаимодействия 13С и 1Н, непосредственно связанного с данным углеродным атомом велики и зависят от типа гибридизации данного углеродного атома. С увеличением S-характера величина Jн-с увеличивается.
Например:
Соединение |
Состояние гибридизации |
S-характер |
J, Гц |
метан |
SP3 |
25 |
125 |
бензол |
SP2 |
33,3 |
159 |
метилацетилен |
SP |
50 |
248 |
Обычно спектры ЯМР 13С укладываются в интервал 400 Гц. Химические сдвиги углеродных атомов в спектре ЯМР 13С достаточно характеристичны, что видно из следующей таблицы.
Углеродсодержащие группы |
δ 13С, м.д. |
Углеродсодержащие группы |
δ 13С, м.д. |
Si(CH3) |
0 |
C═N насыщенные соединения ненасыщенные соединения |
145-165
110-120 |
|
–5-55 |
C═O альдегиды и кетоны кислоты, сложные эфиры, амиды, галогенангидриды ангидриды |
175-225 155-185
150-165 |
═C─олефины |
100-150 |
C═S тионы |
220-235 |
═C─ароматические соединения |
110-150 |
C≡N |
110-125 |
≡С─ |
65-90 |
|
150-160 |
1 2 3 C═C═C |
1 2 70-95 (С С) 200-215 (С) |
|
30-70 40-85 10-70 |
ЯМР 13С – уникальный метод для изучения структуры органических молекул. Спектры ЯМР 13С снятые с подавлением спин-спинового взаимодействия с протонами высоко характеристичны: каждому С-атому, как правило, соответствует свой сигнал, причём набор сигналов характерен именно для этого соединения.
Чувствительность химических сдвигов сигналов 13С к структурным изменениям примерно на порядок превышает таковую в ЯМР- спектроскопии 1Н.
Характерная особенность ЯМР- спектроскопии 13С – аддитивность влияния заместителей.
R m
δС = C + ∑ niRAi
i=1
C – химический сдвиг эталона
ni – число заместителей в i- положении
Ai – инкримент химического сдвига i-го заместителя.
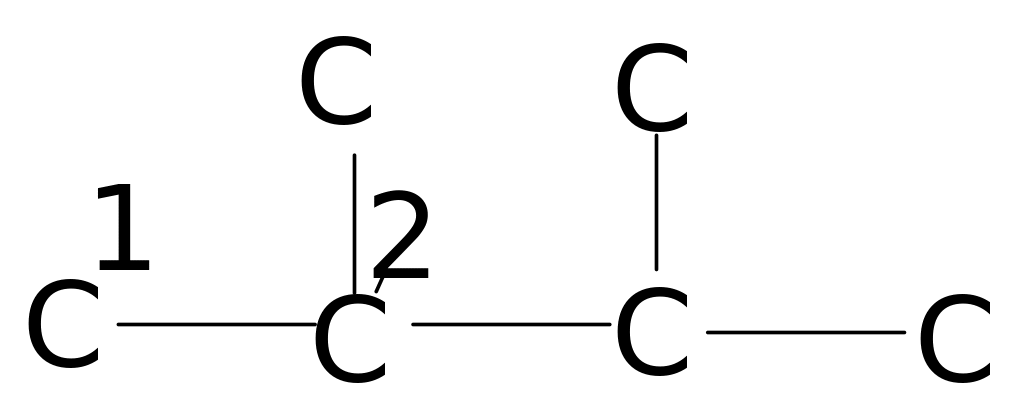
В таблицах 4. и 5. приведены химические сдвиги и инкрименты заместителей для нормальных и изоалканов.
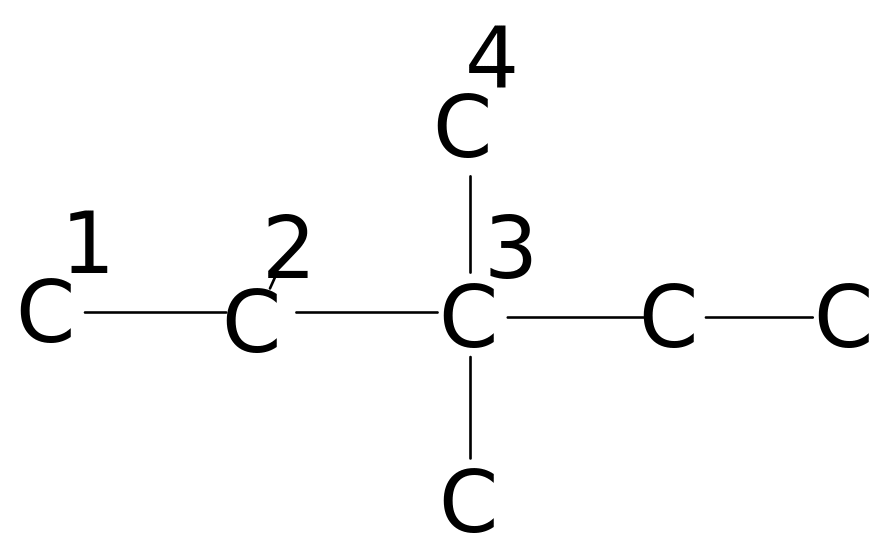
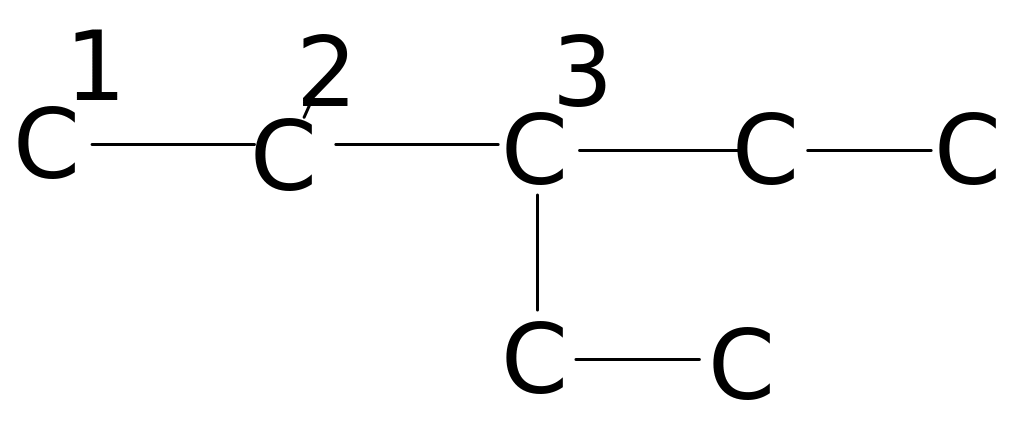
Таблица 4. Химические сдвиги 13С алканов [98]
Соединение (углеродная цепь) |
Атом углерода |
||||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
CH4 |
-2,3 |
- |
- |
- |
- |
- |
- |
C2H6 |
5,7 |
- |
- |
- |
- |
- |
- |
C3H8 |
15,4 |
15,9 |
- |
- |
- |
- |
- |
C4H10 |
13,1 |
24,9 |
- |
- |
- |
- |
- |
C5H12
|
13,5 |
22,2 |
34,1 |
- |
- |
- |
- |
|
21,9 |
29,9 |
31,6 |
11,5 |
- |
- |
- |
|
31,6 |
28,0 |
- |
- |
- |
- |
- |
|
22,7 |
25,7 |
49,0 |
- |
- |
- |
- |
|
29,5 |
30,6 |
47,3 |
18,1 |
15,1 |
- |
- |
|
7,7 |
33,4 |
32,3 |
25,6 |
- |
- |
- |
|
27,0 |
32,7 |
37,9 |
17,7 |
- |
- |
- |
|
10,5 |
25,2 |
42,4 |
- |
- |
- |
- |
C6H14
|
13,7 |
22,7 |
31,7 |
- |
- |
- |
- |
|
22,7 |
27,9 |
11,9 |
20,8 |
14,3 |
- |
- |
|
11,4 |
29,4 |
36,8 |
18,7 |
- |
- |
- |
|
28,7 |
30,3 |
36,5 |
8,5 |
- |
- |
- |
|
19,2 |
34,0 |
- |
- |
- |
- |
- |
C7H16
|
13,7 |
22,6 |
32,0 |
29,0 |
- |
- |
- |
|
22,4 |
28,1 |
38,9 |
29,7 |
23,0 |
13,6 |
- |
|
10,9 |
29,5 |
34,3 |
39,0 |
20,2 |
13,9 |
18,8 |
|
20,0* |
- |
- |
- |
- |
- |
- |
17,7 |
31,9 |
40,6 |
26,8 |
11,6 |
14,5 |
- |
|
* Удвоение сигналов обусловлено магнитной неэквивалентностью С-атомов.
Таблица 5. Влияние заместителей на химические сдвиги 13С(Δδ, м.д.) линейных (н-) и разветвленных (изо) алканов при замещении Н на Х.

Х |
α |
β |
γ |
||
н- |
изо- |
н- |
изо- |
||
СН3 |
9 |
6 |
10 |
8 |
-2 |
CH═CH2 |
20 |
- |
6 |
- |
-3,5 |
C≡CH |
4,5 |
- |
5,5 |
- |
-3,5 |
Ph |
23 |
17 |
9 |
7 |
-2 |
F |
69 |
63 |
8 |
6 |
-7 |
Cl |
31 |
32 |
10 |
10 |
-5 |
Br |
20 |
25 |
10 |
10 |
-4 |
I |
-7 |
4 |
10 |
12 |
-2 |
OH |
48 |
41 |
10 |
8 |
-6 |
OR |
58 |
51 |
8 |
5 |
-4 |
OC(O)CH3 |
52 |
45 |
6,5 |
5 |
-4 |
C(O)H |
31 |
- |
0 |
- |
-2 |
|
23 |
- |
3 |
- |
3 |
C(O)CH3 |
29 |
23 |
3 |
1 |
-3,5 |
C(O)OH |
21 |
16 |
2 |
2 |
-3 |
COO- |
25 |
20 |
3,5 |
3 |
-2 |
C(O)OCH3(и C2H5) |
22,5 |
17 |
3 |
2 |
-3 |
C(O)Cl |
33 |
28 |
2 |
2 |
-3,5 |
C(O)NH2 |
22 |
- |
2,5 |
- |
-3 |
C═N–OH |
|
|
|
|
|
син |
11,5 |
- |
0,5 |
- |
-2 |
анти |
16 |
- |
4,5 |
- |
-1,5 |
NH2 |
28,5 |
24 |
11,5 |
11 |
-5 |
NH3+ |
26 |
24 |
8 |
6 |
-5 |
NHR |
37 |
31 |
8 |
6 |
-4 |
NR2 |
40,5 |
- |
5 |
- |
-4,5 |
NR3+ |
30,5 |
- |
5,5 |
- |
-7 |
NO2 |
61,5 |
57 |
3 |
4 |
-4,5 |
–C≡N |
4 |
1 |
3 |
3 |
-3 |
|
27,5 |
- |
6,5 |
- |
-4,5 |
SH |
10,5 |
11 |
11,5 |
11 |
-3,5 |
–S– |
12 |
|
14 |
|
-3,5 |
SCH3 |
21 |
|
6 |
|
-3 |
S(CH3)2+ |
30 |
|
1 |
|
-3 |
S(O)CH3 |
42 |
|
0 |
|
-3 |
SO2CH3 |
41 |
|
0 |
|
-3 |