
- •Москва 2015
- •1. Введение
- •1.1. Классификация органических соединений
- •1.2. Номенклатура органических соединений.
- •Названия некоторых органических соединений и радикалов
- •2. Строение органических соединений Различные виды изомерии
- •2.1. Пространственное строение органических соединений
- •2.2. Электронное строение органических соединений
- •3. Основные закономерности протекания органических реакций
- •3.1. Типы реагентов
- •3.2. Способы разрыва ковалентной связи
- •3.3 Классификация органических реакций
- •1) По типу разрыва связей в субстрате и реагенте
- •6) Хемо- регио- и стереоселективные реакции
- •3.4 Факторы, определяющие реакционную способность органического соединения
- •4. Кислотно-основные свойства органических соединений
- •5. Свободно-радикальные реакции
- •6. Электрофильные реакции
- •6.1. Реакции электрофильного присоединения
- •6.2. Реакции электрофильного замещения в ароматическом кольце (se)
- •7.1. Реакции нуклеофильного замещения у sp3-гибридизованного атома углерода
- •7.2. Реакции элиминирования (е)
- •8. Реакционная способность соединений с карбонильной группой
- •8.1. Реакции нуклеофильного присоединения (an) к альдегидам и кетонам
- •8.2. Реакции нуклеофильного замещения у карбонильной группы в карбоновых кислотах и их функциональных производных (sn)
- •8.3. Реакции карбонильных соединений с участием подвижного α-водородного атома (сн-кислотного центра)
- •Содержание
- •1. Введение
- •1.1 Классификация органических соединений 3
6. Электрофильные реакции
В электрофильных реакциях реагентом, атакующим органическую молекулу, является электрофил (частица, имеющая дефицит электронов, Е или Е+). Субстратом в этом случае будет молекула, обладающая избыточной электронной плотностью в реакционном центре. К таким молекулам относятся:

Реакции электрофильного присоединения (АЕ) и замещения (SE)
1) Атака области с повышенной электронной плотностью электрофилом с образованием промежуточных активных частиц — сначала π-комплекса, затем карбокатиона (в ряде случаев образование π-комплекса не обнаружено):

π-комплекс карбокатион
2 )
Стабилизация карбокатиона либо
взаимодействием с нуклеофилом (реакции
АЕ),
либо за счет выброса протона (реакции
SE):
)
Стабилизация карбокатиона либо
взаимодействием с нуклеофилом (реакции
АЕ),
либо за счет выброса протона (реакции
SE):
присоединение (АЕ)
замещение (SE)
Типичные реакции алкенов — реакции присоединения:
Алкен реагент продукт тип реакции
 +
Н2
+
Н2
![]() гидрирование
гидрирование

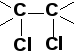
+
Cl2
![]() галогенирование
галогенирование

+
HCl
![]() гидрогалогенирование
гидрогалогенирование
 +
Н2О
+
Н2О
![]() гидратация
гидратация
Типичные реакции аренов — реакции замещения

нитрование
6.1. Реакции электрофильного присоединения
Присоединение галогеноводородов к алкенам
С![]() хема
механизма реакций гидрогалогенирования
хема
механизма реакций гидрогалогенирования
Реакция проходит в две стадии:
1) присоединение электрофила (иона Н+) с образованием карбокатиона

2) присоединение нуклеофила (аниона галогена)

скорость реакций присоединения увеличивается в рядах:
HF < HCl < HBr < HI (увеличение силы кислоты и увеличение нуклеофильности аниона);
CH2=CH2 < RCH=CHR ≈ RCH=CH2 < R2C=CHR ≈ R2C=CH2 (увеличение числа электронодонорных алкильных заместителей в молекуле и повышение основности субстрата).
Присоединение воды (гидратация)
К атализаторы
– достаточно сильные кислоты (серная,
азотная, хлорная, фосфорная)
атализаторы
– достаточно сильные кислоты (серная,
азотная, хлорная, фосфорная)
Схема механизма реакции гидратации
Реакция проходит в три стадии:
1) присоединение электрофила (иона Н+) с образованием карбокатиона

2) атака карбокатиона нуклеофилом (молекулой воды) с образованием иона алкилоксония

3) отщепление протона (проявление кислотных свойств) с образованием спирта

Региоселективность реакций электрофильного присоединения
Э мпирическое
правило В.В. Марковникова (1869)
— При
взаимодействии галогеноводородов и
других реагентов типа НХ с несимметричными
алкенами водород присоединяется к атому
углерода, связанному с максимальным
числом атомов водорода, т. е.
к наиболее «гидрогенизированному»
атому углерода двойной связи.
мпирическое
правило В.В. Марковникова (1869)
— При
взаимодействии галогеноводородов и
других реагентов типа НХ с несимметричными
алкенами водород присоединяется к атому
углерода, связанному с максимальным
числом атомов водорода, т. е.
к наиболее «гидрогенизированному»
атому углерода двойной связи.

Обоснование правила Марковникова
1 )
статический фактор (распределение
электронной плотности в исходной
молекуле:
)
статический фактор (распределение
электронной плотности в исходной
молекуле:
Под действием положительного индуктивного эффекта метильной (алкильной) группы происходит поляризация π-связи и на концевом атоме углерода возникает частичный отрицательный заряд, который обуславливает присоединение протона именно к этому атому.
2) динамический фактор (устойчивость карбокатиона, образующегося на первой стадии):
![]()
катион I катион II
из двух возможных карбокатионов катион I за счет +I эффекта двух метильных групп имеет наименьший заряд на атоме углерода, соответственно, обладает меньшей энергией, более устойчив и образуется легче, чем катион II.
У величение
устойчивости карбокатионов
величение
устойчивости карбокатионов

первичный вторичный третичный
О собенности
реакций присоединения к алкенам с
электроноакцепторными заместителями.
собенности
реакций присоединения к алкенам с
электроноакцепторными заместителями.
Статический фактор: в результате отрицательного индуктивного эффекта трифторометильной группы электроны π-связи поляризуются в ее сторону, что благоприятствует присоединению против правила Марковникова.
![]()
катион I катион II
Отрицательный индуктивный эффект трифторометильной группы намного сильнее положительного индуктивного эффекта группа СН3. В катионе I положительный заряд на атоме углерода больше, чем в катионе II (индуктивный эффект быстро ослабевает по цепи σ-связей), поэтому первый менее устойчив, что также благоприятствует протеканию реакции против правила Марковникова.
Большое биологическое значение имеют реакции гидратации α,β-ненасыщенных карбонильных соединений. В этом образуются β-гидроксикарбонильные соединения, например:

В приведенных примерах статический и динамический факторы действуют согласованно, однако если они противоречат друг другу, определяющим является динамический фактор, например:

(более устойчивый катион)
Современная интерпретация региоселективности электрофильного присоединения (правила Марковникова): направление присоединения реагентов типа НХ к несимметричным алкенам определяется относительной устойчивостью возможных в этих реакциях промежуточных карбокатионов.
Присоединение галогенов к алкенам
Быстрое обесцвечивание раствора брома без выделения HBr — качественная проба на наличие двойной связи.
М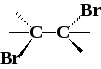 еханизм
реакции бромирования включает этапы
образования π-комплекса брома с алкеном,
в котором происходит поляризация
молекулы брома под действием р-электронов
π-связи, отщепления аниона брома с
образованием циклического иона бромония,
который может находиться в равновесии
с соответствующим карбокатионом, и,
наконец, присоединения аниона брома с
противоположной стороны (анти-присоединение).
еханизм
реакции бромирования включает этапы
образования π-комплекса брома с алкеном,
в котором происходит поляризация
молекулы брома под действием р-электронов
π-связи, отщепления аниона брома с
образованием циклического иона бромония,
который может находиться в равновесии
с соответствующим карбокатионом, и,
наконец, присоединения аниона брома с
противоположной стороны (анти-присоединение).
![]()
![]()
![]()

![]()

![]()
алкен π-комплекс ион бромония карбокатион продукт
анти-присо-
единения
Стереоселективность реакции галогенирования
П ри
галогенировании циклоалкенов происходит
анти-присоединение
с образованием транс-изомера.
ри
галогенировании циклоалкенов происходит
анти-присоединение
с образованием транс-изомера.
циклопентен транс-1,2-дибромоциклопентан
Присоединение карбокатионов к алкенам

Алкилирование алкенов карбокатионами в биохимических реакциях

3-метилбутен-2-илдифосфат катион аллильного типа

3-метилбутен-3-илдифосфат промежуточный карбокатион


геранилдифосфат — предшественник биосинтеза холестерина
Особенности реакций электрофильного присоединения к сопряженным диенам
Образование продуктов 1,2- и 1,4-присоединения
![]()
![]()
![]()
![]()
![]()
продукт 1,2 продукт 1,4
Схема механизма:

мезомерные структуры
