
- •Москва 2015
- •1. Введение
- •1.1. Классификация органических соединений
- •1.2. Номенклатура органических соединений.
- •Названия некоторых органических соединений и радикалов
- •2. Строение органических соединений Различные виды изомерии
- •2.1. Пространственное строение органических соединений
- •2.2. Электронное строение органических соединений
- •3. Основные закономерности протекания органических реакций
- •3.1. Типы реагентов
- •3.2. Способы разрыва ковалентной связи
- •3.3 Классификация органических реакций
- •1) По типу разрыва связей в субстрате и реагенте
- •6) Хемо- регио- и стереоселективные реакции
- •3.4 Факторы, определяющие реакционную способность органического соединения
- •4. Кислотно-основные свойства органических соединений
- •5. Свободно-радикальные реакции
- •6. Электрофильные реакции
- •6.1. Реакции электрофильного присоединения
- •6.2. Реакции электрофильного замещения в ароматическом кольце (se)
- •7.1. Реакции нуклеофильного замещения у sp3-гибридизованного атома углерода
- •7.2. Реакции элиминирования (е)
- •8. Реакционная способность соединений с карбонильной группой
- •8.1. Реакции нуклеофильного присоединения (an) к альдегидам и кетонам
- •8.2. Реакции нуклеофильного замещения у карбонильной группы в карбоновых кислотах и их функциональных производных (sn)
- •8.3. Реакции карбонильных соединений с участием подвижного α-водородного атома (сн-кислотного центра)
- •Содержание
- •1. Введение
- •1.1 Классификация органических соединений 3
3.2. Способы разрыва ковалентной связи
1![]() )
Гомолитический или свободно-радикальный
— электронная пара ковалентной связи
делится между образующимися частицами:
)
Гомолитический или свободно-радикальный
— электронная пара ковалентной связи
делится между образующимися частицами:
Обычно характерен для неполярных и малополярных связей, часто требует затраты большой энергии. Образующиеся активные промежуточные частицы — свободные радикалы.
2![]() )
Гетеролитический или ионный
— электронная пара ковалентной связи
уходит с одной из образующихся частиц:
)
Гетеролитический или ионный
— электронная пара ковалентной связи
уходит с одной из образующихся частиц:
Характерен для полярных связей. Образующиеся активные промежуточные частицы — карбокатионы (имеют положительный заряд на атоме углерода) или карбоанионы (имеют отрицательный заряд на атоме углерода).
3.3 Классификация органических реакций
1) По типу разрыва связей в субстрате и реагенте
(![]() а)
Гомолитические (свободно-радикальные)
реакции:
а)
Гомолитические (свободно-радикальные)
реакции:
субстрат реагент продукты реакции
(![]() б)
Гетеролитические (ионные) реакции:
б)
Гетеролитические (ионные) реакции:
субстрат реагент продукты реакции
(в) Согласованные (синхронные) реакции — одновременный перенос нескольких пар электронов. Часто протекают через ароматическое переходное состояние:
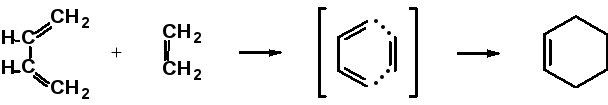
бутадиен-1,3 этилен переходное состояние циклогексен
2) По типу реагента
а) радикальные (R):
СН2=СН–СН3 + НО· → СН2=СН–СН2· + Н2О
б) электрофильные (E):
С6Н6 + NO2+ → C6H5NO2 + H+
в) нуклеофильные (N):
C2H5Br + OH– → C2H5OH + Br–
г )
окислительные
[O]:
)
окислительные
[O]:
д )
восстановительные
[H]:
)
восстановительные
[H]:
3) По конечному результату
а )
реакции
замещения (S):
)
реакции
замещения (S):
б![]() )
реакции
присоединения (A):
)
реакции
присоединения (A):
в![]() )
реакции
отщепления или элиминирования (E):
)
реакции
отщепления или элиминирования (E):
4) По числу молекул (частиц), участвующих в стадии, определяющей общую скорость реакции
а) мономолекулярные:
![]() (диссоциативные)
(диссоциативные)
![]() (изомеризации)
(изомеризации)
б![]() )
бимолекулярные
(ассоциативные):
)
бимолекулярные
(ассоциативные):
![]()
5) Кинетически и термодинамически контролируемые реакции
В ряде случаев из одних и тех же исходных веществ могут образоваться несколько различных продуктов (конкурирующие реакции). Если реакции необратимы, то соотношение продуктов определяется только кинетическим фактором (соотношением скоростей соответствующих реакций). Если же эти реакции обратимы, то сначала образуется тот продукт, скорость образования которого больше (происходит кинетически контролируемая реакция), однако через некоторое время наблюдается превращение этого продукта в то вещество, энергия которого ниже (происходит термодинамически контролируемая реакция), например:

кинетически контролируемый
продукт
н афталин α-нафталинсульфокислота
афталин α-нафталинсульфокислота
термодинамически контролируемый продукт
β-нафталинсульфокислота
6) Хемо- регио- и стереоселективные реакции
Хемоселективность — преимущественное протекание реакции по одному из нескольких реакционных центров:

Р егиоселективность
— предпочтительное
протекание реакции по одному из нескольких
реакционных центров одинаковой
химической природы:
егиоселективность
— предпочтительное
протекание реакции по одному из нескольких
реакционных центров одинаковой
химической природы:
С тереоселективность
— предпочтительность
образования одного из нескольких
возможных стереоизомеров
тереоселективность
— предпочтительность
образования одного из нескольких
возможных стереоизомеров
циклопентен транс-1,2-дибромциклопентан
