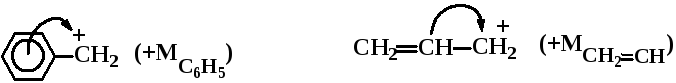- •Москва 2015
- •1. Введение
- •1.1. Классификация органических соединений
- •1.2. Номенклатура органических соединений.
- •Названия некоторых органических соединений и радикалов
- •2. Строение органических соединений Различные виды изомерии
- •2.1. Пространственное строение органических соединений
- •2.2. Электронное строение органических соединений
- •3. Основные закономерности протекания органических реакций
- •3.1. Типы реагентов
- •3.2. Способы разрыва ковалентной связи
- •3.3 Классификация органических реакций
- •1) По типу разрыва связей в субстрате и реагенте
- •6) Хемо- регио- и стереоселективные реакции
- •3.4 Факторы, определяющие реакционную способность органического соединения
- •4. Кислотно-основные свойства органических соединений
- •5. Свободно-радикальные реакции
- •6. Электрофильные реакции
- •6.1. Реакции электрофильного присоединения
- •6.2. Реакции электрофильного замещения в ароматическом кольце (se)
- •7.1. Реакции нуклеофильного замещения у sp3-гибридизованного атома углерода
- •7.2. Реакции элиминирования (е)
- •8. Реакционная способность соединений с карбонильной группой
- •8.1. Реакции нуклеофильного присоединения (an) к альдегидам и кетонам
- •8.2. Реакции нуклеофильного замещения у карбонильной группы в карбоновых кислотах и их функциональных производных (sn)
- •8.3. Реакции карбонильных соединений с участием подвижного α-водородного атома (сн-кислотного центра)
- •Содержание
- •1. Введение
- •1.1 Классификация органических соединений 3
2.2. Электронное строение органических соединений
Атомные орбитали элементов 2-го периода
![]()
![]()


2s 2px 2py 2pz
Гибридизация атомных орбиталей — искусственный прием, заключающийся в смешивании нескольких орбиталей различной формы и близкой энергии с образованием такого же числа гибридных орбиталей, соответствующих реальной геометрии молекулы. Для элементов 2-го периода гибридные орбитали имеют одинаковую форму и энергию.
s![]() p-гибридизация:
p-гибридизация:
![]() +
+
![]()


![]() s
+ p
две sp
sp-гибридизованнный
атом
s
+ p
две sp
sp-гибридизованнный
атом
орбитали


![]() линейный
фрагмент
линейный
фрагмент
молекулы
s![]() p2-гибридизация:
p2-гибридизация:
![]() +
+
![]() +
+
![]()

![]() s
+ p
+ р три sp2-орбитали
s
+ p
+ р три sp2-орбитали


![]() плоский
фрагмент молекулы
плоский
фрагмент молекулы
s![]() p3-гибридизация:
p3-гибридизация:
![]() +
+
![]() +
+
![]() +
+![]()
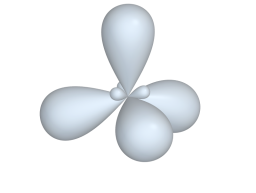
![]() s
+ p
+ р р четыре sp3-орбитали
s
+ p
+ р р четыре sp3-орбитали


![]() тетраэдрический
фрагмент молекулы
тетраэдрический
фрагмент молекулы
Химические связи в органических соединениях
- и π-связи
-Связь — ковалентная связь, образующаяся при перекрывании атомных орбиталей вдоль оси, проходящей через центры атомов.
![]()
![]()
![]()
связь С–Н связь С–С связь С–Cl
Атом углерода образует -связи только гибридными орбиталями.
Одинарная связь всегда -связь
π-Связь — ковалентная связь, образующаяся при боковом перекрывании двух р-орбиталей по обе стороны от линии, соединяющей центры атомов.
![]() π-Связь
менее прочная, более рыхлая и легче
поляризуется, чем
π-Связь
менее прочная, более рыхлая и легче
поляризуется, чем
- связь.
π-Связь может возникнуть только между атомами, уже
связанными -связью.
Двойная связь — сочетание одной - и одной π-связи.
Тройная связь — сочетание одной - и двух π-связей.
Гибридизацию атома углерода легко определить, подсчитав число связанных с ним атомов: sp-, если их два, sp2-, если их три и sp3, если их четыре.
Водородная связь — слабая химическая связь, возникающая между атомом водорода, связанным с электроотрицательным атомом (O, N, F), и электроотрицательным атомом, обладающим неподеленной электронной парой (O, N, F).
![]()
![]()
![]()
межмолекулярные водородные связи внутримолекулярная водо-
в этаноле и уксусной кислоте роднаясвязь в этандиоле
Сопряжение — существование единой р-электронной системы, образующейся в результате последовательного перекрывания трех или более р-орбиталей (образование делокализованной химической связи, охватывающей более двух атомов). Образование такой системы энергетически выгодно.
π,π-сопряжение возникает при чередовании кратных и одинарных связей
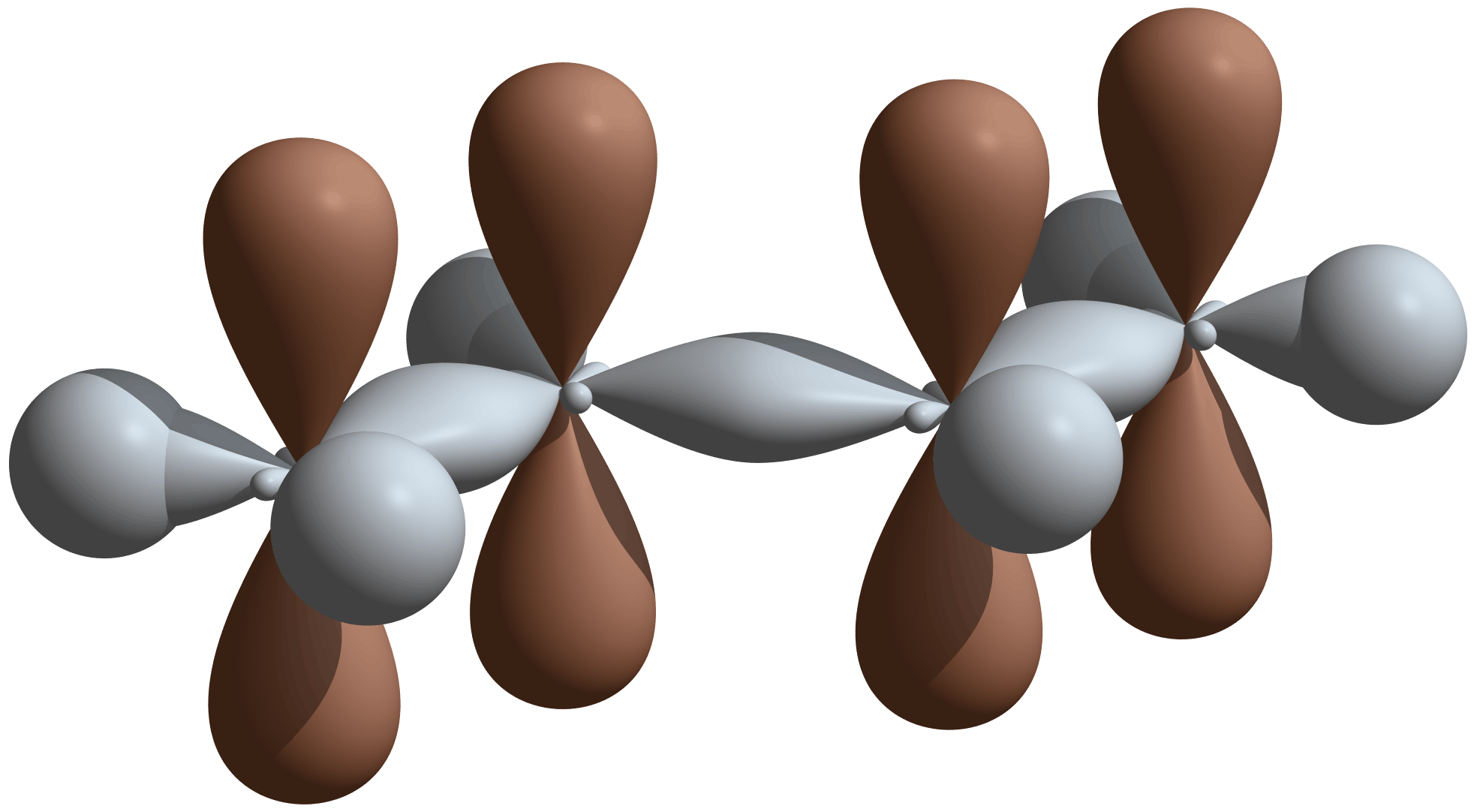


π,π-сопряжение в молекуле бутадиена-1,3
р ,π-сопряжение
возникает при наличии рядом с кратной
связью атома с неподеленной парой
электронов.
,π-сопряжение
возникает при наличии рядом с кратной
связью атома с неподеленной парой
электронов.
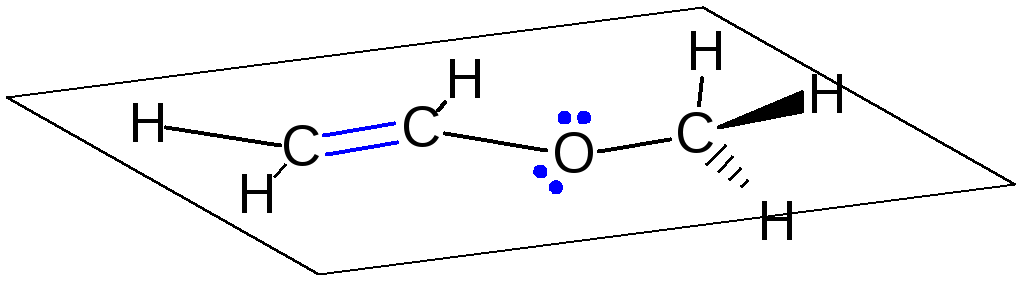
р,π-сопряжение в молекуле винилметилового эфира
А![]()
 роматичность
— наличие в молекуле энергетически
выгодной замкнутой цепи сопряжения,
включающей 4n+2
р-электронов, где n
— любое целое число (правило Хюккеля).
роматичность
— наличие в молекуле энергетически
выгодной замкнутой цепи сопряжения,
включающей 4n+2
р-электронов, где n
— любое целое число (правило Хюккеля).
n = 0 (2 р-электрона): циклопропенильный
катион
n
= 1 (6 р-электронов) бензол (С6Н6):
![]() или
или
![]()
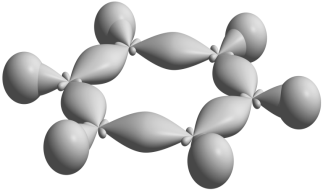


-связи в бензоле р-орбитали в бензоле ароматическая элект-
ронная система
n
= 2 (10 р-электронов)
![]()
нафталин
n
= 3 (14 р-электронов)
![]()
антрацен
Электроотрицательность, полярность и поляризуемость связей
Электроотрицательность (ЭО)— способность атома притягивать к себе электроны химической связи.


Зависимость электроотрицательности Зависимость электроотрицательности
от положения атома в периодической от типа гибридизации атома (при
системе элементов уменьшении доли р-орбитали гибрид-
ная орбиталь становится короче)
Относительная электроотрицательность по Полингу
![]()
Если ковалентная связь образована атомами, имеющими одинаковую электроотрицательность, то она ‑ неполярна, например, Н3С–СН3, Н3С–SH.
Е![]()

 сли
различие в электроотрицательностях
связанных атомов невелико, связь между
ними малополярна:
сли
различие в электроотрицательностях
связанных атомов невелико, связь между
ними малополярна:
Поляризация σ-связей изображается стрелкой вдоль связи, поляризация π-связей — изогнутой стрелкой. Значки δ+ и δ– означают частичные положительный и отрицательный заряды.
С![]()
![]()
![]()
![]()
![]() ильно
полярные
связи образуются между атомами,
значительно различающимися по своей
электроотрицательности:
ильно
полярные
связи образуются между атомами,
значительно различающимися по своей
электроотрицательности:
Поляризуемость связи — способность электронов связи смещаться под действием электрического поля, создаваемого другим атомом, несущим целый или частичный заряд. π-Связи поляризуются гораздо сильнее, чем σ-связи. Чем больше размеры атомов, образующих связь, тем легче она поляризуется, например, поляризуемость связи углерод-галоген возрастает от C–F к C–I.
Электронные эффекты заместителей
Практически любую молекулу органического вещества можно представить, как основную структуру с присоединенными к ней заместителями (атомами или группами атомов). Для понимания общего распределения электронной плотности в молекуле и предсказания возможных свойств состоящего из этих молекул вещества важно знать, как тот или иной заместитель влияет на остальную часть молекулы, т.е. электронные эффекты заместителей.
Точкой отсчета принят атом водорода — его эффект считается равным нулю. Эффект считается положительным, если заместитель увеличивает электронную плотность в остальной части молекулы — проявляет электронодонорные свойства. Эффект считается отрицательным, если заместитель уменьшает электронную плотность в остальной части молекулы — проявляет электроноакцепторные свойства.
Индуктивный эффект (I) — передача электронного эффекта заместителя по цепи σ-связей (обозначается прямой стрелкой вдоль σ-связи).
Положительным индуктивным эффектом (+I) обладают насыщенные углеводородные радикалы (алкилы и циклоалкилы) и атомы, несущие целый отрицательный заряд:
 (+IСН3)
(+IСН3)
![]() (+IО–)
(+IО–)
Отрицательным индуктивным эффектом (–I) обладают атомы, более электроотрицательные, чем углерод или заместители, содержащие такие атомы, а также заместители, несущие целый положительный заряд:
 (–IСF3)
(–IСF3) ![]() (–INH3+)
(–INH3+)
Индуктивный эффект в основном проявляется на ближайшем к заместителю атоме и быстро ослабевает по цепи σ-связей.
Мезомерный эффект (М) — передача электронного эффекта заместителя по цепи сопряжения (изображается изогнутой стрелкой). Возможен только в тех случаях, когда заместитель входит в систему сопряжения молекулы.
Положительным мезомерным эффектом (+М) обладают заместители, содержащие атом с неподеленной парой электронов, входящий в р,π сопряженную систему:
![]() (+МСН3О
)
(+МСН3О
) ![]() (+МNH2)
(+МNH2)
Отрицательным мезомерным эффектом (–М) обладают заместители, входящие в систему π,π-сопряжения с остальной частью молекулы и имеющие электроотрицательный атом на конце этой системы, или заместители, имеющие вакантную (пустую) р-орбиталь, входящую в р,π-сопряжение с остальной частью молекулы:
 (–МСНО
)
(–МСНО
)
 (–МСООН
)
(–МСООН
)
![]() (–МСН3СН+
)
(–МСН3СН+
)
В отличие от индуктивного, мезомерный эффект распространяется на всю систему сопряжения, практически не ослабевая:
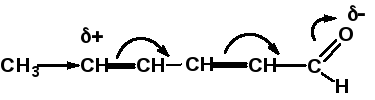
Если индуктивный и мезомерный эффекты одного и того же заместителя направлены в противоположные стороны, то, как правило, преобладает мезомерный эффект.
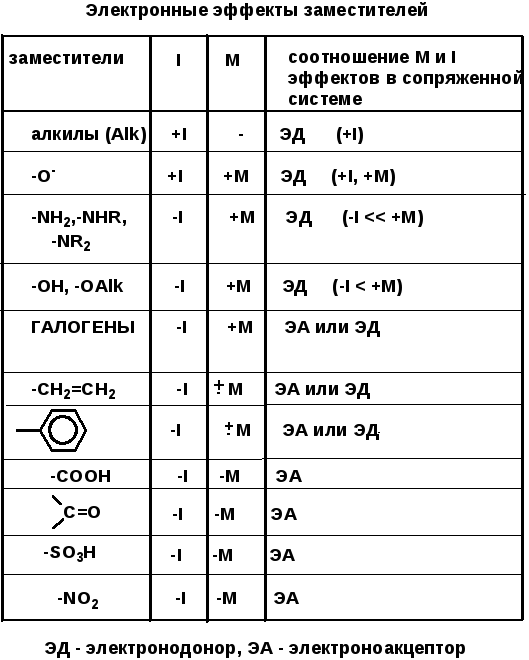
Винильные и арильные заместители в зависимости от ситуации могут проявлять либо электронодонорные, либо электроноакцепторные свойства: