
- •Москва 2015
- •1. Введение
- •1.1. Классификация органических соединений
- •1.2. Номенклатура органических соединений.
- •Названия некоторых органических соединений и радикалов
- •2. Строение органических соединений Различные виды изомерии
- •2.1. Пространственное строение органических соединений
- •2.2. Электронное строение органических соединений
- •3. Основные закономерности протекания органических реакций
- •3.1. Типы реагентов
- •3.2. Способы разрыва ковалентной связи
- •3.3 Классификация органических реакций
- •1) По типу разрыва связей в субстрате и реагенте
- •6) Хемо- регио- и стереоселективные реакции
- •3.4 Факторы, определяющие реакционную способность органического соединения
- •4. Кислотно-основные свойства органических соединений
- •5. Свободно-радикальные реакции
- •6. Электрофильные реакции
- •6.1. Реакции электрофильного присоединения
- •6.2. Реакции электрофильного замещения в ароматическом кольце (se)
- •7.1. Реакции нуклеофильного замещения у sp3-гибридизованного атома углерода
- •7.2. Реакции элиминирования (е)
- •8. Реакционная способность соединений с карбонильной группой
- •8.1. Реакции нуклеофильного присоединения (an) к альдегидам и кетонам
- •8.2. Реакции нуклеофильного замещения у карбонильной группы в карбоновых кислотах и их функциональных производных (sn)
- •8.3. Реакции карбонильных соединений с участием подвижного α-водородного атома (сн-кислотного центра)
- •Содержание
- •1. Введение
- •1.1 Классификация органических соединений 3
5. Свободно-радикальные реакции
Пути образования свободных радикалов
Свободные радикалы образуются в результате гомолитического разрыва ковалентной связи.
1![]() )
Фотохимический
—
расщепление ковалентной связи при
помощи лучистой энергии (фотолиз),
например:
)
Фотохимический
—
расщепление ковалентной связи при
помощи лучистой энергии (фотолиз),
например:
В результате поглощения кванта света молекула возбуждается и затем распадается на две частицы с неспаренным электроном. Такой тип разрыва постоянно осуществляется и в условиях живого организма под действием космического излучения. При воздействии проникающей радиации этот путь является причиной лучевой болезни.
2![]() )
Термический
—
расщепление ковалентной связи за счет
тепловой энергии (термолиз).
В большинстве случаев требуется высокая
температура, несовместимая с условиями
существования живого организма, однако
некоторые вещества, например пероксиды
и гидропероксиды,
способны распадаться и при относительно
низких температурах:
)
Термический
—
расщепление ковалентной связи за счет
тепловой энергии (термолиз).
В большинстве случаев требуется высокая
температура, несовместимая с условиями
существования живого организма, однако
некоторые вещества, например пероксиды
и гидропероксиды,
способны распадаться и при относительно
низких температурах:
пероксид
![]()
гидропероксид
3) Химический — образование радикалов в окислительно-восстановитель-ных процессах или под действием другого свободного радикала.
![]()
![]()
Реакции радикального замещения (SR)
Общие закономерности
Схема механизма реакции на примере хлорирования метана:
![]()
1 этап — инициирование (образование частиц с неспаренным электроном)
![]()
Два атома хлора, обладающие высокой энергией разлетаются в разные стороны, и каждый их них начинает цепь последовательных процессов.
2 этап — рост
цепи
этап — рост
цепи
Большинство свободно-радикальных процессов имеют цепной характер.
Эти две стадии повторяются многократно до тех пор, пока не произойдет обрыв цепи.
3 этап — обрыв цепи
Цепной процесс может оборваться либо за счет рекомбинации двух свободных радикалов,

либо дезактивации свободного радикала при столкновении со стенкой сосуда или молекулой ингибитора.
Региоселективность реакций радикального замещения
В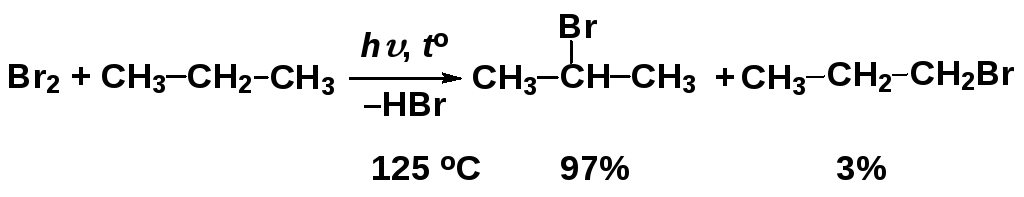 случае молекул более сложных, чем метан
и этан, реакции SR
протекают
региоселективно, например:
случае молекул более сложных, чем метан
и этан, реакции SR
протекают
региоселективно, например:
Соотношение продуктов реакции показывает, что замещение атома водорода у вторичного атома углерода происходит гораздо легче, чем у первичного (статистически соотношение было бы 1 : 3).
Для понимания причин такой избирательности можно использовать два фактора: статический и динамический, однако надо иметь в виду, что если они противоречат друг другу, определяющим является динамический.
В данном случае в качестве статического фактора можно рассматривать энергию, необходимую для разрыва связи углерод-водород (чем ниже энергия разрыва связи, тем легче отрывается атом водорода при радикальной атаке и тем быстрее происходит реакция):

Динамическим фактором, определяющим направление свободно-радикального процесса, является относительная устойчивость (стабильность) образующихся в процессе активных промежуточных частиц — свободных радикалов (чем меньше энергия частицы, тем более она устойчива и тем легче образуется). В свою очередь, энергия радикала связана с возможностями делокализации (рассредоточения) неспаренного электрона по остальной части частицы.
Атом углерода, обладающий неспаренным электроном, как правило, имеет sp2-гибридизацию и несет этот электрон на р-орбитали.
Наиболее
активным и, следовательно, наименее
устойчивым, является метильный радикал,
в котором нет никаких возможностей
делокализации неспаренного электрона:

В этильном
радикале возможно некоторое перекрывание
р-орбитали неспаренного электрона с σ
молекулярной орбиталью С–Н-связи
соседней метильной группы
 ,
что приводит к частичной делокализации
неспаренного электрона на С–Н-связях
соседнего атома углерода и небольшому
понижению энергии частицы.
,
что приводит к частичной делокализации
неспаренного электрона на С–Н-связях
соседнего атома углерода и небольшому
понижению энергии частицы.
В
изопропильном радикале возможностей делокализации неспаренного
электрона в 2 раза больше, а в трет-бутильном
возможностей делокализации неспаренного
электрона в 2 раза больше, а в трет-бутильном
 в 3 раза больше, чем в этильном.
в 3 раза больше, чем в этильном.
Таким образом, устойчивость радикалов возрастает в ряду: первичный < вторичный < третичный.
Наибольшей
устойчивостью обладают свободные
радикалы аллильного
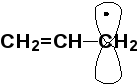 или бензильного
или бензильного
 типа, в которых р-орбиталь, несущая
неспаренный электрон, входит в систему
сопряжения.
типа, в которых р-орбиталь, несущая
неспаренный электрон, входит в систему
сопряжения.
 Сопряжение
в аллильном радикале. Видно, что два
концевых атома углерода совершенно
одинаковы, и неспаренный электрон
полностью делокализовался по всей
частице
Сопряжение
в аллильном радикале. Видно, что два
концевых атома углерода совершенно
одинаковы, и неспаренный электрон
полностью делокализовался по всей
частице
Такие частицы называют мезомерными. Для выяснения места локализации неспаренного электрона или заряда в мезомерных частицах используют так называемые мезомерные (резонансные) структуры — возможные структуры, написанные с соблюдением правил валентности. Для аллильного радикала можно написать две равновероятные структуры:
![]()
Обоюдоострая стрелка означает, что реальное строение частицы среднее между этими двумя граничными структурами, т.е. неспаренный электрон наполовину находится на первом атоме углерода и наполовину – на третьем.
С
 опряжение
в бензильном радикале и соответствующие
резонансные структуры:
опряжение
в бензильном радикале и соответствующие
резонансные структуры:
Преимущественное направление радикальной атаки:
![]()
бутен-1 радикал аллильного типа

этилбензол радикал бензильного типа
В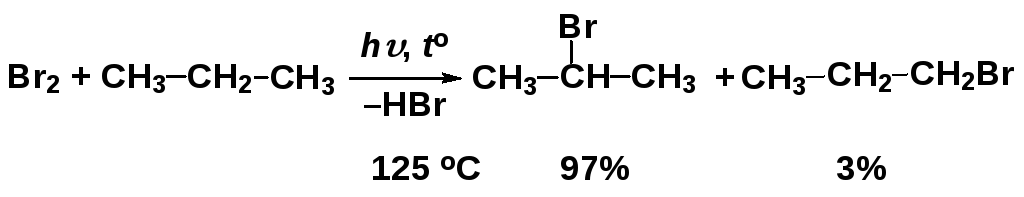 лияние
различных факторов на селективность
радикальных реакций:
лияние
различных факторов на селективность
радикальных реакций:

Чем активнее реагент и чем выше температура, тем меньше селективность.
Более высокая селективность менее активного реагента (радикала брома) по сравнению с более активным реагентом (радикалом хлора) — общая закономерность в протекании органических реакций.
Реакции пероксидного окисления
![]()
гидропероксид
Гидропероксиды — производные пероксида водорода, в котором один атом водорода замещен на органический радикал.
Схема механизма реакции пероксидного окисления (реакция типа SR)
1) стадия инициирования:
![]()
где
![]() — любой достаточно активный свободный
радикал.
— любой достаточно активный свободный
радикал.
2) стадии развития цепи:
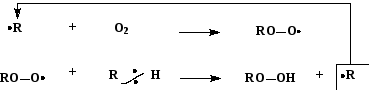
(пероксидный радикал)
3) возможные стадии обрыва цепи:
![]() (пероксид)
(пероксид)
или
![]()
Пероксиды — производные пероксида водорода, в котором два атома водорода замещены на органические радикалы.
Антиоксиданты — природные органические вещества, способные предотвращать развитие неблагоприятных для живого организма радикальных окислительных процессов. Наиболее важные антиоксиданты — витамины Е (токоферолы), А (ретинол), С (аскорбиновая кислота), каротины и биофлавоноиды.
Примеры реакций пероксидного окисления:
![]()
диэтиловый эфир гидропероксид диэтилового эфира
![]()
циклогексен гидропероксид циклогексена

изопропилбензол гидропероксид изопропилбензола
Пероксидное окисление липидов
Реакция пероксидного окисления является основной причиной повреждения и разрушения клеточных мембран в живом организме.


 остаток
олеиновой кислоты
остаток
олеиновой кислоты
Фрагмент липида клеточной
мембраны



аллильное положение
Л юбая
достаточно активная свободно-радикальная
частица (
юбая
достаточно активная свободно-радикальная
частица (![]() ),
появившаяся в липидном слое, атакует
фрагмент ненасыщенной карбоновой
кислоты в одном из аллильных положений,
отрывая атом водорода. В результате из
фрагмента олеиновой кислоты может
образоваться два мезомерных радикала:
),
появившаяся в липидном слое, атакует
фрагмент ненасыщенной карбоновой
кислоты в одном из аллильных положений,
отрывая атом водорода. В результате из
фрагмента олеиновой кислоты может
образоваться два мезомерных радикала:
радикал I радикал II
Д опустим,
что образовался радикал I,
тогда его резонансными структурами
будут:
опустим,
что образовался радикал I,
тогда его резонансными структурами
будут:


О
 2
О2
2
О2





продукты распада
Фрагменты полиненасыщенных кислот подвергаются пероксидному окислению легче, чем фрагменты олеиновой кислоты. Природные антиоксиданты защищают организм от реакций пероксидного окисления.
