
- •Москва 2015
- •1. Введение
- •1.1. Классификация органических соединений
- •1.2. Номенклатура органических соединений.
- •Названия некоторых органических соединений и радикалов
- •2. Строение органических соединений Различные виды изомерии
- •2.1. Пространственное строение органических соединений
- •2.2. Электронное строение органических соединений
- •3. Основные закономерности протекания органических реакций
- •3.1. Типы реагентов
- •3.2. Способы разрыва ковалентной связи
- •3.3 Классификация органических реакций
- •1) По типу разрыва связей в субстрате и реагенте
- •6) Хемо- регио- и стереоселективные реакции
- •3.4 Факторы, определяющие реакционную способность органического соединения
- •4. Кислотно-основные свойства органических соединений
- •5. Свободно-радикальные реакции
- •6. Электрофильные реакции
- •6.1. Реакции электрофильного присоединения
- •6.2. Реакции электрофильного замещения в ароматическом кольце (se)
- •7.1. Реакции нуклеофильного замещения у sp3-гибридизованного атома углерода
- •7.2. Реакции элиминирования (е)
- •8. Реакционная способность соединений с карбонильной группой
- •8.1. Реакции нуклеофильного присоединения (an) к альдегидам и кетонам
- •8.2. Реакции нуклеофильного замещения у карбонильной группы в карбоновых кислотах и их функциональных производных (sn)
- •8.3. Реакции карбонильных соединений с участием подвижного α-водородного атома (сн-кислотного центра)
- •Содержание
- •1. Введение
- •1.1 Классификация органических соединений 3
8.1. Реакции нуклеофильного присоединения (an) к альдегидам и кетонам
Гидратация (образование гидратов)
Многие карбонильные соединения (альдегиды, кетоны, содержащие электроноакцепторные группы у карбонильной группы) в водных растворах частично или полностью гидратируются. Реакция начинается с нуклеофильной атаки молекулы воды на карбонильный атом углерода с образованием тетраэдрического промежуточного соединения с разноименными зарядами на двух атомах кислорода. Затем переход протона от кислотного центра (положительно заряженный кислород) на основный центр (отрицательно заряженный атом кислорода) приводит к образованию гидрата.

Как и большинство реакций нуклеофильного присоединения по карбонильной группе, реакция гидратации обратима.
По содержанию гидратированной формы в растворе можно судить об относительной легкости реакций (AN):

Трихлоруксусный альдегид (хлораль) рядом с карбонильной группой содержит электроноакцепторную трихлорметильную группу, увеличивающую положительный заряд на карбонильном углероде. Гидрат этого альдегида (хлоралгидрат), обладающий снотворным и седативным эффектами, способный вызывать лёгкую анальгезию и использующийся как противосудорожное средство, — устойчивое твердое соединение.
Муравьиный альдегид в водном растворе (40%-ный раствор формальдегида в воде называется формалином и используется для консервации анатомических препаратов) практически полностью гидратирован, однако выделить гидрат в чистом состоянии при обычных условиях невозможно.
При переходе от формальдегида к уксусному альдегиду содержание гидрата уменьшается, а ацетон практически не гидратируется. Это связано, во-первых, с наличием электронодонорных алкильных групп, уменьшающих положительный заряд на карбонильном углероде и, во-вторых, с увеличением пространственных затруднений при атаке нуклеофилом карбонильной группы.
Присоединение спиртов
Механизм присоединения спиртов аналогичен механизму реакции гидратации. Альдегиды легко присоединяют спирты с образованием полуацеталей, при избытке спирта в кислой среде возможно образование ацеталей:

Ацетали — устойчивые вещества, которые можно выделить в индивидуальном состоянии. В кислых средах они гидролизуются с образованием карбонильного соединения и спирта. Ацетализация используется для защиты альдегидной группы от окисления.
К етоны
вступают в эту реакцию только если они
содержат электроноакцепторные
заместители.
етоны
вступают в эту реакцию только если они
содержат электроноакцепторные
заместители.
Реакция образования ацеталя из полуацеталя протекает по механизму (SN1). Кислотный катализ необходим для превращения плохой уходящей группы (-ОН) в хорошую уходящую группу (молекулу воды):
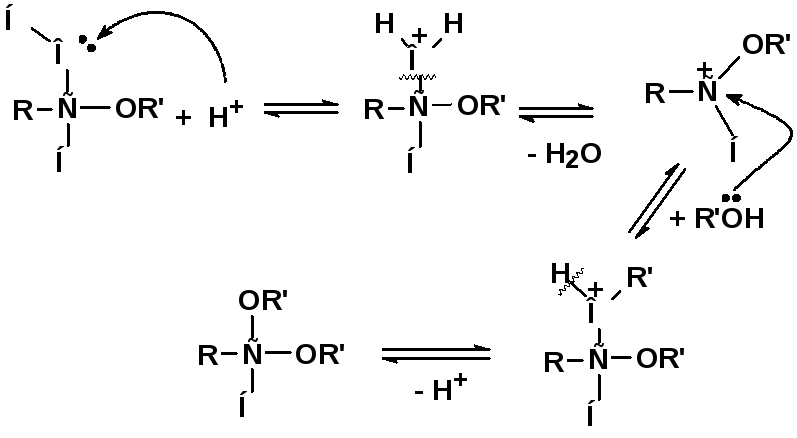
Присоединение тиолов
Тиолы более нуклеофильны, чем спирты, поэтому они реагируют с карбонильными соединениями легче:

Образование полутиоацеталей и дитиоацеталей является важной промежуточной стадией во многих ферментативных реакциях.
Реакции альдегидов и кетонов с первичными аминами. Образование иминов (оснований Шиффа)
А мины
легко присоединяются по карбонильной
группе альдегидов с образованием
промежуточного тетраэдрического
продукта, в котором атом кислорода
заряжен отрицательно, а атом азота —
положительно. Затем происходит перенос
протона от кислотного центра (связь
+N-H)
к основному центру (–О-),
в результате чего получается продукт
присоединения (карбиноламин), который
неустойчив и легко отщепляет воду с
образованием конечного продукта (имина).
мины
легко присоединяются по карбонильной
группе альдегидов с образованием
промежуточного тетраэдрического
продукта, в котором атом кислорода
заряжен отрицательно, а атом азота —
положительно. Затем происходит перенос
протона от кислотного центра (связь
+N-H)
к основному центру (–О-),
в результате чего получается продукт
присоединения (карбиноламин), который
неустойчив и легко отщепляет воду с
образованием конечного продукта (имина).
Формально эту реакцию можно рассматривать, как замещение атома кислорода на атом азота, однако на самом деле это последовательность реакций нуклеофильного присоединения (SN) и последующего элиминирования (Е).
В отличие от альдиминов, образование кетиминов часто требует кислотного катализа вследствие пониженной электрофильности атома углерода карбонильной группы и некоторых пространственных затруднений.
Кислоты протонируют карбонильную группу и усиливают электрофильный центр:

Все стадии этих процессов обратимы, поэтому имины в избытке воды могут подвергаться гидролизу, распадаясь на карбонильное соединение и первичный амин, особенно в кислых средах, в которых амин превращается в аммонийную соль.
Образование и гидролиз иминов играет важную роль в ряде биохимических процессов, особенно связанных с превращениями аминокислот.
