
- •Москва 2015
- •1. Введение
- •1.1. Классификация органических соединений
- •1.2. Номенклатура органических соединений.
- •Названия некоторых органических соединений и радикалов
- •2. Строение органических соединений Различные виды изомерии
- •2.1. Пространственное строение органических соединений
- •2.2. Электронное строение органических соединений
- •3. Основные закономерности протекания органических реакций
- •3.1. Типы реагентов
- •3.2. Способы разрыва ковалентной связи
- •3.3 Классификация органических реакций
- •1) По типу разрыва связей в субстрате и реагенте
- •6) Хемо- регио- и стереоселективные реакции
- •3.4 Факторы, определяющие реакционную способность органического соединения
- •4. Кислотно-основные свойства органических соединений
- •5. Свободно-радикальные реакции
- •6. Электрофильные реакции
- •6.1. Реакции электрофильного присоединения
- •6.2. Реакции электрофильного замещения в ароматическом кольце (se)
- •7.1. Реакции нуклеофильного замещения у sp3-гибридизованного атома углерода
- •7.2. Реакции элиминирования (е)
- •8. Реакционная способность соединений с карбонильной группой
- •8.1. Реакции нуклеофильного присоединения (an) к альдегидам и кетонам
- •8.2. Реакции нуклеофильного замещения у карбонильной группы в карбоновых кислотах и их функциональных производных (sn)
- •8.3. Реакции карбонильных соединений с участием подвижного α-водородного атома (сн-кислотного центра)
- •Содержание
- •1. Введение
- •1.1 Классификация органических соединений 3
8.2. Реакции нуклеофильного замещения у карбонильной группы в карбоновых кислотах и их функциональных производных (sn)
Гидролиз функциональных производных карбоновых кислот
Любые функциональные производные карбоновых кислот в тех или иных условиях способные к гидролизу.
Реакции расщепления функциональные производные карбоновых кислот могут либо катализироваться кислотами (кислотный гидролиз), при этом образуются карбоновые кислоты, либо происходить под действием щелочей (щелочной гидролиз или омыление).
а) кислотный гидролиз
Гидролиз сложных эфиров:

1-ая стадия — протонирование кислорода карбонильной группы и усиление электрофильного центра за счет образования карбокатиона;
2-ая стадия — нуклеофильная атака катонного центра молекулой воды за счет неподеленной электронной пары с образованием иона оксония;
3-я стадия — обратимый перенос протона от одного атома кислорода к другому с образованием другого иона оксония;
4-ая стадия — отщепление молекулы спирта с образование нового карбокатиона;
5-ая стадия — выброс протона (катализатора) с образование молекулы карбоновой кислоты.
Все стадии этого процесса обратимы. Обратная реакция — реакция этерификации (образования сложного эфира из кислоты и спирта). И прямая, и обратная реакции протекают по одному и тому же механизму (SN).
Гидролиз амидов:

Реакция необратима, так как ион алкиламмония лишен нуклеофильности
б) Щелочной гидролиз
Омыление амидов:

1-ая стадия — атака по карбонильной группе сильным нуклеофилом (гидроксид-ионом), приводящая к тетраэдрическому промежуточному соединению. В результате такой атаки полностью изменяется характер атома кислорода — приобретая целый отрицательный заряд, он из акцептора электронов (в исходном соединении) превращается в электронодонора (+I-эффект), сильнее поляризуется связь углерод-азот.
Бывший карбонильный атом углерода приобретает sp3-гибридизацию, исчезает явление сопряжения аминогруппы с карбонилом, освобождается электронная пара у атома азота, усиливаются его основные свойства.
2-ая стадия — отщепление молекулы аммиака или амина с образованием аниона карбоновой кислоты (карбоксилат-иона).
Щелочной гидролиз производных карбоновых кислот практически необратим, так как в результате образуется устойчивый карбоксилат-анион, в котором отрицательный заряд поровну распределяется между двумя атомами кислорода, а карбонильный углерод теряет свои электрофильные свойства (отсутствие положительного заряда).
Реакции ацилирования (SN)
Ацилирование
— введение в молекулу субстрата остатка
карбоновой кислоты (ацила
 ).
).
Общая схема реакций ацилирования:


ацилирующий субстрат продукт уходящая
реагент (нуклеофил) ацилирования группа
Ацилирование спиртов:

![]()
сложный эфир
Ацилирование тиолов:

Ацилирование аминов:

![]()
амид кислоты
Сравнительная активность функциональных производных карбоновых кислот как ацилирующих реагентов
У величение
активности:
величение
активности:
 <
< <
<![]() ≈
≈ <
<![]() <
<![]() <
<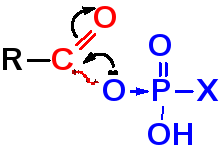 <
<
Каждый последующий член этого ряда может быть использован для получения всех предыдущих классов карбонильных соединений.
Усиление ацилирующей активности соединений в этом ряду связано с увеличением δ+ на карбонильном атоме углерода и увеличением легкости ухода уходящей группы.
Биологически важные ацилирующие реагенты
— амиды
кислот
 .
Способны только к реакциям гидролиза
в кислых или щелочных средах:
.
Способны только к реакциям гидролиза
в кислых или щелочных средах:
![]()

— сложные
эфиры
 .Способны
ацилировать аминогруппу:
.Способны
ацилировать аминогруппу:
![]()
— сложные
тиоэфиры
![]() .
Способны ацилировать амины, спирты,
фенолы. Связь С~S
макроэргическая связь (ΔGогидролиза
> 30 кДж/моль).
.
Способны ацилировать амины, спирты,
фенолы. Связь С~S
макроэргическая связь (ΔGогидролиза
> 30 кДж/моль).


![]() — Ацетилкофермент
А
– главный ацетилирующий реагент живого
организма.
— Ацетилкофермент
А
– главный ацетилирующий реагент живого
организма.

пара-аминофенол парацетамол
— ацилфосфаты
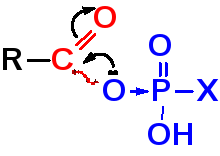 .
Наиболее активные биологические
ацилирующие реагенты. Способны ацилировать
амины, спирты , фенолы и тиолы.
.
Наиболее активные биологические
ацилирующие реагенты. Способны ацилировать
амины, спирты , фенолы и тиолы.

