
- •Москва 2015
- •1. Введение
- •1.1. Классификация органических соединений
- •1.2. Номенклатура органических соединений.
- •Названия некоторых органических соединений и радикалов
- •2. Строение органических соединений Различные виды изомерии
- •2.1. Пространственное строение органических соединений
- •2.2. Электронное строение органических соединений
- •3. Основные закономерности протекания органических реакций
- •3.1. Типы реагентов
- •3.2. Способы разрыва ковалентной связи
- •3.3 Классификация органических реакций
- •1) По типу разрыва связей в субстрате и реагенте
- •6) Хемо- регио- и стереоселективные реакции
- •3.4 Факторы, определяющие реакционную способность органического соединения
- •4. Кислотно-основные свойства органических соединений
- •5. Свободно-радикальные реакции
- •6. Электрофильные реакции
- •6.1. Реакции электрофильного присоединения
- •6.2. Реакции электрофильного замещения в ароматическом кольце (se)
- •7.1. Реакции нуклеофильного замещения у sp3-гибридизованного атома углерода
- •7.2. Реакции элиминирования (е)
- •8. Реакционная способность соединений с карбонильной группой
- •8.1. Реакции нуклеофильного присоединения (an) к альдегидам и кетонам
- •8.2. Реакции нуклеофильного замещения у карбонильной группы в карбоновых кислотах и их функциональных производных (sn)
- •8.3. Реакции карбонильных соединений с участием подвижного α-водородного атома (сн-кислотного центра)
- •Содержание
- •1. Введение
- •1.1 Классификация органических соединений 3
3.4 Факторы, определяющие реакционную способность органического соединения
Статические факторы (электронный и пространственный) — строение исходных веществ, вступающих в химическую реакцию.
Электронный фактор — распределение электронной плотности в молекуле, формирующее в ней реакционные центры (электрофильные, нуклеофильные, кислотные или основные). Он определяется электроотрицательностью атомов, входящих в молекулу, электронными эффектами заместителей, наличием сопряженных и ароматических фрагментов.
Пространственный фактор — пространственная доступность реакционного центра молекулы.
Динамический фактор — энергия образующихся в процессе реакции промежуточных активных частиц (карбокатионов, карбоанионов, свободных радикалов и др.) или переходных состояний. Чем ниже эта энергия, тем более устойчивы (стабильны) эти частицы, и тем легче протекает химическая реакция.
Энергия промежуточных частиц и переходного состояния тесно связана с возможностью делокализации (рассредоточения) электронной плотности за счет электронных эффектов заместителей. Делокализация электронной плотности всегда приводит к снижению энергии.
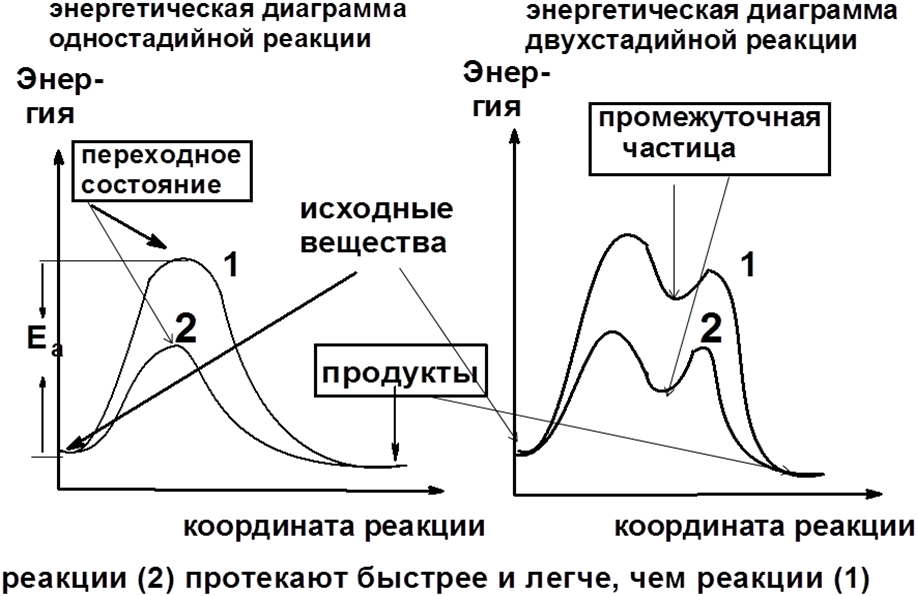
4. Кислотно-основные свойства органических соединений
В органической химии принято использовать концепцию сопряженных кислот и оснований Бренстеда-Лоури.
Кислота — частица (молекула или ион), способная отдавать протон (Н+), превращаясь при этом в сопряженное основание:
НА ⇄ А– + Н+
ВН+ ⇄ В + Н+
CH3COOH ⇄ CH3COO– + H+
CH3NH3+ ⇄ CH3NH2 + H+
кислота сопряженное основание
Сила
кислоты определяется положением
протолитического равновесия и величиной
констант кислотности:
![]() или
или
 или их рК.
рКа
= –lg
Ка
и р
или их рК.
рКа
= –lg
Ка
и р![]() = –lg
= –lg![]() .
Чем сильнее кислота, тем больше величина
Ка
или
.
Чем сильнее кислота, тем больше величина
Ка
или
![]() и тем меньше значение рКа
или
р
и тем меньше значение рКа
или
р![]() .
.
Приближенные формулы для расчета рН водных растворов слабых кислот со значениями рК от 1,5 до 12,5:
рН
= ½(рКа
– lgc)
или рН
= ½(р![]() – lgc).
– lgc).
Основание — частица (молекула или ион), способная присоединить протон (Н+), превращаясь при этом в сопряженную кислоту:
А– + Н+ ⇄ НА
В + Н+ ⇄ ВН+

![]()
основание сопряженная кислота
Сила основания в водной среде определяется положением равновесия:
В + Н2О ⇄ ВН+ + НО–
и
величиной константы основности КВ
=
![]() или его рКВ
= –lgКВ
или его рКВ
= –lgКВ
Чем
сильнее основание, тем слабее сопряженная
кислота и наоборот, чем сильнее кислота,
тем слабее сопряженное основание. Для
сопряженной пары (кислоты и основания)
КВ
×
![]() =
10–14
или
рКВ
+
р
=
10–14
или
рКВ
+
р![]() =
14.
=
14.
Приближенные формулы для расчета рН водных растворов слабых оснований с значениями рК от 1,5 до 12,5:
рН
= ½(lgc
– рКВ)
или рН
= ½(14 + р![]() + lgc).
+ lgc).
Типы органических кислот и оснований
В зависимости от того, от какого атома происходит отрыв протона, органические кислоты подразделяют на ОН-кислоты (например СН3ОН), NH-кислоты (например CH3NH3+), SH-кислоты (например CH3SH), СН-кислоты (например СН3С≡СН) и т.д.
Органические основания подразделяют на р-основания, в которых центром основности является π-связь или ароматическая электронная система, например:
СН2=СН2
или
![]()
и n-основания, в которых центром основности является неподеленная электронная пара, например:
![]()
Зависимость кислотно-основных свойств вещества от его строения
Кислотные свойства
В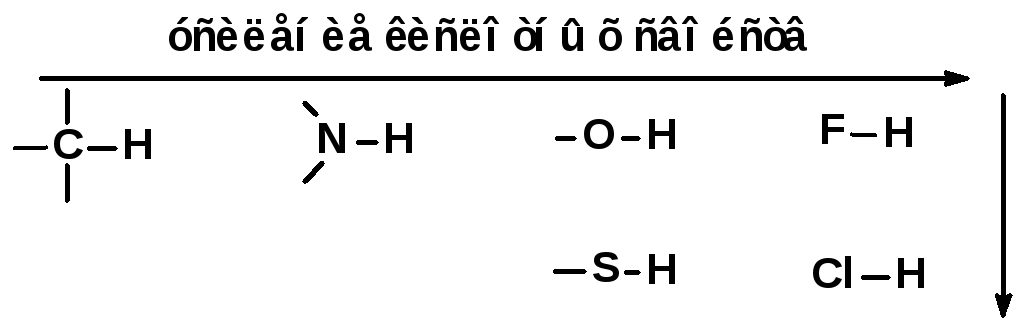 доль
периода в периодической системе элементов
полярность связи элемента с водородом
возрастает, поэтому кислотные свойства
водородных соединений также увеличиваются.
доль
периода в периодической системе элементов
полярность связи элемента с водородом
возрастает, поэтому кислотные свойства
водородных соединений также увеличиваются.
При переходе по группе сверху вниз уменьшается эффективность перекрывания малой атомной орбитали атома водорода с увеличивающейся в размерах атомной орбиталью другого атома, понижается прочность связи элемент–водород, поэтому SH-кислоты более сильные, чем ОН-кислоты.
Для кислот одного типа кислотные свойства зависят от электронных эффектов заместителей, связанных с кислотным центром. Как правило, электронодонорные заместители ослабляют кислотные свойства, а электроноакцепторные их увеличивают.
![]()

+IC2H5 –MC6H5 –MC=O
 pКа
= 16 pКа
= 10 pКа
= 4,7
pКа
= 16 pКа
= 10 pКа
= 4,7
Усиление кислотных свойств
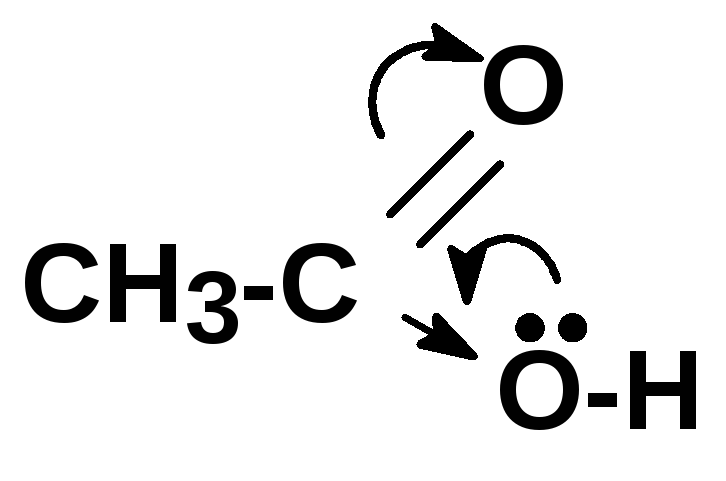
Кислотные свойства увеличиваются параллельно увеличению стабильности аниона (сопряженного основания). Чем больше возможностей делокализации отрицательного заряда в анионе, тем он устойчивей:

![]()
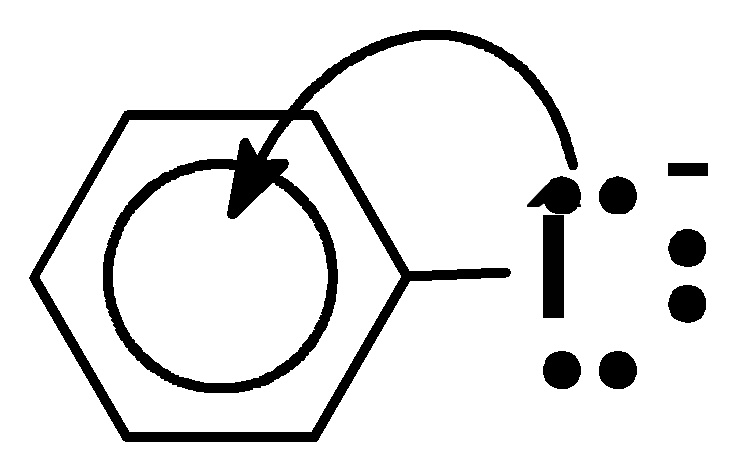

Увеличение устойчивости аниона
Для соединений одного класса:
![]()
–ICl3C IH = 0 +ICH3
К атионы
обладают более сильными кислотными
свойствами, чем соответствующие
нейтральные молекулы:
атионы
обладают более сильными кислотными
свойствами, чем соответствующие
нейтральные молекулы:
Основные свойства
Закономерности в проявлении веществами основных свойств аналогичны, но прямо противоположны:
В периодической системе элементов основные свойства усиливаются справа налево и снизу вверх.

Электронодонорные заместители усиливают основные свойства, электроноакцепторные их ослабляют.
![]()
![]()
О![]() трицательно
заряженные ионы являются более сильными
основаниями, чем соответствующие
нейтральные молекулы.
трицательно
заряженные ионы являются более сильными
основаниями, чем соответствующие
нейтральные молекулы.
