
- •Москва 2015
- •1. Введение
- •1.1. Классификация органических соединений
- •1.2. Номенклатура органических соединений.
- •Названия некоторых органических соединений и радикалов
- •2. Строение органических соединений Различные виды изомерии
- •2.1. Пространственное строение органических соединений
- •2.2. Электронное строение органических соединений
- •3. Основные закономерности протекания органических реакций
- •3.1. Типы реагентов
- •3.2. Способы разрыва ковалентной связи
- •3.3 Классификация органических реакций
- •1) По типу разрыва связей в субстрате и реагенте
- •6) Хемо- регио- и стереоселективные реакции
- •3.4 Факторы, определяющие реакционную способность органического соединения
- •4. Кислотно-основные свойства органических соединений
- •5. Свободно-радикальные реакции
- •6. Электрофильные реакции
- •6.1. Реакции электрофильного присоединения
- •6.2. Реакции электрофильного замещения в ароматическом кольце (se)
- •7.1. Реакции нуклеофильного замещения у sp3-гибридизованного атома углерода
- •7.2. Реакции элиминирования (е)
- •8. Реакционная способность соединений с карбонильной группой
- •8.1. Реакции нуклеофильного присоединения (an) к альдегидам и кетонам
- •8.2. Реакции нуклеофильного замещения у карбонильной группы в карбоновых кислотах и их функциональных производных (sn)
- •8.3. Реакции карбонильных соединений с участием подвижного α-водородного атома (сн-кислотного центра)
- •Содержание
- •1. Введение
- •1.1 Классификация органических соединений 3
3. Основные закономерности протекания органических реакций
Под реакционной способностью вещества подразумевают его способность вступать в ту или иную химическую реакцию и реагировать с большей или меньшей легкостью.
При химических превращениях органического вещества, изменения, как правило, происходят лишь в определенном месте молекулы, а остальная ее часть сохраняется неизменной.
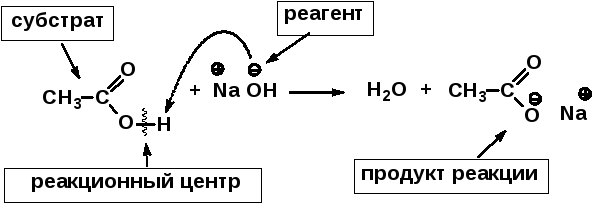
Реакционный центр — атом или группа атомов в молекуле, непосредственно участвующие в химической реакции.
Механизм реакции — детальное описание всех элементарных стадий процесса, в результате которого исходные вещества превращаются в конечные продукты, включающее его стереохимические, кинетические и термодинамические аспекты.
Если в элементарной стадии органической реакции участвуют две частицы, то обычно можно выделить субстрат и реагент:
Субстрат — органическое вещество, подвергающееся изменениям в результате химической реакции.
Реагент — молекула или другая частица, под действием которой эти изменения происходят.
Понятия субстрата и реагента относительны и часто зависят от того, как рассматривать данную реакцию. Если одна реагирующих частиц органическая, а другая — неорганическая, то реагентом считается неорганическая частица, например:
3.1. Типы реагентов
1) Кислотные реагенты (кислоты) — доноры протона по отношению к реакционному партнеру — частично или нацело ионизированные в водных растворах нейтральные молекулы (HCl, CH3COOH) или положительно заряженные частицы (NH4+,H3O+).
2)
Основные реагенты (основания, В)
— акцепторы
протона по отношению к реакционному
партнеру; отрывают протон от кислотного
центра —
отрицательно
заряженные частицы (B–
—
HO–,
CH3O–)или
нейтральные молекулы (B
—
![]() ,
,
![]() ).
).
3)
Нуклеофильные реагенты (нуклеофилы) —
частицы,
образующие новую ковалентную связь за
счет своей электронной пары. Они обладают
повышенной электронной плотностью,
взаимодействуют с любым атомом3,
несущим частичный или полный положительный
заряд; нуклеофил
заряжен отрицательно или имеет
неподеленную пару электронов или
p-связь.
Nu
или Nu–
— Cl–,
HO–,
CH3O–,
R3C–
(карбоанион), CH2=CH2,
C6H6,
![]() ,
,
![]() .
.
4)
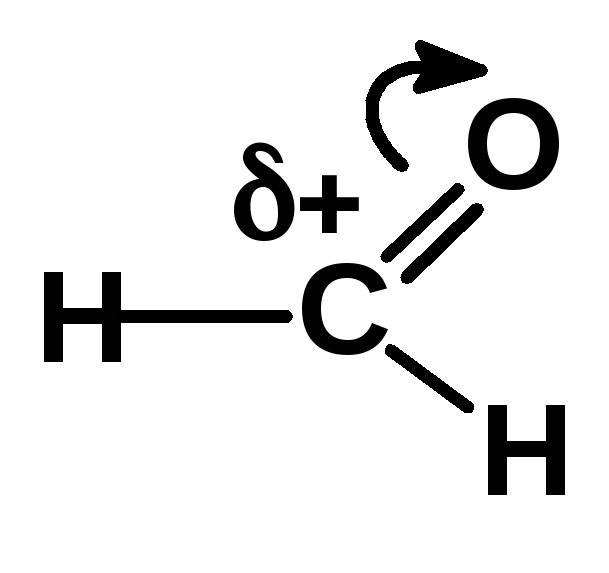
Электрофильные реагенты (электрофилы)
—
частицы,
образующие новую ковалентную связь за
счет пары электронов партнера. Они имеют
недостаток электронов, взаимодействуют
с реакционным центром партнера, имеющим
повышенную электронную плотность,
содержат атом, несущий частичный или
полный положительный заряд или обладают
вакантной орбиталью. E
или E+
— H+,
Cl+,
AlCl3,
SO3,
R3C+
(карбокатион), RC(O)+,
 .
.
5) Радикальные реагенты (свободные радикалы) — свободные атомы или частицы с неспаренным электроном. R• — Cl•, Br•, HOO•, R•, •O—O• (бирадикал).
6) Окислители — нейтральные молекулы или ионы, принимающие электроны или атомы водорода от органического субстрата. [O] (или Ox) — O2, Fe3+, органические окислители.
7) Восстановители — нейтральные молекулы или ионы, отдающие электроны или атомы водорода органическому субстрату. [H] (или Red) — H2, Fe2+, H–, органические восстановители.
