
- •Москва 2015
- •1. Введение
- •1.1. Классификация органических соединений
- •1.2. Номенклатура органических соединений.
- •Названия некоторых органических соединений и радикалов
- •2. Строение органических соединений Различные виды изомерии
- •2.1. Пространственное строение органических соединений
- •2.2. Электронное строение органических соединений
- •3. Основные закономерности протекания органических реакций
- •3.1. Типы реагентов
- •3.2. Способы разрыва ковалентной связи
- •3.3 Классификация органических реакций
- •1) По типу разрыва связей в субстрате и реагенте
- •6) Хемо- регио- и стереоселективные реакции
- •3.4 Факторы, определяющие реакционную способность органического соединения
- •4. Кислотно-основные свойства органических соединений
- •5. Свободно-радикальные реакции
- •6. Электрофильные реакции
- •6.1. Реакции электрофильного присоединения
- •6.2. Реакции электрофильного замещения в ароматическом кольце (se)
- •7.1. Реакции нуклеофильного замещения у sp3-гибридизованного атома углерода
- •7.2. Реакции элиминирования (е)
- •8. Реакционная способность соединений с карбонильной группой
- •8.1. Реакции нуклеофильного присоединения (an) к альдегидам и кетонам
- •8.2. Реакции нуклеофильного замещения у карбонильной группы в карбоновых кислотах и их функциональных производных (sn)
- •8.3. Реакции карбонильных соединений с участием подвижного α-водородного атома (сн-кислотного центра)
- •Содержание
- •1. Введение
- •1.1 Классификация органических соединений 3
2. Строение органических соединений Различные виды изомерии
|
Изомеры |
Структурные (изомеры строения) |
углеродного скелета |
|||
|
положения кратной связи |
|||||
|
положения функциональной группы |
|||||
|
межклассовые (функциональных групп) |
|||||
|
Пространственные стереоизомеры |
Конформации* |
заслоненная |
|||
|
заторможенная |
гош |
||||
|
анти |
|||||
|
Конфигура- ционные |
Энантиомеры |
D |
|||
|
L |
|||||
|
Диастереомеры |
p-диастереомеры (цис-транс относительно плоскости p-связи) |
||||
|
s-диастерео- меры |
цис-транс относительно плоскости цикла |
||||
|
соединения, имеющие более 1-го асим- метрического атома |
|||||
*Конформации можно считать изомерами (конформерами), только если они достаточно медленно превращаются друг в друга и могут быть разделены.
2.1. Пространственное строение органических соединений
Пространственное строение молекулы — взаимное расположение атомов и атомных групп в пространстве.
С тереохимическая
формула
— способ изображения пространственного
строения молекулы на плоскости.
тереохимическая
формула
— способ изображения пространственного
строения молекулы на плоскости.
 —
связь,
лежащая в плоскости чертежа,
—
связь,
лежащая в плоскости чертежа,
![]() — связь,
выходящая вперед из плоскости чертежа
— связь,
выходящая вперед из плоскости чертежа
![]() — связь,
уходящая назад за плоскость чертежа
— связь,
уходящая назад за плоскость чертежа
Конформации — формы молекул, возникающие в результате поворота одной части молекулы относительно другой вокруг σ-связи.
Среди большого числа возможных конформаций выделяют менее устойчивые (заслоненные) и более устойчивые (заторможенные). Из заслоненных конформаций наименее устойчивы те, в которых наиболее сближены объемные атомы ид группы атомов. Из заторможенных наиболее устойчивы те, в которых объемные атомы или группы атомов наиболее удалены друг от друга (анти), или те, в которых возможно образование внутримолекулярных водородных связей (гош).
Н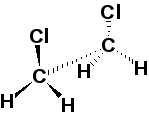

 екоторые
конформации 1,2-дихлороэтана:
екоторые
конформации 1,2-дихлороэтана:
стереохимические
формулы



формулы Ньюмена
з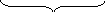 аслоненная скошенная
(гош) анти
аслоненная скошенная
(гош) анти
заторможенные
Конфигурационные изомеры
Конфигурация молекулы — взаимное расположение атомов и атомных групп в пространстве без учета возможных конформаций.
Хиральность — свойство предмета не совпадать со своим зеркальным отображением.
Асимметрический атом углерода (хиральный центр) — атом углерода, связанный с четырьмя различными атомами или атомными группами.
Энантиомеры (зеркальные изомеры, оптические антиподы) — пространственные изомеры, отличающиеся друг от друга, как предмет и его зеркальное отображение.
Пример: 2,3-Дигидроксипропаналь (глицериновый альдегид)


-
— асимметрический
атом углерода
энантиомеры
В обычных условиях энантиомеры не различаются по физическим и химическим свойствам. Оптически активны.
Оптическая активность — свойство вещества изменять плоскость поляризации плоскополяризованного света.
Формулы Фишера
Асимметрический атом углерода находится на пересечении вертикальной и горизонтальной черты. Горизонтальные линии соответствуют связям, направленным вперед из плоскости чертежа; вертикальные — связям, направленным назад за плоскость чертежа.

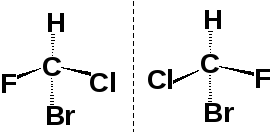
формулы Фишера соответствующие стереохимические формулы
Правила обращения с формулами Фишера:
— поворот на 90о приводит к формуле другого изомера, поворот на 180о не изменяет строение вещества.
— перемена местами двух любых заместителей (одна перестановка) также приводит к формуле другого изомера, две перестановки не изменяют строение вещества.
Определение D или L-конфигурации:
— записать формулу Фишера так, чтобы углеродная цепь располагалась сверху вниз (наиболее окисленный атом углерода находится сверху).
— если
функциональная группа окажется справа,
то это D-изомер,
если слева — L-изомер.
если
функциональная группа окажется справа,
то это D-изомер,
если слева — L-изомер.

L-глицериновый альдегид D-глицериновый альдегид
Диастереомеры — незеркальные пространственные изомеры
Примеры:
б
 утен-2
1,3-диметициклобутан
утен-2
1,3-диметициклобутан
цис


транс
π-диастереомеры σ-диастереомеры
(относительно плоскости π-связи) (относительно плоскости цикла)
Диастереомеры различаются по своим физическим и химическим свойствам.
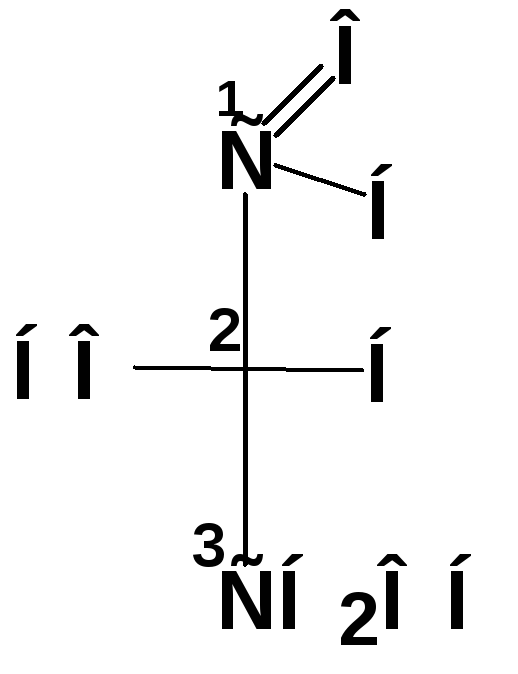
Соединения с несколькими хиральными центрами
Если молекула вещества содержит n асимметрических атомов углерода, число возможных пространственных изомеров этого вещества равно 2n (2n-1 пар энантиомеров).
П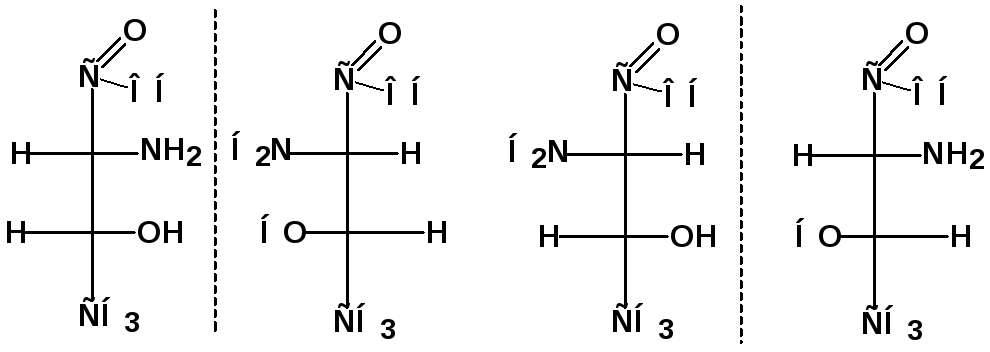 ример:
аминокислота треонин
ример:
аминокислота треонин
![]()

