
- •Москва 2015
- •1. Введение
- •1.1. Классификация органических соединений
- •1.2. Номенклатура органических соединений.
- •Названия некоторых органических соединений и радикалов
- •2. Строение органических соединений Различные виды изомерии
- •2.1. Пространственное строение органических соединений
- •2.2. Электронное строение органических соединений
- •3. Основные закономерности протекания органических реакций
- •3.1. Типы реагентов
- •3.2. Способы разрыва ковалентной связи
- •3.3 Классификация органических реакций
- •1) По типу разрыва связей в субстрате и реагенте
- •6) Хемо- регио- и стереоселективные реакции
- •3.4 Факторы, определяющие реакционную способность органического соединения
- •4. Кислотно-основные свойства органических соединений
- •5. Свободно-радикальные реакции
- •6. Электрофильные реакции
- •6.1. Реакции электрофильного присоединения
- •6.2. Реакции электрофильного замещения в ароматическом кольце (se)
- •7.1. Реакции нуклеофильного замещения у sp3-гибридизованного атома углерода
- •7.2. Реакции элиминирования (е)
- •8. Реакционная способность соединений с карбонильной группой
- •8.1. Реакции нуклеофильного присоединения (an) к альдегидам и кетонам
- •8.2. Реакции нуклеофильного замещения у карбонильной группы в карбоновых кислотах и их функциональных производных (sn)
- •8.3. Реакции карбонильных соединений с участием подвижного α-водородного атома (сн-кислотного центра)
- •Содержание
- •1. Введение
- •1.1 Классификация органических соединений 3
7.2. Реакции элиминирования (е)
Конкуренция реакций замещения и отщепления. Реакции нуклеофильного замещения часто сопровождаются реакциями элиминирования, связанными с наличием в субстрате СН-кислотного центра:

Если на этилбромид действовать разбавленным раствором щелочи, преимущественно идет реакция замещения. Под действием концентрированного или спиртового раствора щелочи преобладает реакция элиминирования. Повышение температуры также благоприятствует реакциям отщепления, что связано с увеличением числа частиц (возрастание энтропии).
Ассоциативный механизм Е2 (бимолекулярное элиминирование)

основание переходное состояние
П од
действием серной кислоты при нагревании
происходит элиминирование воды (реакция
дегидратации), например:
од
действием серной кислоты при нагревании
происходит элиминирование воды (реакция
дегидратации), например:
диссоциативный
механизм
Е1 (мономолекулярное
элиминирование)
Эмпирическое правило Зайцева — при отщеплении галогеноводорода от алкилгалогенида или воды от спирта происходит преимущественное отщепление протона от атома углерода, содержащего минимальное число атомов водорода, т. е. от наименее «гидрогенизированного» атома углерода.
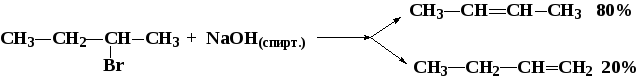
Дегидратация β-гидроксикарбонильных соединений (реакция имеет важное биологическое значение – промежуточная стадия ряда биохимических процессов).

Вследствие высокой СН-кислотности у α-углеродного атома реакция проходит легко при небольшом нагревании или ферментативно с образованием α,β-ненасыщенных карбонильных соединений.
8. Реакционная способность соединений с карбонильной группой
О сновные
классы карбонильных соединений:
сновные
классы карбонильных соединений:
Альдегиды — органические соединения, содержащие атом
водорода, связанный с карбонильной группой
![]() Кетоны
— соединения, содержащие два органических
Кетоны
— соединения, содержащие два органических
радикала, связанных с карбонильной группой.
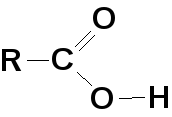
Карбоновые кислоты — соединения, содержащие
гидроксильную группу, связанную с карбонильной группой
Ф
 ункциональные
производные карбоновых кислот —
органические соединения, в результате
гидролиза которых образуются карбоновые
кислоты:
ункциональные
производные карбоновых кислот —
органические соединения, в результате
гидролиза которых образуются карбоновые
кислоты:
— сложные эфиры; — сложные тиоэфиры;


 —
амиды кислот: и — замещенные амиды;
—
амиды кислот: и — замещенные амиды;


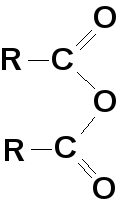
— соли; — ангидриды — галогенангидриды
 кислот; кислот
кислот; кислот
![]() —
смешанные ангидриды — нитрилы кислот.
—
смешанные ангидриды — нитрилы кислот.
(ацилфосфаты);
Реакционные центры в карбонильных соединениях
Распределение электронной плотности в карбонильных соединениях в первую очередь определяется полярностью карбонильной группы:
![]()
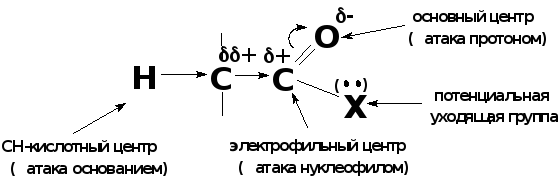
Атака основного центра протоном приводит к образованию карбокатиона, таким образом происходит усиление электрофильного центра, а также увеличение СН-кислотности α-углеродного атома, что может привести к образованию енола.

карбокатион енол
Енолы — органические соединения, содержащие гидроксильную группу непосредственно у двойной углерод–углеродной связи.
Явление динамического равновесия между изомерами называется таутомерией. Для карбонильных соединений — это кето-енольная таутомерия. Кислоты катализируют взаимные превращения кетонной и енольной форм.
Атака СН-кислотного центра основанием приводит к образованию карбоаниона (енолят-иона, стабилизированного сопряжением освободившейся после удаления протона электронной пары на α-углеродном атоме с карбонильной группой). Енолят-ион обладает сильным нуклеофильным центром (атом углерода) и основным центром (атом кислорода).

енолят-ион енол
Енолят-ионы, образующиеся под действием оснований играют важную роль во многих биосинтетических реакциях. Основания также катализируют установление кето-енольного равновесия.
А така
электрофильного центра нуклеофилом
приводит сначала к образованию
промежуточного тетраэдрического
продукта с sp3-гибридизованным
атомом углерода, который затем либо
присоединяет электрофил (протон) —
реакция нуклеофильного присоединения
(АN),
либо выбрасывает потенциальную уходящую
группу — реакция нуклеофильного
замещения (SN).
така
электрофильного центра нуклеофилом
приводит сначала к образованию
промежуточного тетраэдрического
продукта с sp3-гибридизованным
атомом углерода, который затем либо
присоединяет электрофил (протон) —
реакция нуклеофильного присоединения
(АN),
либо выбрасывает потенциальную уходящую
группу — реакция нуклеофильного
замещения (SN).
тетраэдрический
промежуточный
продукт
Реакции нуклеофильного присоединения более характерны для альдегидов и кетонов, реакции нуклеофильного замещения наблюдаются в основном у карбоновых кислот и их производных.
