- •Москва 2015
- •1. Введение
- •1.1. Классификация органических соединений
- •1.2. Номенклатура органических соединений.
- •Названия некоторых органических соединений и радикалов
- •2. Строение органических соединений Различные виды изомерии
- •2.1. Пространственное строение органических соединений
- •2.2. Электронное строение органических соединений
- •3. Основные закономерности протекания органических реакций
- •3.1. Типы реагентов
- •3.2. Способы разрыва ковалентной связи
- •3.3 Классификация органических реакций
- •1) По типу разрыва связей в субстрате и реагенте
- •6) Хемо- регио- и стереоселективные реакции
- •3.4 Факторы, определяющие реакционную способность органического соединения
- •4. Кислотно-основные свойства органических соединений
- •5. Свободно-радикальные реакции
- •6. Электрофильные реакции
- •6.1. Реакции электрофильного присоединения
- •6.2. Реакции электрофильного замещения в ароматическом кольце (se)
- •7.1. Реакции нуклеофильного замещения у sp3-гибридизованного атома углерода
- •7.2. Реакции элиминирования (е)
- •8. Реакционная способность соединений с карбонильной группой
- •8.1. Реакции нуклеофильного присоединения (an) к альдегидам и кетонам
- •8.2. Реакции нуклеофильного замещения у карбонильной группы в карбоновых кислотах и их функциональных производных (sn)
- •8.3. Реакции карбонильных соединений с участием подвижного α-водородного атома (сн-кислотного центра)
- •Содержание
- •1. Введение
- •1.1 Классификация органических соединений 3
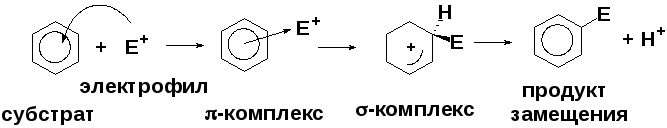
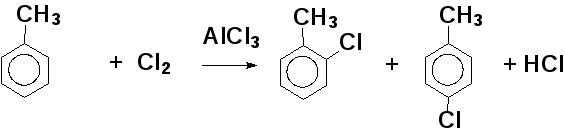
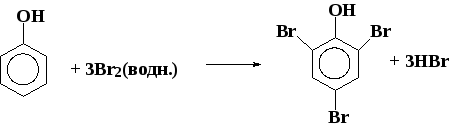
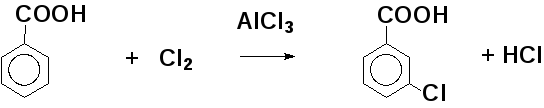
6.2. Реакции электрофильного замещения в ароматическом кольце (se)
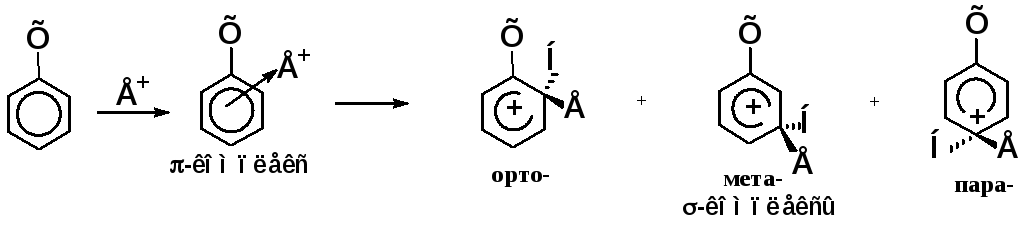
Схема механизма электрофильного замещения:
Строение σ-комплекса:
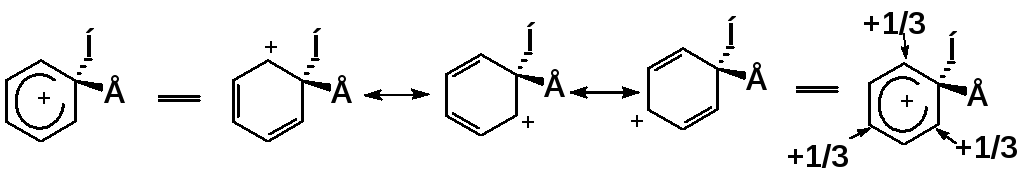
резонансные (мезомерные) структуры распределение заряда
Положительный заряд распределяется по орто- и пара-положениям относительно sp3-гибридизованного атома углерода.
Примеры реакций электрофильного замещения:
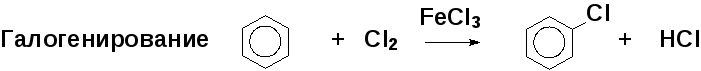
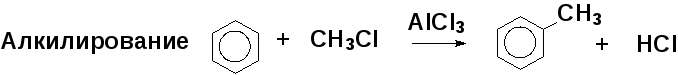
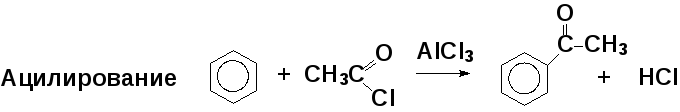
Роль катализатора — образование электрофильной частицы, например для алкилирования:
![]()
Алкилирование алкенами
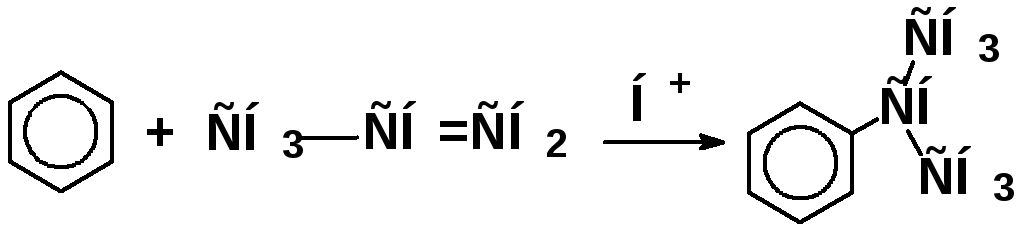
роль катализатора:
![]()
спиртами
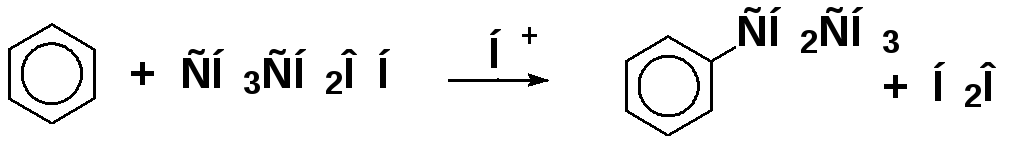
роль катализатора:
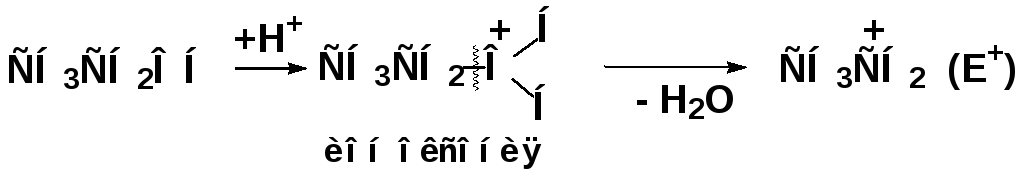
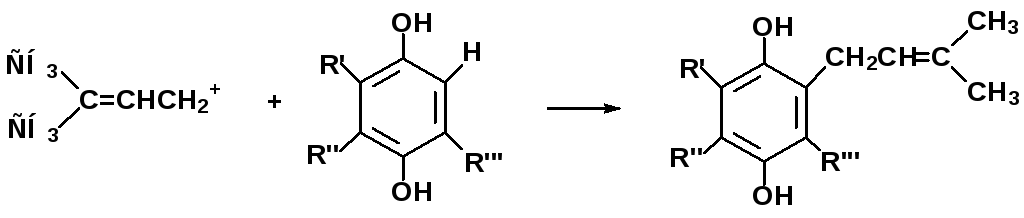
Алкилирование ароматических соединений карбокатионами в биохимических реакциях
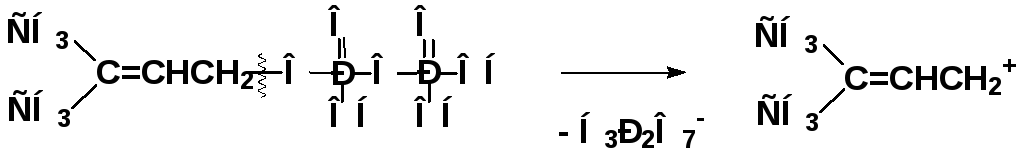
3-метилбутен-2-илдифосфат катион аллильного типа
двухатомный промежуточный продукт
фенол биосинтеза ряда коферментов
и витаминов
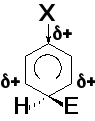
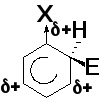
Региоселективность реакций электрофильного замещения (ориентирующее влияние заместителей)
σ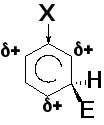
 -Комплексы
с донорным
заместителем Х:
-Комплексы
с донорным
заместителем Х:
 заместитель
заместитель заместитель
заместитель
заместитель заместитель
эффективно непосредственно эффективно
уменьшает не влияет на уменьшает
заряд заряд заряд
наименее устойчивая частица
Электронодонорные заместители (заместители I рода) облегчают реакции электрофильного замещения и направляют входящую группу в орто- и пара-положения (-OH, -OR, NH2, NHR, -NR2, NHC(O)R, Cl, Br, I (+M-эффект > -I-эффекта) CH3 и другие алкилы (+I-эффект)
σ
 -Комплексы
с акцепторным
заместителем Х:
-Комплексы
с акцепторным
заместителем Х:
 заместитель
заместитель заместитель
заместитель
заместитель заместитель
эффективно непосредственно эффективно
увеличивает не влияет на увеличивает
заряд заряд заряд
наиболее устойчивая частица
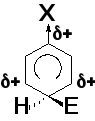
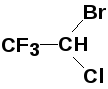
Электроноакцепторные заместители (заместители II рода) затрудняют реакции электрофильного замещения и направляют входящую группу в мета-положение (-CºN, -C(O)H, -C(O)R, -COOH, -COOR, -NO2, -SO3H (-I-, -M-эффекты); - NH3+, - NR3+, -CF3, -CCl3 (-I-эффект)
Влияние изменения механизма реакции на направление процесса
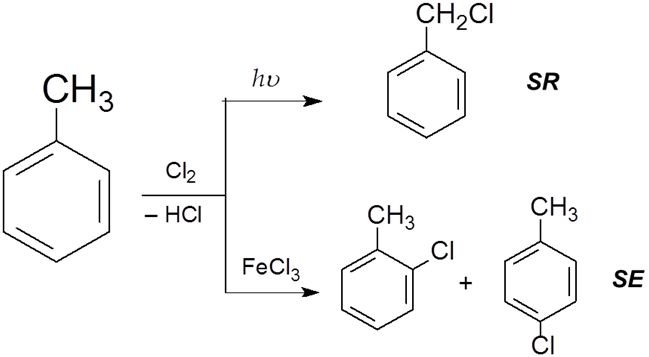
7. Реакционная способность соединений с σ-связью углерод-гетероатом. (В органической химии гетероатом – атом любого элемента, кроме углерода и водорода)
– галогенопроизводные (σ-связь углерод-галоген)
R–F, R–Cl, R-Br, R–I.
 —
фторотан (средство для наркоза)
—
фторотан (средство для наркоза)
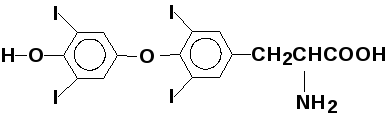
— тироксин (один из гормонов щито-
видной железы)
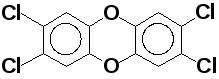 —
диоксин (один из
наиболее опасных агентов
—
диоксин (один из
наиболее опасных агентов
загрязнения окружающей среды)
– соединения с σ-связью углерод-кислород
![]() — спирты;
— спирты;
![]() — фенолы и енолы; R–O–R
— простые эфиры; R–O–O–R
— пероксиды; R–O–O–H
— гидропероксиды.
— фенолы и енолы; R–O–R
— простые эфиры; R–O–O–R
— пероксиды; R–O–O–H
— гидропероксиды.
– соединения с σ-связью углерод-сера
R–S–H — тиолы; R–S–R — сульфиды; R–S–S–R — дисульфиды;
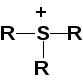 — третичные
сульфониевые соединения; R–SO3H
— сульфокислоты.
— третичные
сульфониевые соединения; R–SO3H
— сульфокислоты.
– соединения с σ-связью углерод-азот
R–NH2
— первичные амины;
![]() — вторичные амины;
— вторичные амины;
![]() — третичные амины;
— третичные амины;
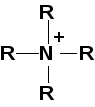 — четвертичные аммониевые соединения:
R–NO2
— нитросоединения.
— четвертичные аммониевые соединения:
R–NO2
— нитросоединения.
Распределение электронной плотности и реакционные центры в таких соединениях
В
рассматриваемых классах соединений
фактором, определяющим их реакционную
способность, является полярность связи
углерод-гетероатом:
![]() .
.
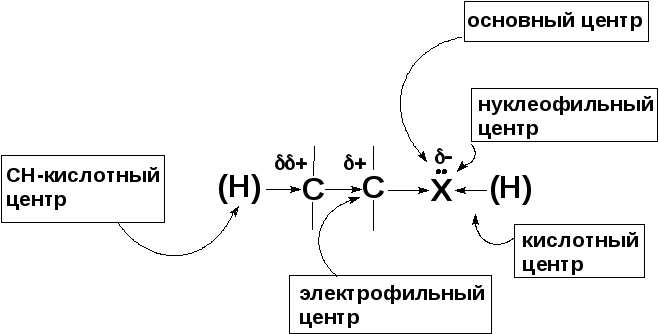
Если гетероатом связан с атомом водорода, как, например, в спиртах и тиолах, то связь Х–Н является кислотным центром молекулы. Наличие неподеленной электронной пары на гетероатоме обуславливает наличие основного и нуклеофильного центров. Атом углерода, связанный с гетероатомом, несет частичный положительный заряд и является электрофильным реакционным центром. Электроноакцепторное влияние гетероатома частично передается и на второй атом углерода, несколько поляризуя связь С–Н, и создавая слабый СН-кислотный центр.
Проявление кислотных свойств:
Спирты не взаимодействуют с щелочами, реагируют с активными металлами, образуя алкоксиды (алкоголяты):
2С2Н5ОН + 2Na → 2C2H5ONa + H2
этоксид натрия
Фенолы проявляют более сильные кислотные свойства, образуя феноксиды при взаимодействии с щелочами:
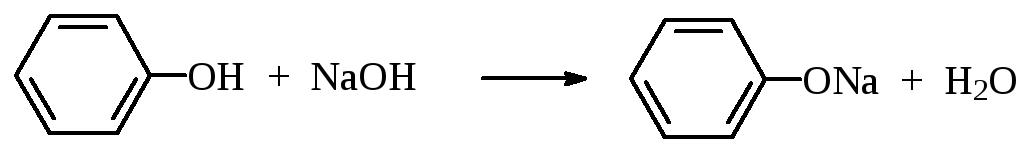
феноксид натрия
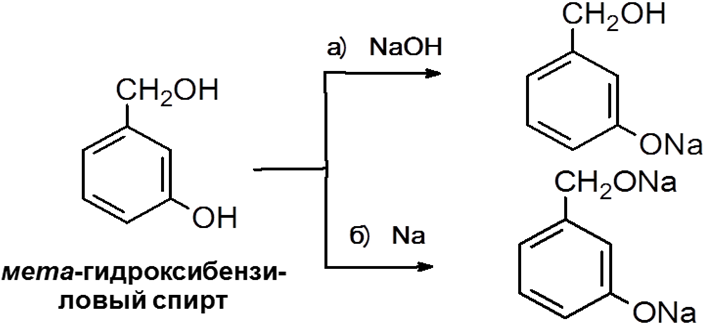
Реакция а) хемоселективна, реакция б) нехемоселективна.
Тиолы по своим кислотным свойствам похожи на фенолы:
C2H5SH + NaOH → C2H5SNa + H2O
этантиолят натрия
Проявление основных свойств
Наиболее выраженными основными свойствами обладают амины — при взаимодействии с кислотами образуются устойчивые соли, которые можно выделить в индивидуальном состоянии:
С2H5NH2 + HCl → [C2H5NH3]Cl
хлорид этиламмония
Спирты и простые эфиры проявляют очень слабые основные свойства, образуя с сильными кислотами неустойчивые оксониевые соли, распадающиеся при попытке их выделения:
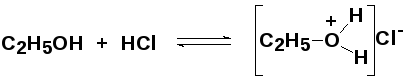 (хлорид
этилоксония)
(хлорид
этилоксония)
![]() (гидросульфат
диэтилоксония)
(гидросульфат
диэтилоксония)
Нуклеофильность — стремление к взаимодействию с атомом, имеющим целый или частичный положительный заряд (кроме атома водорода).
Нуклеофильность атома, обладающего свободной электронной парой, в периоде возрастает параллельно с увеличением основности справа налево, что связано с увеличением размера атома, уменьшением его электроотрицательности и, как следствие, с увеличением доступности этой электронной пары. В группе периодической системы изменение электроотрицательности противоположно изменению основности – увеличение нуклеофильности сверху вниз связано с увеличением поляризуемости электронной оболочки атома.