
- •Лекция 1.
- •Экономические аспекты борьбы с коррозией.
- •Классификация коррозионных процессов.
- •Показатели коррозионной стойкости металлов и сплавов.
- •– Отрицательный весовой показатель, используется, когда в процессе коррозии масса образца уменьшается. Образуются либо хорошо растворимые соединения металла, либо (не сказал что).
- •Атомы водорода в дефектах кристаллической решетки могут образовывать молекулу водорода h2, которая имеет гораздо большие размеры и выйти из кристаллической решетки уже не может.
- •Условие сплошности оксидных плёнок.
- •Логарифмический закон.
- •Механизмы диффузии ионов в кристаллической решётке оксидов.
- •Лекция 4.
- •Способы защиты металлов от газовой коррозии.
- •Оксид легирующего компонента должен обладать меньшей электропроводностью по сравнению с оксидами защищаемых металлов.
- •Активные катионы, перешедшие в раствор электролита.
- •Необратимые потенциалы металлы.
- •Термодинамика коррозионных процессов.
- •Диаграмма коррозионного процесса.
- •Особенности катодной реакции водородной деполяризации.
- •Коррозионные процессы с кислородной деполяризацией.
- •Лекция 8.
- •Влияние процесса водородной деполяризации на кислородную деполяризацию.
- •Особенности катодной реакции ионизации кислорода при коррозии металлов.
- •Способы защиты металлов от процессов коррозии с кислородной деполяризацией.
- •Плёночная теория.
- •Обобщённая анодная поляризационная кривая окисления металлов.
- •Лекция 11.
- •Отрицательный защитный эффект.
- •Практические выводы из теории катодной электрохимической защиты.
- •1. Защита от внешнего источника постоянного тока. Применяют для металлоконструкций из стальных, низко- и средне легированных сталей (3-10%), сплавов меди и титана и других.
- •2. Катодная защита с помощью протектора.
- •Коррозия под действием блуждающих токов. Дренажная защита.
- •Дренажная защита.
- •Анодная электрохимическая защита.
- •Способы перевода коррозионной системы в устойчивое пассивное состояние.
- •Воздействуя на характер анодного процесса металла.
- •Лекция 14.
- •Анодная электрохимическая защита от внешнего источника тока.
- •Защита металлов от коррозии с помощью ингибиторов.
- •Анодные ингибиторы.
- •Катодные ингибиторы.
Диаграмма коррозионного процесса.
Это графическая зависимость изменения потенциалов анода и катода от плотности тока.
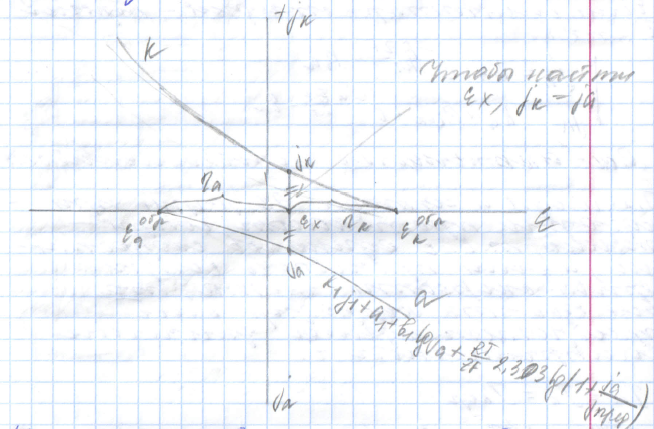
Графическая зависимость изменения рабочего потенциала анода или катода от плотности тока и называется анодной или катодной поляризационной кривой. Они берут начало из точек обратимых потенциалов для анодной или катодной электрохимических реакций.


Или
наоборот, основное уравнение
электрохимической кинетики описывает
зависимость скорости процесса от
величины потенциала (поляризации), если
лимитирующей стадией переноса электронов

Так как анодная и катодная электрохимические реакции при коррозии протекают сопряженно (с одинаковыми скоростями), если пренебречь сопротивлением раствора электролита, то вся поверхность корродирующего металла приобретёт единое значение компромиссного потенциала




Лекция 7.
Коррозионная диаграмма Эванса.
Это графическое изображение изменения поляризации для анодной и катодной электрохимических реакций от силы или плотности тока.


-
При замыкании анода и катода проводником первого рода в системе появится электрический ток. По металлу он обусловлен движением электронов от анодных участков к катодным, по электролиту – встречным движением ионов.

Если Rэл = 0, то в системе достигается максимальный ток коррозии



Вся
электродвижущая сила будет расходоваться
на анодную и катодную поляризации. Такая
система называется полностью
заполяризованной, в ней устанавливается
единое значение компромиссного потенциала

-
Если
 ,
то в системе возникает падение напряжения
на этом сопротивлении
,
то в системе возникает падение напряжения
на этом сопротивлении


Часть электродвижущей силы будет расходоваться на падение напряжения в электролите, меньше будут величины анодной и катодной поляризации, а следовательно – и скорости анодной и катодной реакций


При наличии сопротивления раствора электролита, будет устанавливаться фактическая величина тока коррозии. В этом случае не достигается единый компромиссный потенциал системы, т.е. под фактическим током коррозии на анодных и катодных участках устанавливаются свои значения рабочих потенциалов, разность между которыми – dU.

Зная характер катодной и анодной поляризационной кривой (описывается уравнением для поляризации лимитирующей стадии) и величину удельного сопротивления электролита, фактический ток коррозии и величины рабочих потенциалов катода и анода можно найти графически, графически сложив при постоянных значениях тока падение напряжения в электролите с анодной (или катодной) поляризацией.
Точка пересечения суммарной кривой катода + dUэл с анодной кривой (т. А), экстраполяция на ось потенциалов, позволяет определить величину рабочего потенциала анода, а экстраполяция на ось токов – величину фактического тока коррозии.
При этом фактическом токе т. В мы получаем величину рабочих потенциалов для катода.


О степени заторможенности отдельных стадий коррозионного процесса судят по величине их сопротивлений.

P
– поляризуемость данной реакции. Её
численная величина также может быть
определена графически, как тангенс угла
наклона касательной к поляризационной
кривой при фактическом токе.


Стадия, протекающая с наибольшими торможениями, с наибольшим сопротивлением, и будет определять скорость всего процесса, поэтому её называют контролирующей. Численно её величину находят по степени контроля в каждой стадии.

Степень контроля определяется как вклад в торможение или поляризацию данной стадии в сумме всех торможений, выраженный в процентах.



Возможные случаи контроля.



Таким образом, графический анализ коррозионного процесса проводится с целью выявления стадии, протекающей с наибольшими затруднениями, скорость которой будет контролировать или определять скорость всего процесса.
Чтобы наиболее эффективно тормозить коррозионный процесс (защищать металл от коррозии), нужно воздействовать на контролирующую стадию.
Способ воздействия будет зависеть от природы поляризации – природы лимитирующей стадии (например, при электрохимической анодной или катодной электрохимической реакции).
Катодные процессы. Коррозионные процессы с водородной деполяризацией.
В общем случае, это катодная реакция, в которой участвует протон водорода и её протекание сопровождается выделением пузырьков газообразного водорода.
В зависимости от кислотности среды, суммарная катодная реакция может быть записана как:
-
В кислых средах:

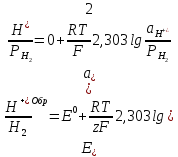
Только когда образовавшиеся пузырьки водорода на поверхности металла будут отрываться, можно говорить, что парциальное давление водорода близко к 1 атмосфере.
При


-
В нейтральных и щелочных средах:



С
точки зрения термодинамики, процесс
коррозии металла может протекать с
водородной деполяризацией, если обратимый
потенциал анодной реакции коррозии
металла будет отрицательнее обратимого
потенциала водородного электрода. 
Но реально водород будет выделяться на катодных участках поверхности металла только если рабочий потенциал в поверхности катодных участков будет отрицательнее обратимого потенциала водородного электрода.
Из диаграммы следует, что, с термодинамической точки зрения, при коррозии данного металла возможно протекание электрохимической реакции выделения водорода на катоде для первой и второй систем.
С
кинетической точки зрения, реакция
выделения водорода будет протекать для
системы 1, для которой
 будет отрицательнее
будет отрицательнее
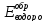 в системе 2.
в системе 2.
Рабочих потенциал системы 2 будет положительнее потенциала обратимого электрода, поэтому процесс коррозии не будет сопровождаться выделением водорода.
Механизм катодной реакции выделения водорода включает ряд последовательных стадий:

-
Диффузия H3O+ к поверхности катода (в диффузионной части ДЭС)
-
Дегидратация на границе плотной и диффузионной частей
-
Адсорбция H+ на поверхности катода
-
Перенос электрона – разряд - медленная
-
Перемещение по поверхности катода и внедрение в металл
-
Молизация [воссоединение ионов противоположных знаков в нейтральные молекулы] Hадс + Hадс -> H2 - медленная
-
Рост пузырька и отрыв от поверхности.
Наиболее часто самыми медленными являются стадии разряда (переноса иона через границу фаз) и стадия молизации. В следствие аномальной подвижности ионов водорода, транспортные стадии протекают легко и быстро
В случае лимитирующих стадий:


K1 – константа скорости электрохимической реакции, бета – коэффициент переноса для электрохимической реакции (показывает, какая доля внешней катодной поляризации будет расходоваться на уменьшение энергии активации для реакции переноса электрона); пси – электрокинетический потенциал (скачок потенциала) между плотной и диффузионной частями ДЭС, зависящий от его строения, влияния пав;

Сводится к уравнению Тафеля.
Константа
а зависит от природы металла, состава
электролита и наличия ПАВ; величина
константы б определяет природу
лимитирующей стадии.
Если
лимитирующая стадия – перенос электронов,
и коэффициент переноса
 ~0,5,
то
~0,5,
то
 – электрохимическая, если маленькая –
химическая, 0,03- диффузия
– электрохимическая, если маленькая –
химическая, 0,03- диффузия
Для сильно разбавленных слабых кислот, (0.01Н CH3COOH) и в более нейтральных средах

Поляризация носит концентрационный характер.
Наоборот, в очень сильно концентрированных растворах кислот и щелочей, обладающих высокой вязкостью и плотностью, наблюдается т.н. газодиффузионная поляризация, обусловленная трудностью отрыва пузырька водорода и перемещения его в раствор электролита.

