
- •Лекция 1.
- •Экономические аспекты борьбы с коррозией.
- •Классификация коррозионных процессов.
- •Показатели коррозионной стойкости металлов и сплавов.
- •– Отрицательный весовой показатель, используется, когда в процессе коррозии масса образца уменьшается. Образуются либо хорошо растворимые соединения металла, либо (не сказал что).
- •Атомы водорода в дефектах кристаллической решетки могут образовывать молекулу водорода h2, которая имеет гораздо большие размеры и выйти из кристаллической решетки уже не может.
- •Условие сплошности оксидных плёнок.
- •Логарифмический закон.
- •Механизмы диффузии ионов в кристаллической решётке оксидов.
- •Лекция 4.
- •Способы защиты металлов от газовой коррозии.
- •Оксид легирующего компонента должен обладать меньшей электропроводностью по сравнению с оксидами защищаемых металлов.
- •Активные катионы, перешедшие в раствор электролита.
- •Необратимые потенциалы металлы.
- •Термодинамика коррозионных процессов.
- •Диаграмма коррозионного процесса.
- •Особенности катодной реакции водородной деполяризации.
- •Коррозионные процессы с кислородной деполяризацией.
- •Лекция 8.
- •Влияние процесса водородной деполяризации на кислородную деполяризацию.
- •Особенности катодной реакции ионизации кислорода при коррозии металлов.
- •Способы защиты металлов от процессов коррозии с кислородной деполяризацией.
- •Плёночная теория.
- •Обобщённая анодная поляризационная кривая окисления металлов.
- •Лекция 11.
- •Отрицательный защитный эффект.
- •Практические выводы из теории катодной электрохимической защиты.
- •1. Защита от внешнего источника постоянного тока. Применяют для металлоконструкций из стальных, низко- и средне легированных сталей (3-10%), сплавов меди и титана и других.
- •2. Катодная защита с помощью протектора.
- •Коррозия под действием блуждающих токов. Дренажная защита.
- •Дренажная защита.
- •Анодная электрохимическая защита.
- •Способы перевода коррозионной системы в устойчивое пассивное состояние.
- •Воздействуя на характер анодного процесса металла.
- •Лекция 14.
- •Анодная электрохимическая защита от внешнего источника тока.
- •Защита металлов от коррозии с помощью ингибиторов.
- •Анодные ингибиторы.
- •Катодные ингибиторы.
Лекция 11.





Чтобы
определить локальные токи, нужно найти
точки пересечения анодной и катодной
кривых для железа с отрезком
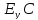 при новом компромиссном потенциале
системы
при новом компромиссном потенциале
системы
 .
Точка К – пересечение
KFe
и т. С.
.
Точка К – пересечение
KFe
и т. С.
При
потенциале Ey
локальный ток
 ,
т.е. при катодной поляризации системы
от Ex
до Ey
(в область более электроотрицательных
значений) произошло уменьшение локального
тока работы внутренней гальванопары
на железе. Локальный анодный ток
,
т.е. при катодной поляризации системы
от Ex
до Ey
(в область более электроотрицательных
значений) произошло уменьшение локального
тока работы внутренней гальванопары
на железе. Локальный анодный ток
 или остаточный анодный ток окисления
железа
или остаточный анодный ток окисления
железа
 уменьшился, уменьшилась скорость
окисления железа.
уменьшился, уменьшилась скорость
окисления железа.
Явление уменьшения локального тока (анодного) в коррозионной системе при катодной поляризации называется положительным защитным эффектом.
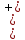

В данном случае, катодная поляризация системы Fe-анод – Fe-катод произошла за счёт внешнего тока, поступающего в систему с цинкового электрода-протектора. Величина анодного тока на цинке определяется также по точке пересечения анодной кривой для цинка с отрезком EyC при потенциале Ey.

Катодный ток (ассимиляция электронов) на Zn меньше анодного (из-за более высокого перенапряжения выделения водорода, чем на Fe).

Поэтому условно говорят, что цинк в данной системе будет преимущественно работать анодом, т.е. посылать во внешнюю цепью больше электронов, чем ассимилирует в ходе катодной реакции.
У
Fe
наоборот, при
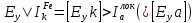 .
Поэтому поверхность железа преимущественно
работает катодом, т.е. скорость окисления
железа уменьшилась, но количество
выделяющегося водорода увеличится.
.
Поэтому поверхность железа преимущественно
работает катодом, т.е. скорость окисления
железа уменьшилась, но количество
выделяющегося водорода увеличится.
При катодной поляризации системы от Ex до Ey величина анодной поляризации



Анодная поляризация процесса окисления железа стала меньше, поэтому произошло уменьшение тока коррозии.
Принцип катодной электрохимической защиты – уменьшение скорости анодной реакции за счёт смещения компромиссного потенциала поверхности металла в область более электроотрицательных значений.
Когда
компромиссный потенциал системы Ey
будет равен обратимому потенциалу
анодной реакции окисления металла,
поляризация анодного процесса будет
равна нулю и
 – условие полной электрохимической
катодной защиты.
– условие полной электрохимической
катодной защиты.

Катодную поляризацию коррозионной системы можно осуществить за счёт внешнего источника постоянного тока.
Для
того, чтобы в системе пошёл внешний
катодный ток необходимо поместить в
агрессивную среду дополнительный анод,
который подключается к (+) источника
постоянного тока. 


Внешний анод:

Как правило, в водных растворах электролитов на внешнем катоде идёт процесс выделения кислорода, т.е. внешний выносной анод должен быть максимально коррозионно стойким (инертным), чтобы внешний анодный ток шёл на процесс выделения кислорода с его поверхности.
Коррозионная диаграмма для процесса катодной защиты внешним током будет иметь вид:


При подключении данной системы к отрицательному полюсу внешнего источника тока, в систему пойдёт внешний катодный ток, который и будет вызывать катодную поляризацию системы, т.е. обеспечит сдвиг её компромиссного потенциала в область более электроотрицательных значений от Ex до Ey.
Т.к. в данной системе всего 1 катод, локальные участки на поверхности железа, то процесс катодной поляризации будет проходить по катодной поляризационной кривой для железа.

Из точки S, когда внешний ток был равен 0, до точки С, когда катодный ток увеличился за счёт прибавления внешнего тока.
При новом компромиссном потенциале Ey локальный ток работы внутренних гальвано пар на железе будет соответствовать точке «а», точке пересечения анодной поляризационной кривой с отрезком [EyC]. Это будет остаточный анодный ток окисления металла при катодной поляризации.
Точке
C
будет соответствовать катодный ток
 .
.

Если мы достигнем обратимого потенциала анодной реакции окисления металла
 ,
то анодный
остаточный ток
,
то анодный
остаточный ток
 ,
при этом вся поверхность железа будет
выполнять функции макрокатода и катодный
процесс будет протекать с максимальной
скоростью. Максимальный внешний катодный
ток будет соответствовать точке «d».
,
при этом вся поверхность железа будет
выполнять функции макрокатода и катодный
процесс будет протекать с максимальной
скоростью. Максимальный внешний катодный
ток будет соответствовать точке «d».
Таким внешним током мы обеспечили полную электрохимическую катодную защиту.
В
данном случае, величина
 .
Ток окисления металла уменьшится на
.
Ток окисления металла уменьшится на
 при потенциале Ey.
Чтобы проанализировать влияние внутренних
и внешних факторов на величину
положительного защитного эффекта,
условно примем, что в области потенциалов
от Ex
до Ey
поляризационные кривые близки к линейным.
Тогда из величин углов
при потенциале Ey.
Чтобы проанализировать влияние внутренних
и внешних факторов на величину
положительного защитного эффекта,
условно примем, что в области потенциалов
от Ex
до Ey
поляризационные кривые близки к линейным.
Тогда из величин углов

 – величины
поляризуемостей (фарадеевских
сопротивлений) для анодной и катодной
электрохимических реакций в корррозионной
системе.
– величины
поляризуемостей (фарадеевских
сопротивлений) для анодной и катодной
электрохимических реакций в корррозионной
системе.



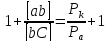

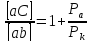



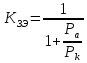

Величина положительного защитного эффекта будет определяться как величиной внешнего катодного тока (поступающего либо с протектора, либо от внешнего источника постоянного тока), умноженного на коэффициент защитного эффекта, который показывает, какая доля внешнего катодного тока будет идти на уменьшение локального тока коррозии металла.
Из
выражения коэффициента разностного
эффекта
 следует, что параметры катодной
электрохимической защиты будут
определяться соотношением величин
поляризуемостей анодной и катодной
электрохимических реакций, протекающих
на поверхности защищаемого металла.
Некоторый вклад вносят процессы,
протекающие на металле-протекторе, так
как процесс катодной поляризации идёт
вдоль суммарной поляризационной кривой.
следует, что параметры катодной
электрохимической защиты будут
определяться соотношением величин
поляризуемостей анодной и катодной
электрохимических реакций, протекающих
на поверхности защищаемого металла.
Некоторый вклад вносят процессы,
протекающие на металле-протекторе, так
как процесс катодной поляризации идёт
вдоль суммарной поляризационной кривой.
Чем больше поляризуемость катодной электрохимической реакции и меньше – анодной, тем величина коэффициента защитного эффекта будет больше, и большая часть внешнего тока будет идти на уменьшение скорости коррозии.
Основные параметры катодной электрохимической защиты.
 - степень
электрохимической защиты.
- степень
электрохимической защиты.

 - эффективность
электрохимической защиты (отношение
получаемого положительного защитного
эффекта (уменьшение скорости коррозии
металла) к затратам на защиту)
- эффективность
электрохимической защиты (отношение
получаемого положительного защитного
эффекта (уменьшение скорости коррозии
металла) к затратам на защиту)
Эффективность также будет определяться природой лимитирующих стадий электрохимических реакций и будет мало зависеть от способа защиты (внешний ток или протектор), т.е. будет определяться природой металла и составом агрессивной среды.
Сдвиг
потенциала




Основные случаи коррозионного поведения систем.
-
Если процесс коррозии протекает с чисто водородной деполяризацией.

Для систем, имеющих большую поляризуемость катодного процесса, при одинаковом внешнем токе будет достигаться больший положительный защитный эффект.
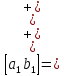

В таких системах будет выше эффективность катодной электрохимической защиты.
Чтобы повысить поляризуемость катодного процесса (например, перенапряжение для выделения водорода), нужно в состав агрессивной среды вводить ингибиторы данной реакции.
-
Если процесс коррозии протекает на металле в области полной пассивации, то поляризация такой системы внешним током не приведёт к уменьшению скорости коррозии, защитный эффект и эффективность такой защиты будут равны 0.

-
Если процесс коррозии протекает на предельном диффузионном катодном токе (например, с чисто кислородной деполяризацией), поляризуемость катодного процесса стремится к бесконечности, а коэффициент защитного эффекта – к единице. Весь катодный ток полностью расходуется на уменьшение локального тока коррозии. Эффективность защиты = 100%.






-
В большом числе вариантов коррозионных систем удаётся сдвинуть компромиссный потенциал до величины обратимого потенциала анодной электрохимической реакции
 ,
т.е. обеспечить полную электрохимическую
катодную защиту как от внешнего источника
постоянного тока, так и при подключении
дополнительного металла, имеющего
более электроотрицательный потенциал
анодной электрохимической реакции.
Поэтому величина
,
т.е. обеспечить полную электрохимическую
катодную защиту как от внешнего источника
постоянного тока, так и при подключении
дополнительного металла, имеющего
более электроотрицательный потенциал
анодной электрохимической реакции.
Поэтому величина
 и называется защитным потенциалом, до
которого необходимо сдвинуть потенциал
системы.
и называется защитным потенциалом, до
которого необходимо сдвинуть потенциал
системы.

