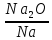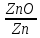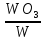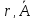- •Лекция 1.
- •Экономические аспекты борьбы с коррозией.
- •Классификация коррозионных процессов.
- •Показатели коррозионной стойкости металлов и сплавов.
- •– Отрицательный весовой показатель, используется, когда в процессе коррозии масса образца уменьшается. Образуются либо хорошо растворимые соединения металла, либо (не сказал что).
- •Атомы водорода в дефектах кристаллической решетки могут образовывать молекулу водорода h2, которая имеет гораздо большие размеры и выйти из кристаллической решетки уже не может.
- •Условие сплошности оксидных плёнок.
- •Логарифмический закон.
- •Механизмы диффузии ионов в кристаллической решётке оксидов.
- •Лекция 4.
- •Способы защиты металлов от газовой коррозии.
- •Оксид легирующего компонента должен обладать меньшей электропроводностью по сравнению с оксидами защищаемых металлов.
- •Активные катионы, перешедшие в раствор электролита.
- •Необратимые потенциалы металлы.
- •Термодинамика коррозионных процессов.
- •Диаграмма коррозионного процесса.
- •Особенности катодной реакции водородной деполяризации.
- •Коррозионные процессы с кислородной деполяризацией.
- •Лекция 8.
- •Влияние процесса водородной деполяризации на кислородную деполяризацию.
- •Особенности катодной реакции ионизации кислорода при коррозии металлов.
- •Способы защиты металлов от процессов коррозии с кислородной деполяризацией.
- •Плёночная теория.
- •Обобщённая анодная поляризационная кривая окисления металлов.
- •Лекция 11.
- •Отрицательный защитный эффект.
- •Практические выводы из теории катодной электрохимической защиты.
- •1. Защита от внешнего источника постоянного тока. Применяют для металлоконструкций из стальных, низко- и средне легированных сталей (3-10%), сплавов меди и титана и других.
- •2. Катодная защита с помощью протектора.
- •Коррозия под действием блуждающих токов. Дренажная защита.
- •Дренажная защита.
- •Анодная электрохимическая защита.
- •Способы перевода коррозионной системы в устойчивое пассивное состояние.
- •Воздействуя на характер анодного процесса металла.
- •Лекция 14.
- •Анодная электрохимическая защита от внешнего источника тока.
- •Защита металлов от коррозии с помощью ингибиторов.
- •Анодные ингибиторы.
- •Катодные ингибиторы.
-
Атомы водорода в дефектах кристаллической решетки могут образовывать молекулу водорода h2, которая имеет гораздо большие размеры и выйти из кристаллической решетки уже не может.

Реакция раскисления стали идёт за счет добавления Mn, Al, Si в расплавы.


Кинетика процессов газовой коррозии.
Законы роста оксидных плёнок.
Для большинства металлов с термодинамической точки зрения процесс коррозии разрешен, и термодинамическая возможность окисления уменьшается с ростом температуры. Скорость окисления металлов наоборот значительно возрастает с ростом температуры и подчиняется закономерностям для гетерогенных химических реакций.

Kc – константа скорости, Cox – концентрация окислителя в газовой фазе, W – энергия активации для данной реакции, e – 2,71. С ростом температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза, но для процессов коррозии металлов данные по скорости окисления отличаются на много порядков в зависимости от природы металла и характера агрессивной среды.
Например, Al, Ti, Cr и т.д., имеющие очень большую отрицательную величину dG, окисляются на воздухе очень мало даже при высоких температурах, в то время как Cu, Fe и другие металлы имеют очень высокую скорость коррозии. Поэтому принятой считать, что скорость коррозии определяется не столько термодинамической возможностью данной химической реакции, сколько тормозящими факторами.
Главным тормозящим фактором является процесс образования на поверхности металла плёнок из продуктов химической реакции. Чем выше защитные свойства этих плёнок, тем с меньшей скоростью протекает процесс коррозии данного металла.
Чтобы пленка обладала защитными свойствами, она прежде всего должна быть сплошной (безпористой), чтобы перекрывать всю поверхность металла, отделяя его от агрессивной внешней среды.
Условие сплошности оксидных плёнок.
Чтобы
оксидная пленка полностью перекрывала
поверхность металла, необходимо чтобы
удельный мольный объём оксида
 был больше, чем удельный объём самого
металла
был больше, чем удельный объём самого
металла
 .
.

Соотношения объёмов оксидов и исходных металлов.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,48 |
0,59 |
0,63 |
1,28 |
1,58 |
1,65 |
1,74 |
2,09 |
3,22 |
3,35 |
Оксиды щелочных и щелочноземельных металлов имеют меньший удельный мольный объём, чем чистый металлы, и не могут образовывать сплошных оксидных плёнок, способных заметно тормозить скорость газовой коррозии (препятствовать доступу кислорода из газовой фазы к поверхности металлов), поэтому они всегда будут коррозировать с очень большой скоростью. Большинство металлов способны образовывать сплошные оксидные плёнки, которые и будут обладать защитными свойствами, т.е. по мере их роста скорость коррозии будет уменьшаться.
Поэтому скорость коррозии кальция будет в тысячи и миллионы раз превосходит скорость коррозии алюминия.
Но:
когда удельный мольный объём оксида
значительно превосходит объём металла,
по мере роста такой оксидной плёнки в
толщину в ней накапливается значительное
внутреннее напряжение, которое в итоге
вызовет её растрескивание и скалывание
с поверхности металла при определенной
толщине. При этом будет обнажаться
поверхность металла и пленки не будут
сплошными и защитными, поэтому принято,
что соотношение должно быть

Таким образом, чтобы оксидная плёнка обладала защитными свойствами, прежде всего она должна быть сплошной.
Чтобы плёнка имела максимально возможную прочность с поверхностью металла, необходимо чтобы оксид имел максимально близкий тип кристаллической решетки и её параметры, как у основного металла.
Оксид металла и металл должны иметь близкие по величине температурные коэффициенты линейного расширения.
В рабочем интервале температур металл или компонент сплава не должны образовывать летучих соединений (возгоняться), либо легкоплавких эвтектик.
Законы роста оксидных плёнок.
Линейный закон.
Если в процессе коррозии на металле образуется не сплошная плёнка, либо продукты коррозии возгоняются или удаляются с поверхности металла и тем самым не тормозят процесс доставки кислорода к поверхности металла, в этом случае скорость окисления будет определяться кинетическими возможностями химической реакции.


При
неизменных внешних условиях ( ),
),


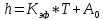
Линейный
закон – если скорость процесса коррозии
определяется скоростью химической
реакции,
то зависимость толщины плёнки
от времени будет
линейно нарастать.
 – постоянная
интегрирования; толщина плёнки оксида,
которая была на металле на момент начала
коррозионных испытаний.
– постоянная
интегрирования; толщина плёнки оксида,
которая была на металле на момент начала
коррозионных испытаний.
Скорость
коррозии в данном случае будет значительно
возрастать с ростом температуры, но при
образовании не сплошных, пористых плёнок
при повышении температуры на каждые
 скорость коррозии будет повышаться
менее, чем в два раза, так как:
скорость коррозии будет повышаться
менее, чем в два раза, так как:
-
Часть поверхности металла экранирована не сплошной плёнкой
-
Поры несколько тормозят скорость доставки
Лекция 3.
Параболический закон.
Отмечается, когда на поверхности металла образуется сплошная оксидная плёнка, которая отделяет сам металл от внешней агрессивной газовой среды.

В данном случае механизм процесса коррозии можно описать следующей схемой:
-
Диффузия О2 в газовой фазе к поверхности оксидной плёнки Ме2О.
-
Адсорбция и распад молекулы О2 на атомы.

-
Ионизация металла на границе металл/оксид.

При этом катион металла переходит в оксидную плёнку (в дефекты) и на поверхности металла остаётся электрон.
-
Твердофазная диффузия катионов металла и миграция электронов через слой оксидной плёнки.
-
Ионизация Оадс.
 на поверхности оксидной плёнки
на поверхности оксидной плёнки
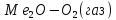
-
Твердотельная диффузия О2- через оксидную плёнку в зону химической реакции.
-
Химическая реакция образования оксида, рост оксидной плёнки.
Наиболее медленными стадиями, как правило, будут 4 или 6 – стадии твердофазной диффузии ионов через слой кристаллической решётки оксида.
При диффузионном контроле коррозионного процесса его скорость будет описываться уравнением диффузии (согласно второму закону Фика):

Кдиф
– коэффициент диффузии ионов см2/с,
градиент С – разница концентраций в
диффузионном слое,
 – толщина диффузионного слоя, в нашем
случае – это и есть толщина растущей
оксидной плёнки.
– толщина диффузионного слоя, в нашем
случае – это и есть толщина растущей
оксидной плёнки.
Т.к. стадия диффузии является лимитирующей, концентрация ионов в зоне химической реакции, протекающей быстро, будет стремиться к нулю.

При диффузионном контроле с ростом толщины оксидной плёнки скорость процесса коррозии будет уменьшаться. Это условие образования сплошной плёнки, обладающей защитными свойствами.


 – параболический
закон, А0
– толщина оксидной плёнки на начало
испытаний.
– параболический
закон, А0
– толщина оксидной плёнки на начало
испытаний.




Если
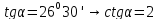

Величина котангенса угла наклона в двоичных логарифмических координатах должна показать нам степень параболы.
В
большинстве случаев наблюдаются
некоторые
отклонения от чистой
параболы (когда
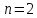 ).
).
Если в процессе коррозии образуется оксидная плёнка, в которой удельный мольный объём оксида превышает атомный объём металла (выполняется условие сплошности), то по мере утолщения плёнки в ней накапливаются значительные внутренние напряжения, которые будут приводить в начальные моменты времени – к переуплотнению оксида (искажение кристаллической решётки). Это будет способствовать затруднению диффузии ионов через данный оксидный слой, поэтому n будет становиться >2. В пределе, при значительном накоплении внутренних напряжений начинается процесс разрушения кристаллической решётки оксида (глубинное расслоение).
Истинный
путь (в обход) движения ионов увеличивается
при расслоении, что также сказывается
на увеличении n.

Если оксидная плёнка растёт с поверхности, – на границе плёнка/газ, - то внутренние напряжения в ней значительно не накапливаются, а идёт постоянное поверхностное разрушение (разрыхление) оксидной плёнки и процесс диффузии облегчается. Возможно 1<< n < 2.
Зона роста оксидной плёнки во многом будет определяться диффузионными возможностями (подвижностью) катионов металла и ионов кислорода в кристаллической решетке оксида, которые определяются механизмом полупроводимости оксидных слоёв (n, p – тип), а также от соотношения радиусов движущихся навстречу друг другу ионов.
Если размеры катиона металла меньше, чем ион кислорода, т.е. катионам двигаться легче, то зона роста будет приближаться к поверхности-границе оксидная плёнка/газ; и наоборот, если радиус катиона больше, чем О2-, то зона роста будет в глубинных слоях оксида.
В большинстве случаев размеры катионов металла меньше, чем у кислорода.
|
|
О2- |
Al3+ |
Cr3+/Cr6+ |
Zn |
Fe2+/Fe3+ |
Ni2+ |
Cu+ |
K+ |
|
|
1,4 |
0,5 |
0,65 / 0,52 |
0,74 |
0,75/0,67 |
0,78 |
0,96 |
1,33 |