
- •Лекция 1.
- •Экономические аспекты борьбы с коррозией.
- •Классификация коррозионных процессов.
- •Показатели коррозионной стойкости металлов и сплавов.
- •– Отрицательный весовой показатель, используется, когда в процессе коррозии масса образца уменьшается. Образуются либо хорошо растворимые соединения металла, либо (не сказал что).
- •Атомы водорода в дефектах кристаллической решетки могут образовывать молекулу водорода h2, которая имеет гораздо большие размеры и выйти из кристаллической решетки уже не может.
- •Условие сплошности оксидных плёнок.
- •Логарифмический закон.
- •Механизмы диффузии ионов в кристаллической решётке оксидов.
- •Лекция 4.
- •Способы защиты металлов от газовой коррозии.
- •Оксид легирующего компонента должен обладать меньшей электропроводностью по сравнению с оксидами защищаемых металлов.
- •Активные катионы, перешедшие в раствор электролита.
- •Необратимые потенциалы металлы.
- •Термодинамика коррозионных процессов.
- •Диаграмма коррозионного процесса.
- •Особенности катодной реакции водородной деполяризации.
- •Коррозионные процессы с кислородной деполяризацией.
- •Лекция 8.
- •Влияние процесса водородной деполяризации на кислородную деполяризацию.
- •Особенности катодной реакции ионизации кислорода при коррозии металлов.
- •Способы защиты металлов от процессов коррозии с кислородной деполяризацией.
- •Плёночная теория.
- •Обобщённая анодная поляризационная кривая окисления металлов.
- •Лекция 11.
- •Отрицательный защитный эффект.
- •Практические выводы из теории катодной электрохимической защиты.
- •1. Защита от внешнего источника постоянного тока. Применяют для металлоконструкций из стальных, низко- и средне легированных сталей (3-10%), сплавов меди и титана и других.
- •2. Катодная защита с помощью протектора.
- •Коррозия под действием блуждающих токов. Дренажная защита.
- •Дренажная защита.
- •Анодная электрохимическая защита.
- •Способы перевода коррозионной системы в устойчивое пассивное состояние.
- •Воздействуя на характер анодного процесса металла.
- •Лекция 14.
- •Анодная электрохимическая защита от внешнего источника тока.
- •Защита металлов от коррозии с помощью ингибиторов.
- •Анодные ингибиторы.
- •Катодные ингибиторы.
-
Оксид легирующего компонента должен обладать меньшей электропроводностью по сравнению с оксидами защищаемых металлов.
Некоторые свойства легирующих элементов, повышающих жаростойкость обычных углеродистых сталей.
|
Свойства |
FeO |
Fe2O3 |
Al2O3 |
Cr2O3 |
SiO2 |
|
Отношение
|
1,77 |
2,14 |
1,28 |
2,07 |
1,9 |
|
Электропроводность при 1000 С, Ом-1, См-1 |
102 |
- |
10-7 |
10-2 |
10-6 |
|
Ионный радиус катиона в оксиде, А |
0,75 |
0,67 |
0,54 |
0,6 |
0,41 |
|
Теплота образования оксида, dG кДж/моль |
-269,2 |
-801,8 |
-1674,7 |
-1122,0 |
818,2 |
-
Оксид легирующего компонента должен обладать высокой термической стойкостью, не должен быть летучим, возгоняться или разлагаться (обладать высокой упругостью диссоциации) во всём температурном диапазоне эксплуатации материала.
Температура разложения Al2O3 ~ 2500 C, SiO2 ~ 2000 С, B2O3 ~ 294 C.
-
Чтобы легирующие компоненты максимально равномерно распределялись по объему сплава защищаемого металла и образовывали защитную пленку, которая перекрывала бы всю поверхность защищаемого металла, легирующий компонент с основным металлом должен образовывать сплав типа «твёрдый раствор», компоненты которого неограниченно растворимы друг в друге и в жидком, и в твёрдом состоянии. Поэтому легирующие компоненты могут либо замещать часть узлов в кристаллической решетке основного металла (если ионные радиусы различаются не более, чем на 15%), либо внедряться в междоузельное пространство (если радиус иона легирующего компонента не более 0,59 от радиуса основного металла).
-
Защищаемый металл и оксиды основного металла и легирующего компонента должны иметь близкие по величине коэффициенты линейного температурного расширения.
При содержании хрома в стали порядка 8-10% окалиностойкость составляет примерно 800-900 градусов, 23-25% примерно 1300-1400 градусов.
Для сплавов Fe и Zn существует область критических концентраций легирующего компонента, при достижении которой на воздухе вся поверхность сплава будет перекрываться слоем окалины из оксидов чистого легирующего компонента.
|
Сплав, % |
Fe-Al |
Fe-Cr |
Cu-Zn (латунь) |
Cu-Al (бронза) |
Cu-Be (бронза) |
|
|
8-10 |
14-20 |
14-20 |
>3 |
1-2 |
-
Легирующий компонент с основным металлом должен образовывать смешанные – двойные оксиды, которые называются типа «шпинели», которые имеют свой тип кристаллической решетки и обладают повышенными защитными свойствами.
При определённом соотношении компонентов может образовываться NiO и Al2O3 (NiAl2O4), 90хSiO2 10уNa2O (Na2SiO3), химические соединения с принципиально отличной от отдельных оксидов химической решеткой.

-
Нанесение на поверхность металлической детали защитного жаропрочного окалиностойкого металлического или неметаллического (органического или неорганического) покрытия.
-
Нанесение гальванических покрытий металлами, хромирование, осаждение термостойких сплавов (Ni-P), а также оксидных покрытий (анодирование).
-
Термодиффузионные покрытия, когда атомы или ионы легирующих компонентов при контакте с поверхностью защищаемого металла внедряются в поверхностные слои его кристаллической решетки, в результате чего на поверхности образуется сплав нужного состава с высокой коррозионной стойкостью.
Для сталей – термодиффузионное хромирование; Алитирование – насыщение поверхности алюминием (49% Al, 49% Al2O3, 2% NH4Cl), на поверхности стали формируется сплошная хорошо сцепленная защитная плёнка из внедрённого в поверхностные слои алюминия, закрытого слоем чистого Al2O3; Силицирование – насыщение поверхностных слоёв кремнием (газ SiCl4).
-
Нанесение слоя термостойких органических покрытий, где в качестве плёнкообразователя используются лаки на Si-O-Si-O-Si- силоксановой основе и с Al2O3/Cr2O3 в качестве пигментов, с термостойкостью ~650 C.
-
Термодиффузионное напыление в мощном электрическом поле.
-
Способ воздействия на агрессивную внешнюю среду путём создания защитных газовых атмосфер.
-
Вакуумирование – уменьшение парциального давления кислорода.
-
Создание атмосферы инертных газов (аргон). Используется как правило в спецтехнике, при сваривании высоколегированных сплавов. Необходима защита, т.к. газ очень тяжелый и легко задохнуться.
-
Использование восстановительных атмосфер (H2, CH4, CO, NH3). Сдерживается взрывоопасностью таких газов. Газы могут вступать с металлом в химические реакции с образованием гидридов, нитридов, карбидов…
В настоящее время наибольшее распространение получили газовые смеси на основе N2 + CO2 + CO. Процентный состав компонентов в смеси выбирается исходя из условий эксплуатации (температуры). Чтобы предотвратить процесс обычного окисления железа, необходимо учитывать 2 возможные реакции:
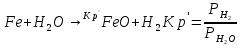

По зависимости констант равновесия первой и второй реакции от температуры:

Ниже
кривых констант равновесия лежит область
окислительных атмосфер, т.е. в заштрихованной
области будет протекать процесс коррозии;
выше линий проходит область восстановительных
атмосфер, где реакции будут протекать
только в обратном направлении. Например,
если CO
– 0,5; CO2
– 0,2; N2
– 0,3, то

Температурная область АВ, в которой процесс окисления железа протекать не будет. Если в качестве конструкционного материала используется углеродистая сталь, то большинство её характеристик очень сильно зависят от % содержания углерода. Поэтому следует подбирать состав газовой смеси исходя из возможности протекания реакций обезуглероживания, что приведёт к уменьшению прочности и твердости стали, или науглероживания поверхностных слоёв (цементации), что значительно уменьшит пластичность и увеличит хрупкость.


Лекция 5.
Электрохимическая коррозия металлов.
Это процесс самопроизвольного окисления металла при его контакте с электропроводящей агрессивной средой, обусловленный тем, что на поверхности металла возникают и функционируют множество микрогальванопар, т.е. анодных и катодных участков, и процесс коррозии сопровождается наличием электрического тока (движением электронов по поверхности металла (по металлической фазе) и движением ионов по раствору электролита).
Существуют две теории электрохимической коррозии, описывающие механизм процесса:
-
«Химический» механизм, предполагает эквипотенциальность, т.е. одинаковый заряд всей поверхности металла, при этом процесс окисления металла с оставлением электронов – анодная стадия, процесс «забирания» (связывания) электронов ионами или молекулами окислителя агрессивной среды протекает одновременно во всех точках поверхности, и скорости (плотности тока ja=jk) анодной и катодной реакции равны.
Экспериментально данный механизм был доказан при коррозии в агрессивных средах с очень высокой проводимостью – электролитах с очень высокой электропроводностью. Например, для Fe и Cl в концентрированных растворах H2SO4, Al и Si в концентрированных растворах NaOH.

При коррозии металлов в растворах идёт процесс их ионизации с выделением водорода.
-
Электрохимический механизм предполагает возникновение на поверхности металла участков с различным запасом свободной энергии, что на участках с избытком энергии возникает более электроотрицательный заряд поверхности. На них и протекают анодные электрохимические реакции, окисление металла с отдачей (оставлением) электронов.
На участках с меньшим запасом энергии потенциал поверхности будет менее отрицательный (более положительный), на них будут протекать катодные реакции восстановления окислителя из агрессивной среды.
Гетерогенность (неоднородность) поверхности металла может быть вызвана тремя причинами:
-
Неоднородность физико-химического состава поверхности металла (наличие примесей, компонентов сплава), наличие различных структурных модификаций, анизотропия кристаллов.

-
Неоднородность состава агрессивной среды, - электролита, - у поверхности металла; различная концентрация ионов металла растворённого кислорода и pH электролита у различных зон электрода.
-
Неравномерность действия внешних факторов (температура, давление) по поверхности металла
Таким образом, на поверхности металла возникает множество микрогальванопар, - пространственно разделенных анодных и катодных участков.
А:

K:

Идёт процесс окисления металла, в нашем случае – ионизация ионов в раствор. Оставленные электроны участвуют в катодной реакции восстановления ионов окислителя из агрессивной среды.
Таким образом, анодный и катодный процессы протекают сопряженно, с одинаковой скоростью. Ей отвечает величина тока (перетока электронов по поверхности металла),

, но, в отличие от химического механизма, площади катодных участков в большинстве случаев не равны площади анодных участков

Кинетические параметры, плотности тока, не равны плотности тока.
Электрохимический механизм как раз и предусматривает очень сильную зависимость от скорости электрохимических процессов потенциала поверхности электрода.
Так как анодная и катодная реакция протекают сопряженно (с участием одного и того же кол-ва электронов), то торможение или замедление скорости коррозии данного металла.
Термодинамическая возможность протекания процесса электрохимической коррозии.
А:

K:


В общем виде процесс окисления металла будет протекать самопроизвольно, если изменение dG <0. Суммарная реакция будет меньше 0

где z – число электронов, участвующих в реакции окисления металла, F – число фарадея
E
– электродвижущая сила коррозионного
процесса, знак и величина которой
определяется разностью обратимых
потенциалов для окислительно-восстановительной
катодной электрохимической реакции
 и анодной реакцией окисления металла
и анодной реакцией окисления металла
 .
.
Таким образом, процесс коррозии цинка в растворе кислоты может протекать самопроизвольно при dG < 0.
Обратимые и необратимые потенциалы.
Обратимый потенциал металла.
При погружении металла в раствор электролита из-за процессов обмена ионами и электронами с электролитом возникает ДЭС – происходит пространственное разделение зарядов между поверхностью металла и слоем электролита, т.е. поверхность металла приобретает определенный заряд, а, следовательно, и потенциал.
-
Если энергия сольватации катионов металла значительно превосходит энергию кристаллической решетки (металлические связи), то создаются условия выигрыша в энергии для перехода катионов из металла в раствор.
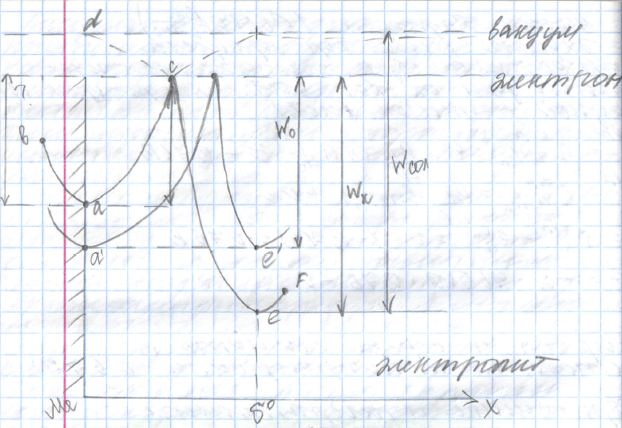

Энергия ионизации численно равна работе по переносу единицы положительного заряда, в данном случае – катиона металла, из кристаллической решётки в бесконечно удалённую точку в вакууме, на диаграмме т. А отличает сред
Точке е отвечает средняя энергия катионов того же металла, расположенных в электролите на расстоянии d0 от поверхности металла. Линии d-c-e о отвечает энергия сольватации переноса катиона из бесконечно удалённой точке в вакууме в данную точку электролита.
За
счет электростатической адсорбции
диполей из электролита на поверхности
металла облегчается процесс перехода
катионов металла в раствор за счет
выигрыша в энергии

Чтобы прошёл процесс ионизации катиона металла ему необходимо преодолеть небольшой барьер. Выходя из кристаллической решётки в электролит (протекание анодной реакции окисления металла в прямом направлении), электроны остаются на поверхности металла, за счет чего он приобретает избыточный отрицательный заряд относительно электролита, который и будет удерживать катион от ухода в электролит на некотором энергетически наиболее выгодном состоянии. Будет формироваться положительная обкладка ДЭС.
В процессе ионизации будут участвовать катионы металла из кристаллической решётки, имеющие повышенный запас свободной энергии, достаточной для преодоления активационного барьера. Поэтому по мере их ухода средний уровень энергии катионов на поверхности металла будет понижаться из точки а в точку а1.
Величина отрицательного заряда будет возрастать пропорционально кол-ву оставленных электронов.


