
- •Лекция 1.
- •Экономические аспекты борьбы с коррозией.
- •Классификация коррозионных процессов.
- •Показатели коррозионной стойкости металлов и сплавов.
- •– Отрицательный весовой показатель, используется, когда в процессе коррозии масса образца уменьшается. Образуются либо хорошо растворимые соединения металла, либо (не сказал что).
- •Атомы водорода в дефектах кристаллической решетки могут образовывать молекулу водорода h2, которая имеет гораздо большие размеры и выйти из кристаллической решетки уже не может.
- •Условие сплошности оксидных плёнок.
- •Логарифмический закон.
- •Механизмы диффузии ионов в кристаллической решётке оксидов.
- •Лекция 4.
- •Способы защиты металлов от газовой коррозии.
- •Оксид легирующего компонента должен обладать меньшей электропроводностью по сравнению с оксидами защищаемых металлов.
- •Активные катионы, перешедшие в раствор электролита.
- •Необратимые потенциалы металлы.
- •Термодинамика коррозионных процессов.
- •Диаграмма коррозионного процесса.
- •Особенности катодной реакции водородной деполяризации.
- •Коррозионные процессы с кислородной деполяризацией.
- •Лекция 8.
- •Влияние процесса водородной деполяризации на кислородную деполяризацию.
- •Особенности катодной реакции ионизации кислорода при коррозии металлов.
- •Способы защиты металлов от процессов коррозии с кислородной деполяризацией.
- •Плёночная теория.
- •Обобщённая анодная поляризационная кривая окисления металлов.
- •Лекция 11.
- •Отрицательный защитный эффект.
- •Практические выводы из теории катодной электрохимической защиты.
- •1. Защита от внешнего источника постоянного тока. Применяют для металлоконструкций из стальных, низко- и средне легированных сталей (3-10%), сплавов меди и титана и других.
- •2. Катодная защита с помощью протектора.
- •Коррозия под действием блуждающих токов. Дренажная защита.
- •Дренажная защита.
- •Анодная электрохимическая защита.
- •Способы перевода коррозионной системы в устойчивое пассивное состояние.
- •Воздействуя на характер анодного процесса металла.
- •Лекция 14.
- •Анодная электрохимическая защита от внешнего источника тока.
- •Защита металлов от коррозии с помощью ингибиторов.
- •Анодные ингибиторы.
- •Катодные ингибиторы.
-
Плёночная теория.
Предполагает, что в определённой области потенциалов на поверхности металла формируется фазовая плёнка оксида, состоящая из десятков-сотен монослоёв (толстая плёнка). Она может быть пористой, именно в порах локализуются анодные участки и протекает реакция ионизации металла. Доля их поверхности очень мала, так что анодная плотность тока может достигать очень больших величин, что и вызывает большой сдвиг потенциала поверхности металла в положительном направлении, а также высокую концентрационную поляризацию по катиону металла в порах. Поры быстро перекрываются плёнкой нарастающего оксида и наоборот, в местах, ранее перекрытых оксидной плёнкой, может протекать катодный процесс – восстановление оксида металла, прилегающего к металлической поверхности, до чистого металла, что будет вызывать уменьшение толщины оксидной плёнки со стороны металла. На внешней поверхности оксидная плёнка будет контактировать с электролитом и, за счёт химического растворения, толщина оксидной плёнки будет уменьшаться и с этой стороны.
Таким образом, существовавшие ранее анодные участки, - поры, - будут закрываться слоем оксида металла, и наоборот, на ранее перекрытых участках, - анодных, будут образовываться поры, где и будет локализоваться анодный процесс.
Будет наблюдаться равномерная коррозия всей поверхности металла через плёнку оксида и поддерживаться положительная величина потенциала поверхности металла.
-
Адсорбционная теория
Предполагает, что на поверхности металла наблюдается специфическая адсорбция кислорода, частично ионизованного, количество которого не превышает 1 монослоя.
Значительное торможение анодной реакции ионизации металла объясняется:
-
С химической точки зрения, адсорбированные ионы кислорода насыщают, связывают свободные валентные подуровни. У наиболее активных, поверхностных катионов металла, делая их менее химически активными.
-
С электрохимической точки зрения, адсорбция анионов кислорода приводит к образованию диполей с катионами металла, положительная часть которых внедрена в кристаллическую решетку металла, а отрицательная располагается в ДЭС.
Таким образом, изменяется строение ДЭС, возникает дополнительный более положительный скачок потенциала, локализованный в поверхностных слоях металла.
Потенциал металла относительно металла становится более электроположительным. Возникает единый потенциальный единый кинетический барьер (повышение энергии активации для процесса ионизации – растёт работа выхода катиона из металла через этот дополнительный барьерный слой,
Экспериментально было показано, что при заполнении поверхности платины в серной кислоте абсорбированным кислородом вызывает сдвиг потенциала на 120 мВ, при этом скорость анодной реакции уменьшается почти в десять раз.
Обобщённая анодная поляризационная кривая окисления металлов.
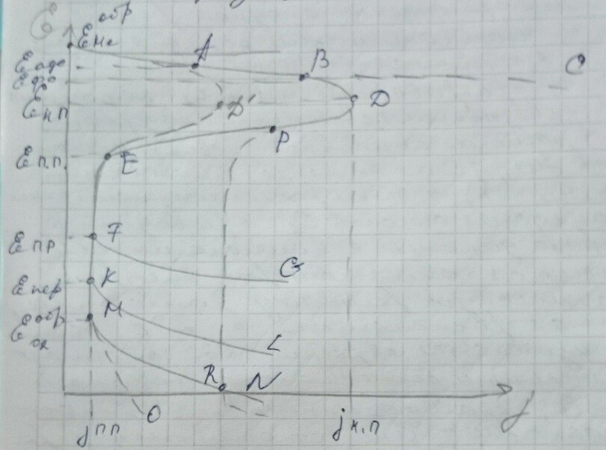
На
начальном участке по обратимому
потенциалу до т. А, поляризационная
кривая описывается уравнением Тафеля
 для замедленной электрохимической
реакции ионизации металла (в пределе,
данная зависимость шла бы вдоль линии
А-С – процесс коррозии металла протекал
бы по активным состояниям его поверхности
(без наличия каких-либо плёнок)). Отклонение
от Тафелевской зависимости вносит
только концентрационная поляризация.
для замедленной электрохимической
реакции ионизации металла (в пределе,
данная зависимость шла бы вдоль линии
А-С – процесс коррозии металла протекал
бы по активным состояниям его поверхности
(без наличия каких-либо плёнок)). Отклонение
от Тафелевской зависимости вносит
только концентрационная поляризация.
Точке А на поляризационной кривой соответствует потенциал адсорбции – начало посадки адсорбируемого кислорода
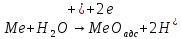
Дальнейшее заполнение поверхности металла адсорбированным кислородом вызывает дополнительное торможение для электрохимической реакции.
Поэтому на участке А-В анодная кривая идёт более круто относительно линии А-С для Тафелевской зависимости (рост поляризуемости анодного процесса).
Точке В соответствует обратимый потенциал образования фазового оксида
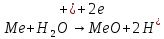
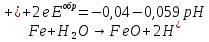
При более положительных потенциалах, в точке В процесс окисления металла протекает по двум анодным реакциям, 1 и 3, но так как анодная поляризация для реакции 3 (сдвиг потенциала в более положительном направлении от точки В) не велика, скорость второй реакции (образования фазового оксида) незначительна (гораздо меньше скорости реакции 1, т.к. ей соответствует большая поляризация).
Скорость образования оксидной плёнки пока будет несколько меньше, чем скорость её химического растворения в электролите. По мере приближения к точке D, скорость окисления металла будет увеличиваться, как и вклад реакции 3. Поэтому увеличивается и торможение анодного электрохимического процесса.
В точке D достигается максимальная – предельная – плотность анодного тока, при которой скорость образования фазового оксида будет равна скорости его химического растворения в электролите. При более положительных потенциалах, скорость образования оксида будет выше скорости химической реакции его растворения и вся поверхность будет перекрыта сплошной защитной оксидной плёнкой и скорость анодного процесса очень резко затормозится (линия D-E).
Таким образом, точке D соответствует максимальная скорость анодного растворения металла (плотность тока начала пассивации) потенциал начала пассивации (фладе-потенциал).
При
потенциалах, положительнее точки Е,
металл будет находиться в пассивном
состоянии. Процесс его окисления будет
протекать при минимальной плотности
тока
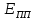 – полная пассивация.
– полная пассивация.
Область потенциалов полной пассивации, положительнее точки Е, будет зависеть от свойств образующейся оксидной плёнки, её химического состава и полупроводимости.
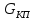 – величина
плотности тока полной пассивации будет
определяться скоростьб химического
растворения оксида металла в данном
электролите и не будет зависеть от
потенциала у поверхности металла.
– величина
плотности тока полной пассивации будет
определяться скоростьб химического
растворения оксида металла в данном
электролите и не будет зависеть от
потенциала у поверхности металла.
Если
не изменяется химический состав оксидной
плёнки, и она обладает электронной
проводимостью, то область пассивного
устойчивого состояния будет сохраняться
до
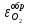 (до т. «Н»).
(до т. «Н»).
При более положительных потенциалах, процессу окисления металла будет протекать процесс выделения кислорода, что вызовет деполяризацию участка M-N,


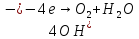
На практике встречаются некоторые отклонения от анодной поляризационной кривой, вызванные как составом электролита, так и природой самого металла.
-
Так как анодные и катодные участки расположены близко друг к другу,

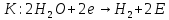

…., как правило, это рыхлые гидроксиды, которые перекрывают, частично экранируют часть поверхности металла за счёт сокращения истинной анодной поверхности, а также затруднения диффузионного отвода ионов металла через поры рыхлой плёнки гидроксида.
Поэтому будут возрастать торможения для анодного процесса. Линия A-D’-E – процесс пассивации будет наступать при несколько меньших токах начала пассивации, соответствующих точке D’.
-
При наличии в растворе ионов хлора или брома, обладающих очень сильной адсорбционной способностью при определённых потенциалах, наступает состояние пробоя оксидной плёнки, так как эти ионы «выдирают» кислород и способствуют растворению металла. Будет отмечаться явление локальной (точечной) коррозии (питтинг-образование).

Доля анодных участков, не перекрытых плёнкой, не велика, но анодная плотность тока растворения металла в глубину значительной. … Поэтому такие ионы, как Cl-, Br-, называются депассиваторами.
-
При сдвиге потенциала в положительном направлении для металлов с переменной валентностью становятся возможными электрохимические реакции окисления ионов металла в оксидной плёнке до высшей степени окисленности. Для железа, при потенциалах до + 0,5 В, оксидная плёнка преимущественно состоит из катионов Fe2+; +0,5 ~ +0,8 В,
 ;
>0,8 В, в основном Fe3+.
;
>0,8 В, в основном Fe3+.
-
В ряде случаев изменение физико-химического состава продуктов окисления очень сильно влияет на анодную электрохимическую реакцию, т.к. могут образовываться растворимые продукты, что приведёт к не только химическому, но и электрохимическому распаду защитной плёнки.
Такое явление называется перепассивацией, нарушением пассивного состояния за счет образования хорошо растворимых продуктов анодной электрохимической реакции. Потенциал перепассивации отвечает точке К. Положительнее него и происходит этот процесс, поляризационная кривая идёт вдоль K-L.
Если в состав электролита входят ионы, которые хорошо растворяют оксидные плёнки данного метала, то величина тока полной пассивации будет значительно увеличиваться. (D-P-R-N) – т.н. область электрохимического полирования металла.
Для полирования нержавеющей стали к раствору H2SO4 добавляют HNO3 и HF
-
Ряд металлов, как Al и Ti, образуют оксидные плёнки с униполярной проводимостью (нет электронной проводимости), поэтому смещение потенциала их поверхности не будет сопровождаться выделением кислорода. При очень больших положительных потенциалах удаётся получать толстые защитные оксидные слои, например, Al2O3.
Линии MO отвечает область анодирования, т.е. наращивания толстых анодных защитных оксидных плёнок на металлах и их сплавах.
Лекция 10.
Влияние внешней поляризации на локальный ток коррозии металлов.
-
Влияние внешней катодной поляризации на локальный ток коррозии. (лабораторная работа №3)
Внешнюю катодную поляризацию для металлической системы можно осуществить либо за счёт подключения к металлу дополнительного макрокатода – металла с более положительным обратимым потенциалом анодной электрохимической реакции, либо за счёт подключения внешнего источника тока – внешнего анодного тока.
Имеется локальная коррозионная система: Zn в растворе HCl.
Рисунок и диаграмма
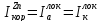
Цинковый образец находится в растворе HCl, на поверхности цинка образуются и эффективно работают внутренние, т.е. локальные, гальвано пары, короткозамкнутые системы.

На коррозионной диаграмме ей соответствует анодная кривая ионизации цинка и катодная кривая выделения водорода. Растворённого в электролите молекулярного кислорода нет, поэтому процесс коррозии цинка протекает с чисто водородной деполяризацией
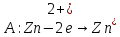

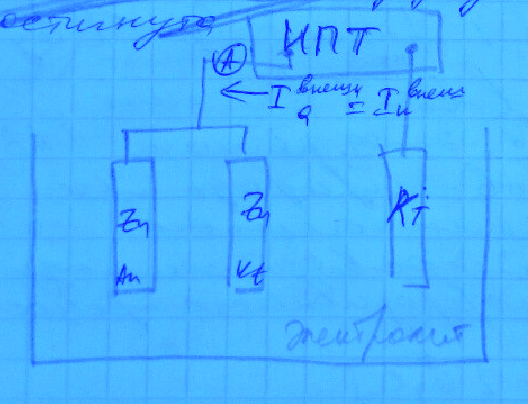
Точка пересечения кривых S показывает, экстраполяцией на ось потенциалов, единый компромиссный потенциал Ex коррозии цинка за счёт работы внутренних гальванопар. Экстраполяция на ось токов позволяет определить ток коррозии при соблюдения условия равенства локальных внутренних анодного и катодного токов.
При этом с катодных участков цинка идёт выделение водорода, объём которого нами фиксируется в бюретке 1.
При подключении к локальной цинковой гальвано паре ещё одного металла (например, платины), обратимый потенциал для анодной реакции, который значительно положительнее обратимого потенциала водородного электрода (для катодной электрохимической реакции), на платине при контакте с цинком в данной системе могут протекать только катодные электрохимические реакции. Вся поверхность платины будет являться единым макрокатодом.
Так как в нашем электролите есть только один катодный деполяризатор, протон Н+, то на платине будет реализовываться та же электрохимическая катодная реакция выделения водорода, что и на катодных участках поверхности цинка. Поэтому катодная поляризационная кривая для платины будет выходить из одной и той же точки обратимого потенциала водородного электрода, в частности – будет иметь меньший угол наклона (меньшую поляризуемость катодного процесса), меньшее перенапряжение выделения водорода по сравнению с цинком.
При подключении внешнего платинового макрокатода, наша система из локальной двухэлектродной стала короткозамкнутой трёхэлектродной системой, в которой есть один цинковый анод и два катода – цинковый и платиновый.
Эквивалентная электрическая схема.
Согласно
закону Кирхгофа, в едином узле
короткозамкнутой многоэлектродной
системы должно установиться единое
значение потенциала, при котором
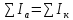 .
.
Графически,
по данным поляризационных кривых, нужно
построить суммарные поляризационные
кривые. Т.к. в области потенциалов между
обратимыми потенциалами цинка и водорода
протекает только один анодный процесс,
ему соответствует одна поляризационная
кривая
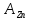 .
Чтобы построить суммарную катодную
поляризационную кривую
(выделение H2 на
цинке и платине протекает параллельно),
при фиксированном потенциале, мы должны
сложить катодные токи на цинке и платине.
.
Чтобы построить суммарную катодную
поляризационную кривую
(выделение H2 на
цинке и платине протекает параллельно),
при фиксированном потенциале, мы должны
сложить катодные токи на цинке и платине.
Суммарная
катодная поляризационная кривая выходит
из одной точки обратимого потенциала
водородного электрода, т.к. реализуется
один и тот же катодный процесс. Точка
пересечения суммарной катодной
поляризационной кривой и анодной кривой
– т. С. Экстраполяция на ось потенциалов
показывает новое значение единого
компромиссного потенциала трёхэлектродной
системы
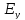 .
При контакте нашего металла Zn
с дополнительным макрокатодом Pt,
компромиссный потенциал от
.
При контакте нашего металла Zn
с дополнительным макрокатодом Pt,
компромиссный потенциал от
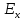 сместился в область более электроположительных
значений, произошла анодная поляризация
в коррозионной системе. Для того, чтобы
определить величины локальных токов,
необходимо найти точки пересечения
анодных и катодных поляризационных
кривых с отрезком
сместился в область более электроположительных
значений, произошла анодная поляризация
в коррозионной системе. Для того, чтобы
определить величины локальных токов,
необходимо найти точки пересечения
анодных и катодных поляризационных
кривых с отрезком
 .
.
При
потенциале
 локальный катодный ток на цинке при
потенциале
локальный катодный ток на цинке при
потенциале
 локальный катодный ток во внутренней
короткозамкнутой системе Zna
– Znк будет равен
длине отрезка Eyа.
локальный катодный ток во внутренней
короткозамкнутой системе Zna
– Znк будет равен
длине отрезка Eyа.
При
анодной поляризации нашей системы, её
внутренний локальный ток (равный
минимальному из анодного или катодного
токов на цинке) уменьшился от величины
 до
до


При анодной поляризации системы, скорость выделения водорода с поверхности цинка будет уменьшаться, но в нашей четырёх электродной системе появился внешний ток, который мы фиксируем по амперметру.
На поверхности платины, пропорционально
величине внешнего тока, идёт выделение
водорода, которое мы фиксируем по бюретке
2. Величина внешнего тока при потенциале
 будет соответствовать величине отрезка
[Eyb].
Точка b принадлежит
катодной поляризационной кривой для
платины. Анодный ток растворения цинка
при потенциале Ey
значительно возрос.
будет соответствовать величине отрезка
[Eyb].
Точка b принадлежит
катодной поляризационной кривой для
платины. Анодный ток растворения цинка
при потенциале Ey
значительно возрос.

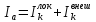
На
один анодный процесс работают два
катодных процесса. Если анодный процесс
протекает по Тафелевской зависимости,
т.е. лимитирующей стадией является
перенос электрона, то анодная плотность
тока
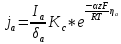 .
.
Сдвиг компромиссного потенциала системы от Ex до Ey увеличил анодную поляризацию, как степень отклонения от обратимого потенциала цинка, что и послужило причиной возрастания анодного тока – скорости коррозии цинка при анодной поляризации системы.
И наоборот, сдвиг потенциала от Ex до Ey вызвал уменьшение поляризации для катодного процесса на цинке. Скорость катодного процесса стала меньше.
Анодная поляризация локальной коррозионной системы может быть достигнута при подключении металла к положительному полюсу внешнего источника постоянного тока.
К отрицательному полюсу источника постоянного тока мы должны подключить дополнительный внешний выносной электрод (катод), расположенный в этом же электролите.
Без
поляризации при потенциале
 ток коррозии равен
ток коррозии равен
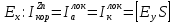 .
.
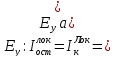
Чтобы проанализировать влияние внешних (температуры, состава электролита, наличия ПАВ) и внутренних факторов (природы металла, локального и подключаемого), установим взаимосвязи между параметрами коррозионного процесса.


Примем, что в области потенциалов Ey – Ex анодная и катодная поляризационная кривые близки к линейным. Тогда тангенс угла наклона анодной поляризационной кривой – ничто иное, как поляризуемость анодного процесса, т.е. степень его заторможенности, а тангенс бета – поляризуемость катодного процесса.
Из треугольника aCS можно выразить:
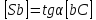

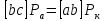

P – полязируемость.
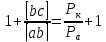
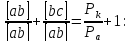
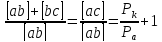
Явление
уменьшения локального тока под действием
внешней анодной поляризации называется
положительным разностным эффектом
 ,
или дифференц-эффектом. В нашем случае,
при анодной поляризации величина
,
или дифференц-эффектом. В нашем случае,
при анодной поляризации величина
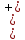
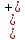
Таким образом, величина разностного эффекта (насколько уменьшится локальный коррозионный ток при анодной поляризации) определяется величиной внешнего анодного тока, умноженной на коэффициент разностного эффекта, который показывает какая доля внешнего анодного тока расходуется на уменьшение локального внутреннего катодного тока системы.
График

Коэффициент разностного эффекта определяется соотношением поляризуемостей катодной и анодной электрохимических реакций (мало зависит от способа поляризации), т.е. определяется природой лимитирующих стадий анодной и катодной электрохимических реакций.
1.
Чем выше поляризуемость анодной
электрохимической реакции, тем больше
будет степень уменьшения локального
тока при одном и том же внешнем токе
анодной поляризации. И наоборот, чем
меньше будет величина катодной
поляризуемости, тем больше будет
уменьшение локального тока при анодной
поляризации одним и тем же внешним
током.

2. Если катодный процесс протекает на предельной диффузионной плотности тока,
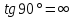 ,
КРЭ
= 0,
,
КРЭ
= 0,
 ,
,
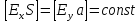 .
В данном случае поляризуемость катодного
процесса стремится к бесконечности,
коэффициент разностного эффекта и сам
эффект равны 0. Анодная поляризация
такой системы не приводит к уменьшению
локального тока коррозионной системы.
Скорость анодной реакции разрушения
металла будет значительно возрастать,
прямо пропорционально повышению внешнего
тока.
.
В данном случае поляризуемость катодного
процесса стремится к бесконечности,
коэффициент разностного эффекта и сам
эффект равны 0. Анодная поляризация
такой системы не приводит к уменьшению
локального тока коррозионной системы.
Скорость анодной реакции разрушения
металла будет значительно возрастать,
прямо пропорционально повышению внешнего
тока. 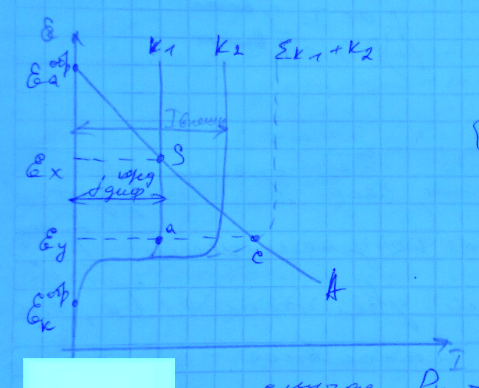
3. Если процесс коррозии протекает в области полной пассивации,

Таким образом, весь внешний ток будет расходоваться на уменьшение локального тока. Анодная поляризация не вызывает увеличения анодного тока, так как не нарушается пассивное состояние системы.
4.
Если компромиссный потенциал системы
сдвинуть до обратимого потенциала
катодной реакции,
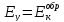 ,
то её локальный ток будет равен 0, катодные
процессы протекать перестанут и
поверхность металла будет выполнять
функции единого макроанода. Водород
выделяться не будет, а скорость растворения
металла будет очень высока.
,
то её локальный ток будет равен 0, катодные
процессы протекать перестанут и
поверхность металла будет выполнять
функции единого макроанода. Водород
выделяться не будет, а скорость растворения
металла будет очень высока.
1) Анодно заполяризовать систему до обратимого потенциала катода при помощи подключения дополнительного макрокатода невозможно, так как протекание катодной реакции на макрокатоде всё равно будет требовать перенапряжения, а следовательно – деполяризации. Это возможно только от внешнего источника тока.
2) Отрицательный разностный эффект наблюдается, когда при анодной поляризации системы происходит увеличение локального тока, например – скорости выделения водорода.
Экспериментально было показано несоответствие изменения механизма при изменении поляризации:
-
Смена механизма



-
Увеличение скорости анодного процесса при анодной поляризации вследствие неравномерной коррозии может вызывать выкрашивание в электролит мелких частичек металла, которые теряют электрический контакт с основным металлом, но процессы их коррозии протекают самостоятельно с выделением водорода в объёме раствора, который также фиксируется в бюретке. Ток, идущий на данный процесс, не фиксируется амперметром, подключенным к основному металлу.
-
Возможность нарушения сплошности защитных оксидных плёнок при анодной поляризации может перевести систему в состояние пробоя или перепассивации, что и будет вызывать увеличение локальных токов коррозии.
-
Катодная поляризация системы (лабораторная работа №5).
Также может быть обеспечена либо за счёт подключения дополнительного металла с более электроотрицательным потенциалом анодной электрохимической реакции (протектора), либо за счёт внешнего катодного тока при подключении к отрицательному полюсу внешнего источника постоянного тока.
1. Пусть протекает процесс коррозии металла, например – железа с водородной деполяризацией, а катодная поляризация будет обеспечиваться подключением более электроотрицательного металла (цинка).
Без
контакта поверхность железа под током
коррозии будет находиться при компромиссном
потенциале
 ,
при котором локальные токи (анодный и
катодный) на железе равны и величина
тока коррозии – отрезок
,
при котором локальные токи (анодный и
катодный) на железе равны и величина
тока коррозии – отрезок
 .
При подключении более электроотрицательного
металла (цинка) система из двухэлектродной
стала короткозамкнутой четырёхэлектродной,
так как поверхность цинка тоже будет
работать гальвано пара цинк-анод,
цинк-катод. В короткозамкнутой
четырёхэлектродной системе установится
новое значение компромиссного потенциала
.
При подключении более электроотрицательного
металла (цинка) система из двухэлектродной
стала короткозамкнутой четырёхэлектродной,
так как поверхность цинка тоже будет
работать гальвано пара цинк-анод,
цинк-катод. В короткозамкнутой
четырёхэлектродной системе установится
новое значение компромиссного потенциала
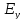 ,
при котором сумма всех анодных токов
будет равна сумме катодных.
,
при котором сумма всех анодных токов
будет равна сумме катодных.
Чтобы найти компромиссный потенциал многоэлектродной системы, нужно построить суммарную анодную и катодную кривые, для чего (при фиксированных потенциалах) мы складываем анодные или катодные токи. Суммарная поляризационная кривая будет выходить из точки обратимого потенциала водородного электрода, так как катодная реакция на железе и на цинке будет одной и той же.
Суммарная
анодная кривая будет выходить из точки
обратимого потенциала самой отрицательной
анодной реакции,
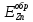 .
Так как до обратимого потенциала
обратимой реакции на железе в системе
протекает только одна анодная реакция
на цинке, суммарная анодная кривая на
этом участке будет совпадать с анодной
кривой для цинка.
.
Так как до обратимого потенциала
обратимой реакции на железе в системе
протекает только одна анодная реакция
на цинке, суммарная анодная кривая на
этом участке будет совпадать с анодной
кривой для цинка.
При потенциалах, более положительных, чем обратимый потенциал анодной реакции на железе, в системе одновременно будут протекать два анодных процесса.
