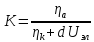- •Лекция 1.
- •Экономические аспекты борьбы с коррозией.
- •Классификация коррозионных процессов.
- •Показатели коррозионной стойкости металлов и сплавов.
- •– Отрицательный весовой показатель, используется, когда в процессе коррозии масса образца уменьшается. Образуются либо хорошо растворимые соединения металла, либо (не сказал что).
- •Атомы водорода в дефектах кристаллической решетки могут образовывать молекулу водорода h2, которая имеет гораздо большие размеры и выйти из кристаллической решетки уже не может.
- •Условие сплошности оксидных плёнок.
- •Логарифмический закон.
- •Механизмы диффузии ионов в кристаллической решётке оксидов.
- •Лекция 4.
- •Способы защиты металлов от газовой коррозии.
- •Оксид легирующего компонента должен обладать меньшей электропроводностью по сравнению с оксидами защищаемых металлов.
- •Активные катионы, перешедшие в раствор электролита.
- •Необратимые потенциалы металлы.
- •Термодинамика коррозионных процессов.
- •Диаграмма коррозионного процесса.
- •Особенности катодной реакции водородной деполяризации.
- •Коррозионные процессы с кислородной деполяризацией.
- •Лекция 8.
- •Влияние процесса водородной деполяризации на кислородную деполяризацию.
- •Особенности катодной реакции ионизации кислорода при коррозии металлов.
- •Способы защиты металлов от процессов коррозии с кислородной деполяризацией.
- •Плёночная теория.
- •Обобщённая анодная поляризационная кривая окисления металлов.
- •Лекция 11.
- •Отрицательный защитный эффект.
- •Практические выводы из теории катодной электрохимической защиты.
- •1. Защита от внешнего источника постоянного тока. Применяют для металлоконструкций из стальных, низко- и средне легированных сталей (3-10%), сплавов меди и титана и других.
- •2. Катодная защита с помощью протектора.
- •Коррозия под действием блуждающих токов. Дренажная защита.
- •Дренажная защита.
- •Анодная электрохимическая защита.
- •Способы перевода коррозионной системы в устойчивое пассивное состояние.
- •Воздействуя на характер анодного процесса металла.
- •Лекция 14.
- •Анодная электрохимическая защита от внешнего источника тока.
- •Защита металлов от коррозии с помощью ингибиторов.
- •Анодные ингибиторы.
- •Катодные ингибиторы.
Способы защиты металлов от процессов коррозии с кислородной деполяризацией.
Если процесс коррозии протекает в замкнутой системе и допускает воздействие на состав агрессивной среды (в реакторе):
-
Прекратить доступ кислорода из воздуха в данном электролите: нанести на поверхность электролита слой органической жидкости (масла).
-
Химически связать растворенный в электролите кислород за счёт использования восстановителей.

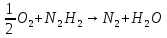
-
Отдуть кислород из электролита инертным газом
-
Провести кипячение электролита. Резко уменьшается парциальное давление кислорода, а потому и его растворимость.
Для открытых (производственных) систем, где не допускается значительное изменение состава агрессивной среды, можно использовать ингибиторы. Наибольшей эффективностью будут обладать высокомолекулярные ПАВ, макромолекулы которых, прочно адсорбируясь на катодных участках поверхности, будут даже выступать за пределы ДЭС, не только изменяя его строение, но и препятствуя доступу молекулярного кислорода к поверхности металла.
К ингибиторам коррозии можно отнести и действие катионов металлов (например, Zn), которые будут образовывать с продуктами катодной реакции труднорастворимые соединения, которые и будут экранировать поверхность металла.


-
Нанесение защитных покрытий:
-
Лакокрасочных, если позволяет среда
-
Неорганических, оксидных, фосфатных плёнок
-

-
Гальванических покрытий (металлами).
Для стали: электрохимически - Zn, Cd, Sn, будут очень быстро пассивироваться - Ni, Cr.
-
Электрохимические методы защиты:
-
Сдвиг компромиссного потенциала системы в область более электроотрицательных значений – катодная защита внешним катодным током или протектором.

-
Если сам металл склонен к пассивации, то используют анодную поляризацию в область более положительных потенциалов, когда вся поверхность металла покрыта сплошной защитной плёнкой.

Лекция 9.
Анодные процессы при электрохимической коррозии.
В зависимости от природы металла и состава агрессивной среды (кислотности – pH), анодные процессы окисления металла могут протекать:



Механизм анодной реакции, как правило, включает в себя три последовательных стадии:
-
Специфическая адсорбция

-
Электрохимические реакции окисления адсорбированного соединения металла с образованием растворимого комплексного иона

-
Распад комплексного иона в растворе с образованием растворимого катиона металла

Экспериментально было доказано, что процесс ионизации железа в серной кислоте протекает через 4 последовательных стадии






Реакция 3 или 4 – перенос второго электрона, протекают различным путём в зависимости от pH раствора. В сильно кислых средах – по 3, в щелочных и нейтральных – 4. Являются лимитирующими.
При постоянной концентрации анионов SO4 в растворе и уменьшении pH на единицу (увеличении концентрации протонов в 10 раз), скорость анодной реакции также увеличивается в 10 раз (порядок реакции P = 1).
При постоянном pH раствора, при увеличении концентрации ионов SO4 в 10 раз, скорость коррозии железа также возрастает в ~10 раз.
При
плотностях анодного тока
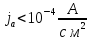 также наблюдается линейная зависимость
между анодной поляризацией и анодной
плотностью тока
также наблюдается линейная зависимость
между анодной поляризацией и анодной
плотностью тока
 .
При более высоких плотностях
.
При более высоких плотностях
 отмечается Тафелевская зависимость,
указывающая на лимитирующую стадию –
электрохимическую реакцию.
отмечается Тафелевская зависимость,
указывающая на лимитирующую стадию –
электрохимическую реакцию.
С увеличением анодной плотности тока, возникает и увеличивается концентрационная поляризация, связанная с замедленностью диффузионного отвода продуктов анодной реакции.




Для многих металлов наблюдается явление пассивации.
Пассивация, или пассивность, обусловлена очень высокой коррозионной стойкостью термодинамически неустойчивых металлов в данной среде, связанной со значительным смещением потенциала их поверхности в область более положительных значений, что вызвано значительными торможениями анодной стадии коррозионного процесса. При этом достигается очень малая величина анодной плотности тока, которая остаётся неизменной в довольно широкой области изменения потенциалов.
Например, для железа происходит смещение потенциала от -0,5 ~ -0,2 В -> +0,5 ~ 1,0 В
Для хрома -0,6 ~ -0,3 В -> +0,8 ~ 0,9 В
Пассивное состояние характеризуется двумя величинами:
Причина наступления пассивного состояния – образование и перекрытие всей поверхности металла сплошной защитной плёнкой продуктов анодной электрохимической реакции. Поэтому в области пассивного состояния скорость коррозии металла – анодная плотность тока – будет определяться свойствами образовавшейся защитной плёнки: скоростью её химического растворения в агрессивном электролите, которая не зависит от потенциала поверхности металла, и её полупроводимости – способности переносить катионы и электроны через упорядоченную кристаллическую решетку данного химического соединения (оксиды металлов).
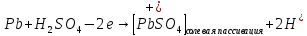
Существует две основных теории пассивации: