
- •Лекция 1.
- •Экономические аспекты борьбы с коррозией.
- •Классификация коррозионных процессов.
- •Показатели коррозионной стойкости металлов и сплавов.
- •– Отрицательный весовой показатель, используется, когда в процессе коррозии масса образца уменьшается. Образуются либо хорошо растворимые соединения металла, либо (не сказал что).
- •Атомы водорода в дефектах кристаллической решетки могут образовывать молекулу водорода h2, которая имеет гораздо большие размеры и выйти из кристаллической решетки уже не может.
- •Условие сплошности оксидных плёнок.
- •Логарифмический закон.
- •Механизмы диффузии ионов в кристаллической решётке оксидов.
- •Лекция 4.
- •Способы защиты металлов от газовой коррозии.
- •Оксид легирующего компонента должен обладать меньшей электропроводностью по сравнению с оксидами защищаемых металлов.
- •Активные катионы, перешедшие в раствор электролита.
- •Необратимые потенциалы металлы.
- •Термодинамика коррозионных процессов.
- •Диаграмма коррозионного процесса.
- •Особенности катодной реакции водородной деполяризации.
- •Коррозионные процессы с кислородной деполяризацией.
- •Лекция 8.
- •Влияние процесса водородной деполяризации на кислородную деполяризацию.
- •Особенности катодной реакции ионизации кислорода при коррозии металлов.
- •Способы защиты металлов от процессов коррозии с кислородной деполяризацией.
- •Плёночная теория.
- •Обобщённая анодная поляризационная кривая окисления металлов.
- •Лекция 11.
- •Отрицательный защитный эффект.
- •Практические выводы из теории катодной электрохимической защиты.
- •1. Защита от внешнего источника постоянного тока. Применяют для металлоконструкций из стальных, низко- и средне легированных сталей (3-10%), сплавов меди и титана и других.
- •2. Катодная защита с помощью протектора.
- •Коррозия под действием блуждающих токов. Дренажная защита.
- •Дренажная защита.
- •Анодная электрохимическая защита.
- •Способы перевода коррозионной системы в устойчивое пассивное состояние.
- •Воздействуя на характер анодного процесса металла.
- •Лекция 14.
- •Анодная электрохимическая защита от внешнего источника тока.
- •Защита металлов от коррозии с помощью ингибиторов.
- •Анодные ингибиторы.
- •Катодные ингибиторы.
Отрицательный защитный эффект.

Для систем, процесс коррозии в которых протекает в условиях полной пассивации (например, высоколегированные хромом и никелем нержавеющие стали), то значительная катодная поляризация может вывести систему из устойчивого пассивного состояния, так как при этом потенциале становится возможным катодный процесс восстановления защитных оксидных или гидроксидных плёнок и система из устойчивого пассивного состояния с очень маленьким током коррозии переходит в активное состояние с большой скоростью коррозии при потенциале Ey.
При дальнейшем сдвиге потенциала (катодной поляризации) отрицательнее Ey, скорость коррозии системы будет вновь уменьшаться, появится положительный защитный эффект.
Для большинства металлов, имеющих очень отрицательные значения потенциалов анодных реакций (например, Al, Mg), значительно отрицательнее обратимого потенциала водородного электрода, и находящихся в устойчивом пассивном состоянии (в средах, близких к нейтральным), катодная поляризация будет вызывать увеличение внешнего катодного тока – более интенсивного выделения водорода с этой же поверхности металла.
Значительное подщелачивание поверхности будет способствовать химическому растворению оксидных плёнок с образованием хорошо растворимых продуктов, что вызовет процесс нарушения пассивного состояния, сопровождающийся увеличением скорости коррозии.
Практические выводы из теории катодной электрохимической защиты.
-
В большинстве случаев при катодной электрохимической защите, катодная поляризация сопровождается увеличением катодного тока за счёт подачи в систему внешнего тока от протектора или источника постоянного тока.


Полная
электрохимическая защита в точке «d»,
соответствующей обратимому потенциалу
металла
 .
.
Если лимитирующей стадией катодной электрохимической реакции является перенос электронов, т.е. катодная кривая описывается уравнением Тафеля, то



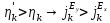
При защите с помощью протектора, скорость его коррозии будет выше скорости коррозии металла до защиты (при условии, что расход металлов выражен в грамм-эквивалентах)

Скорость расхода протектора, выраженная в граммах, будет различной, так как определяется величиной электрохимического эквивалента металла.







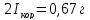
Если катодный процесс протекает на предельном диффузионном токе, при полной электрохимической защите, внешний ток будет равен току коррозии.



-
Если на катоде протекает реакция выделения водорода, а обратимый потенциал анодной реакции окисления металла значительно отрицательнее
 ,
то обеспечение полной электрохимической
защиты внешним током может быть
недостижимо (для Al,
Mg)
или становится крайне малоэффективным,
так как с ростом катодной поляризации
происходит облегчение электрохимической
реакции выделения водорода (катодная
поляризуемость уменьшается), так как
внешняя энергия, затрачиваемая на
поляризацию системы, частично расходуется
на уменьшение энергии активации данного
процесса.
,
то обеспечение полной электрохимической
защиты внешним током может быть
недостижимо (для Al,
Mg)
или становится крайне малоэффективным,
так как с ростом катодной поляризации
происходит облегчение электрохимической
реакции выделения водорода (катодная
поляризуемость уменьшается), так как
внешняя энергия, затрачиваемая на
поляризацию системы, частично расходуется
на уменьшение энергии активации данного
процесса.
-
Если процесс коррозии протекает с чисто кислородной деполяризацией, а обратимый потенциал анодной реакции металла отрицательнее обратимого потенциала водородного электрода, то выбирается определённая область потенциалов электрохимической защиты, когда она будет оптимальна.
Область, в которой на катоде протекает ионизация кислорода и выделение водорода с большим перенапряжением (высокой катодной поляризуемостью), что будет гарантировать относительно высокую эффективность использования внешнего тока (~90%).
При более положительных потенциалах точки С, эффективность будет выше, но степень защиты будет очень мала. При более электроотрицательных потенциалах степень защиты будет увеличиваться, а эффективность – стремительно уменьшаться, что экономически невыгодно.
Для повышения эффективности и степени электрохимической катодной защиты, в состав агрессивной среды нужно вводить ингибиторы катодной электрохимической реакции выделения водорода. Только после введения ингибитора следует включать внешний ток.
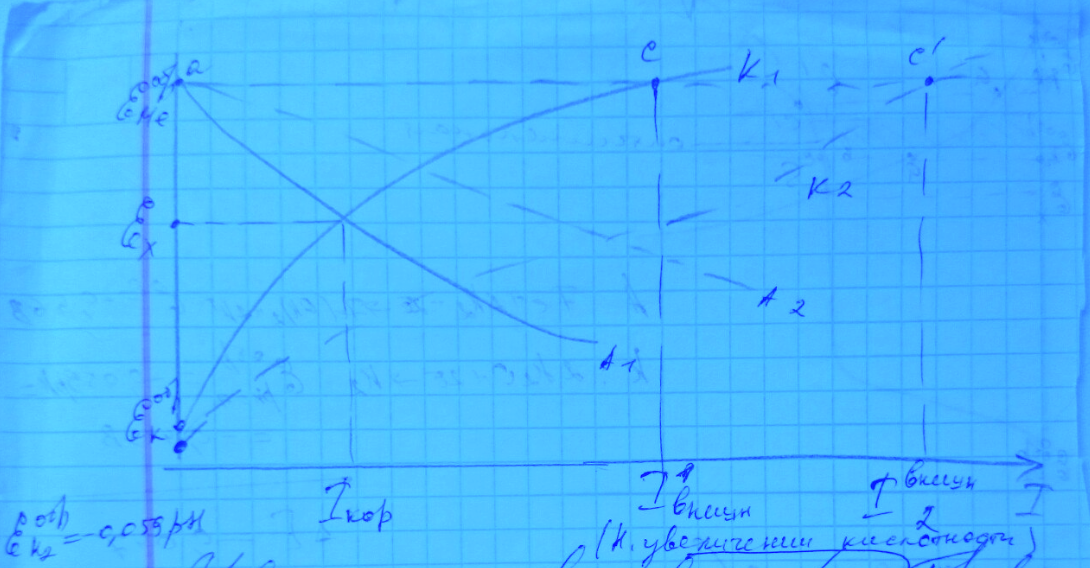
Увеличение агрессивности среды (pH, концентрации окислителей) приводит к облегчению как катодной, так и анодной электрохимических реакций. Для обеспечения электрохимической защиты будет требоваться всё больший внешний ток. Эффективность защиты, в большинстве случаев, будет уменьшаться.
Лекция 12.
Организация катодной защиты.
