
- •Лекция 1.
- •Экономические аспекты борьбы с коррозией.
- •Классификация коррозионных процессов.
- •Показатели коррозионной стойкости металлов и сплавов.
- •– Отрицательный весовой показатель, используется, когда в процессе коррозии масса образца уменьшается. Образуются либо хорошо растворимые соединения металла, либо (не сказал что).
- •Атомы водорода в дефектах кристаллической решетки могут образовывать молекулу водорода h2, которая имеет гораздо большие размеры и выйти из кристаллической решетки уже не может.
- •Условие сплошности оксидных плёнок.
- •Логарифмический закон.
- •Механизмы диффузии ионов в кристаллической решётке оксидов.
- •Лекция 4.
- •Способы защиты металлов от газовой коррозии.
- •Оксид легирующего компонента должен обладать меньшей электропроводностью по сравнению с оксидами защищаемых металлов.
- •Активные катионы, перешедшие в раствор электролита.
- •Необратимые потенциалы металлы.
- •Термодинамика коррозионных процессов.
- •Диаграмма коррозионного процесса.
- •Особенности катодной реакции водородной деполяризации.
- •Коррозионные процессы с кислородной деполяризацией.
- •Лекция 8.
- •Влияние процесса водородной деполяризации на кислородную деполяризацию.
- •Особенности катодной реакции ионизации кислорода при коррозии металлов.
- •Способы защиты металлов от процессов коррозии с кислородной деполяризацией.
- •Плёночная теория.
- •Обобщённая анодная поляризационная кривая окисления металлов.
- •Лекция 11.
- •Отрицательный защитный эффект.
- •Практические выводы из теории катодной электрохимической защиты.
- •1. Защита от внешнего источника постоянного тока. Применяют для металлоконструкций из стальных, низко- и средне легированных сталей (3-10%), сплавов меди и титана и других.
- •2. Катодная защита с помощью протектора.
- •Коррозия под действием блуждающих токов. Дренажная защита.
- •Дренажная защита.
- •Анодная электрохимическая защита.
- •Способы перевода коррозионной системы в устойчивое пассивное состояние.
- •Воздействуя на характер анодного процесса металла.
- •Лекция 14.
- •Анодная электрохимическая защита от внешнего источника тока.
- •Защита металлов от коррозии с помощью ингибиторов.
- •Анодные ингибиторы.
- •Катодные ингибиторы.
Лекция 8.
В
области очень малых плотностей тока


Лимитирующей стадией будет перенос первого электрона, поляризация активационная.
При
 описывается уравнением Тафеля
описывается уравнением Тафеля

В данной области потенциалов скорость катодной реакции ионизации кислорода будет зависеть как от кривой металла на катодных участках, температуры, состава электролита, наличия в нём ПАВ.

Тафелевской зависимости отвечает участок А-В на катодной поляризационной кривой, так как растворимость молекулярного кислорода в водных растворах электролитов достаточно низкая (при t = 20, ~2,5 * 10-4 моль/л). Поэтому по мере возрастания катодной плотности тока будет наблюдаться значительная концентрационная поляризация, обусловленная замедленностью протекания стадии диффузионной доставки молекулярного кислорода, растворённого в электролите, к поверхности катода.
Скорость
диффузионного потока описывается
уравнением Фика

Если
лимитирующей стадией скорости всего
электрохимического процесса будет
диффузионная, то сколько кислорода
будет поставляться к катоду, столько и
будет участвовать в электрохимической
ионизации, скорость которой описывается
законом Фарадея


При постоянной температуре и составе электролита, максимальная скорость диффузионной доставки кислорода к поверхности катода – при максимальном градиенте концентраций, т.е. при условии, что Cпов будет стремиться к 0.

Z
– число электронов в катодной реакции,
z
= 4; F
= 96 500; Kдиф
– коэффициент диффузии молекулярного
кислорода в электролите, Kдиф
=
10-6;
 –
толщина диффузионного слоя, в котором
реализуется градиент концентраций.
–
толщина диффузионного слоя, в котором
реализуется градиент концентраций.





При наличии диффузионных затруднений, большой вклад будет вносить концентрационная поляризация


Концентрация кислорода у поверхности катода будет значительно понижаться, что и будет вызывать сдвиг потенциала в область более электроотрицательных значений. На катодной поляризационной кривой этому соответствует участок В-С.
 – область
кислородного голодания. В точке С
поверхностная концентрация кислорода
стремится к нулю, это вызывает резкое
смещение потенциала в область отрицательных
значений по линии С-D-F.
– область
кислородного голодания. В точке С
поверхностная концентрация кислорода
стремится к нулю, это вызывает резкое
смещение потенциала в область отрицательных
значений по линии С-D-F.
Сдвиг
потенциала будет продолжаться, пока не
достигнет области потенциалов протекания
реакции восстановления другого окислителя
в электролите. Например, реакция выделения
водорода
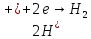 ,
обратимый потенциал которой на 1,23 В
положительнее обратимого потенциала
кислородного электрода.
,
обратимый потенциал которой на 1,23 В
положительнее обратимого потенциала
кислородного электрода.
В области потенциалов, отрицательнее точки D (обратимого потенциала водородного электрода), на поверхности катода будут протекать одновременно 2 реакции: ионизация кислорода на предельной диффузионной плотности тока и выделение водорода.
Влияние процесса водородной деполяризации на кислородную деполяризацию.
-
Если выделение водорода протекает не очень интенсивно, то поднимающиеся пузырьки газа будут перемешивать электролит в прикатодном пространстве. Толщина диффузионного слоя будет несколько снижаться, облегчая диффузионный подвод молекул кислорода и предельную диффузионную плотность тока данного процесса.
-
Если на поверхности идёт обильное выделение водорода, то относительно большая катодная поверхность будет перекрыта пузырьками водорода, а следовательно – открытая поверхность для доступа кислорода будет сокращаться. Выделяющийся из раствора газообразный водород будет уменьшать содержание кислорода в газовой фазе: снижается парциальное давление кислорода над раствором и по закону Генри-Рауля уменьшается растворимость кислорода, будет наблюдаться эффект отдувки выхода растворённого кислорода из электролита в газовую фазу. Концентрация растворённого в электролите кислорода будет уменьшаться, меньше будет и предельная диффузионная плотность тока – скорость реакции.
