
- •Содержание
- •Введение
- •Классификация химических превращений в окружающей среде Все химические превращения загрязняющих веществ в окружающей среде можно разделить на:
- •1.2 Миграция химических элементов в окружающей среде
- •Перенос почва – вода
- •Лекция № 2 ФизиКо-химические процессы в атмосфере
- •2.1 Пыли и аэрозоли
- •2.1.1 Химический состав аэрозолей
- •2.1.2 Сток аэрозолей в тропосфере
- •2.3 Газы в атмосфере
- •2.3 Химические превращения в атмосферном воздухе
- •Состав облачных и дождевых капель. Химические процессы в жидкой фазе
- •2.4 Фотохимические реакции в нижних слоях атмосферы
- •Фотохимические реакции оксидов азота (фотохимический смог)
- •Другие химические реакции оксидов азота
- •Химические реакции соединений серы. Кислотные дожди
- •Влияние кислотных дождей на природные объекты, здания, памятники и технику
- •Окисление монооксида углерода
- •Химия парникового эффекта
- •2.5 Атмосферная химия органических веществ Окисление метана и его гомологов
- •Хлорорганические соединения. Пестициды
- •2.6 Фотохимические реакции в верхних слоях атмосферы
- •Лекция № 3 Физико-химические процессы в гидросфере
- •3.1. Сведения о свойствах воды и её загрязнении
- •Вторичное загрязнение
- •3.2 Физико-химические превращения металлов в гидросфере
- •Превращения металлов при участии микроорганизмов
- •3.5 Эвтрофирование водоемов
- •Трофический статус водного объекта
- •Эвтрофирование и сукцессия
- •Стадии эвтрофирования
- •Хозяйственные последствия эвтрофирования
- •Борьба с эвтрофированием
- •Формы нефтяных загрязнений
- •Последствия загрязнения морей и океанов нефтью
- •3.7.2 Поверхностно-активные вещества
- •3.7.3 Пестициды
- •Лекция № 4 Физико-химические процессы в литосфере и почвенном покрове
- •4.1 Поведение тяжелых металлов и их соединений в почвах
- •4.2 Поведение пестицидов в почвах
- •4.3 Загрязнение почв нефтью
- •4.4 Процессы биологического разложения твердых бытовых отходов
- •Лекция № 5 физико-химические превращения в окружающей среде суперэкотоксикатов
- •5.1 Стойкие органические загрязнители
- •5.2 Полихлорированые бифенилы
- •Полиароматические углеводороды (пау)
- •5.4 Дихлордифенилтрихлорэтан (ддт)
- •Лекция № 6 Радиоактивные вещества в окружающей среде
- •6.1 Взаимодействие ионизирующего излучения с компонентами атмосферы
- •Радиационно-химические превращения вещества под действием радиоактивных излучений
- •6.2 Искусственные радионуклиды в морских экосистемах
- •Радиолиз воды
- •6.3 Поведение радионуклидов в почвах
- •6.4 Поступление радионуклидов в растения
- •Лекция № 7 биохимические процессы трансформации загрязняющих веществ в окружающей среде
- •Процессы, протекающие при нарушении экологического равновесия в круговороте биогенных элементов
- •Список литературы Основная
- •Дополнительная
- •Физико-химические превращения загрязняющих веществ в окружающей среде конспект лекций
Превращения металлов при участии микроорганизмов
Наряду с изменениями вещества под влиянием абиотических факторов, проходят важные превращения, связанные с присутствием живых организмов. Основную роль в биогенном превращении играют микроорганизмы, населяющие водную среду, донные осадки и полости самих макроорганизмов. В большей степени такие процессы определяют самоочищающую способность водоема.
Гидробионты участвуют в превращении металлов. При участии микроорганизмов в окружающей среде могут происходить окислительно-восстановительное превращение кобальта, хрома, мышьяка. При этом аэробные микроорганизмы обеспечивают процессы окисления, а анаэробные – процессы восстановления. Условия для восстановительных процессов создаются в глубине донных отложений. В толще воды восстановление может происходить в условиях длительного и глубокого дефицита кислорода.
В химических реакциях, связанных с превращением металлов с участием гидробионтов, особое место занимает их метилирование, т.е. образование метилсодержащих соединений металлов. Метилирование представляет собой неферментативный процесс, протекающий с участием метилкобаламина (витамина В12).
Рассмотрим поведение некоторых металлов в водоеме и возможные реакции, протекающие с их участием.
Металлическая ртуть – вещество средней токсичности, но очень ядовиты её пары. Давление насыщенных паров ртути при температуре 20 оС равно 0,1729 Па и с повышением температуры резко возрастает.
Соединения одновалентной ртути менее токсичны, чем соединения двухвалентной по причине низкой растворимости в воде.
Соединения двухвалентной ртути обладают высокой токсичностью. При попадании в человеческий организм в виде двухвалентных ионов ртуть действует на центральную нервную систему, вызывая симптомы психического расстройства.
Из всех видов ртути наиболее опасны соединения с органическими группами – это диметилртуть (СН3)2Нg и ион метилртути CH3Hg+. Одинаково опасны как сама диметилртуть, так и её пары. Метилирование ртути с образованием метил- и диметилртути происходит активнее с участием микрофлоры, особенно эффективно – в анаэробных условиях.
Итак, токсичность ртути в значительной степени зависит от её химического состояния.
Но очень важно ещё и то, что в природных условиях, в частности, в водных источниках любое вещество может вступать в реакции, которые иногда превращают его из относительно безвредного в смертельно опасное.
В результате использования ртути в различных промышленных процессах, например, для электролитического получения гидроксида натрия, ртуть в виде металла или Hg2+ попадает в водоёмы и оседает на дно. Микроорганизмы, обитающие в природных водоёмах, выделяют серу в какой-либо её форме. Ртуть реагирует с серой, образуя соли. Часто этой солью является HgS. Сульфид ртути – труднорастворимая соль и поэтому особой опасности не представляет. Но под влиянием активной бактериальной жизни на дне водоёмов сульфид ртути вполне может окислиться в растворимую соль – сульфат, в результате чего в воду попадают ядовитые ионы двухвалентной ртути - Hg2+.
Надо помнить, что производные данного иона склонны к реакции диспропорционирования, в результате чего в водоёме появляется Hg2+ и металлическая ртуть:
Hg22+ = Hgo + Hg2+
Микроорганизмы, живущие в воде, являются катализаторами этой реакции. Если в водоём, загрязнённый ртутью, сбрасывают сточные воды, содержащие органические примеси, то в водоёме размножаются бактерии, способные реагировать с ртутью, образуя органические соединения - (СН3)2Нg и СН3Нg+.
Схема круговорота ртути представлена на рисунке 3.4.
Все формы ртути прямым или непрямым путем переходят в метилртуть. Высокая токсичность данных металлических соединений объясняется тем, что они легко "взламывают" биологическую защиту организма, проникая в кровь и отравляя весь организм.
Ещё один фактор, который необходимо учитывать при рассмотрении физических процессов, которым подвергаются загрязнители в гидросфере, это их способность к аккумуляции в растительности и живых организмах.
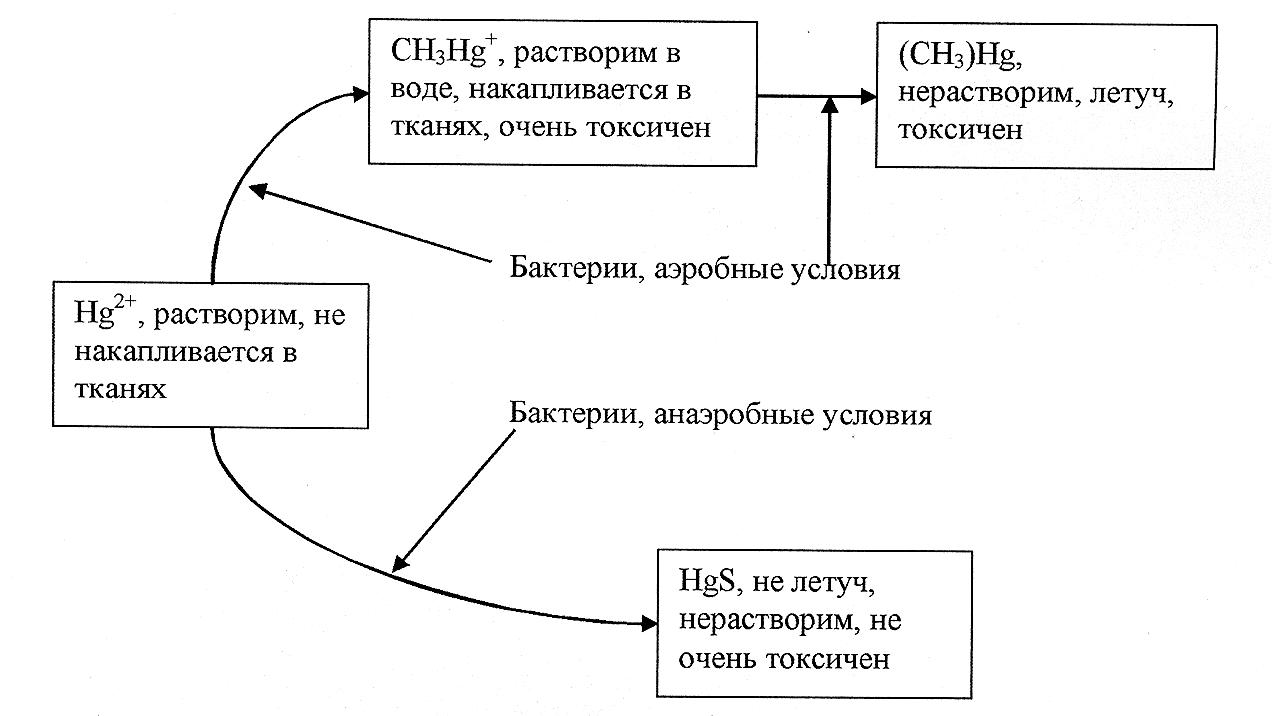
Рисунок 3.4 – Схема круговорота ртути
На рисунке 3.5 представлена упрощенная схема превращений ртути в водоемах.
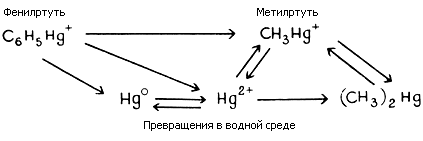
Рисунок 3.5 - Упрощенная схема превращений ртути в воде.
Концентрация ртути в рыбе может быть в 1000 раз выше, чем в водоёме, в котором рыба выловлена. Попадая в организм человека, ртуть также аккумулируется, вызывая тяжелые отклонения и приводя к рождению умственных и физических уродов (болезнь Минамата).
Свинец. В процессе антропогенной деятельности в природные воды ежегодно попадает 500-600 тыс. т свинца.
В воде он в основном адсорбирован на поверхности взвешенных частиц или находится в виде растворимых комплексов с гуминовыми кислотами. При биометилировании свинца образуется тетраметилсвинец. Водные растения хорошо аккумулируют свинец. Иногда планктон удерживает его с коэффициентом концентрирования 105.
При сжигании нефти и бензина в окружающую среду поступает не менее 50 % всего антропогенного выброса этого металла. Можно утверждать, что содержание свинца в хлорированной водопроводной воде выше, чем в нехлорированной. Для перевода Pb в Pb+2 необходим окислитель, каковым является хлорноватистая кислота (HClO), образующаяся при хлорировании воды:
H2O + Cl2 = H+ + Cl- + HClO.
Особенности нахождения и миграции свинца в природных водах обусловлены осаждением и комплексообразованием с органическими и неорганическими лигандами. Интенсивность этих процессов зависит от рН и окислительно-восстановительного потенциала среды, наличия лигандообразователей и др.
Свинец взаимодействет с водой и кислородом воздуха:
2Pb + O2 + 2H2O → 2Pb(OH)2.
В основных средах свинец может накапливаться в значительных концентрациях, образуя растворимые плюмбиты:
Pb(OH)2 + 2OH- → PbO22- + 2H2O.
Если в воде присутствует СО2, то это приводит к образованию довольно хорошо растворимого гидрокарбоната свинца:
2Pb + O2 → 2PbO
PbO + CO2 → PbCO3
PbCO3 + H2O + CO2 → Pb(HCO3)2
Кадмий. Кадмий относится к числу рассеянных элементов, его содержание в земной коре невелико (8·10-6 %).
Рудники цветных металлов представляют собой главный источник выбросов кадмия в водную среду. Загрязнение может происходить за счет шахтных дренажных вод, сточных вод после переработки руд. Выброс этих потоков в локальные русла может привести к обширному загрязнению водотоков ниже по течению. Рудники, которыми перестали пользоваться, могут тем не менее в течение многих лет продолжать загрязнять соседние водоемы.
Производство фосфатных удобрений приводит к перераспределению кадмия, присутствующего в фосфатных горных породах, между продуктом, которым является фосфорная кислота и отходами гипса. Во многих случаях от гипса избавляются, сбрасывая его в прибрежные воды, что приводит к значительному поступлению кадмия.
Выпадение кадмия с атмосферными осадками в пресные и морские водоемы является основным источником поступления кадмия на глобальном уровне.
Подкисление почв и озер за счет кислотных дождей может привести к увеличению подвижности кадмия из почв и отложений и приводить к повышению его концентрации в поверхностных и грунтовых водах. В водоемах кадмий подвергается метилированию.
Реки, загрязненные кадмием, могут загрязнять окружающую среду вследствие орошения или ирригации в сельскохозяйственных целях при выгрузке вычерпанных осадков. Значительные количества кадмия, поступающего в пресные воды из промышленных источников, быстро сорбируются взвешенными частицами и могут осаждаться или оставаться в суспендированном состоянии в зависимости от климатических условий. Результатом этого могут быть низкие концентрации растворенного кадмия даже в реках, которые принимают и переносят большие количества этого металла.
Высокая фитотоксичность кадмия объясняется его близостью по химическим свойствам к цинку. Поэтому кадмий может замещать цинк во многих биохимических процессах, нарушая работу большого количества ферментов.
По фитотоксичности и способности накапливаться в растениях кадмий занимает первое место в ряду тяжёлых металлов. Кадмий в основном локализуется в корнях и в меньших количествах - в стеблях, черешках и главных жилках листьев. Токсичность кадмия для растений проявляется в нарушении активности ферментов, торможении фотосинтеза, нарушении транспирации, а также ингибировании восстановления NО2 до NО. Кроме того, в метаболизме растений он является антагонистом ряда элементов питания (Zn, Cu, Mn, Ni, Se, Ca, Mg, P). При токсичном воздействии металла у растений наблюдаются задержка роста, повреждение корневой системы и хлороз листьев. В растения кадмий поступает из почвы и атмосферы.
В организм человека кадмий поступает главным образом с пищей, а также с водой и воздухом. Токсичное действие металла проявляется уже при очень низких концентрациях. Его избыток ингибирует синтез ДНК, белков и нуклеиновых кислот, влияет на активность ферментов, нарушает усвоение и обмен других микроэлементов (Zn, Cu, Se, Fe), что может вызывать их дефицит. Кадмий является антагонистом кальция и железа и способен замещать эти элементы, например, кальций в костной ткани. Поэтому недостаток в организме цинка, железа и кальция может привести к 2-3 кратному повышению усвояемости кадмия из желудочно-кишечного тракта (до 15-20 %).
Поведение соединений азота в поверхностных водоемах
Неорганические соединения (NH4+, NO2-, NO3-) азота присутствуют практически во всех природных водах и зачастую сдерживают развитие организмов. Их содержание в природных водах обусловлено, прежде всего, качеством и количеством сбрасываемых неочищенных или недостаточно очищенных от азотсодержащих веществ сточных вод, атмосферных осадков, а также кинетикой их биохимической трансформации.
Значительные количества азота и фосфора поступают с удобрениями, которые могут вымываться обильными дождями и попадать в грунтовые и поверхностные воды. Ионы NO3-, NH4+, H2PO4-, HPO42- способствуют зарастанию водоемов растительностью.
Кроме того, нитриты и нитраты могут быть восстановлены до NH4+ сероводородом или оксидом железа (+2).
Применяемый в качестве удобрения карбамид (мочевина) под влиянием микроорганизмов и фермента уреазы гидролизуется с образованием аммиака и диоксида углерода:
(NH2)2CO + 2 H2O ↔ 2 NH3 + CO2 + H2O ↔ (NH4)2CO3.
Образующийся карбонат подвергается гидролизу:
(NH4)2CO3 + H2O ↔ NH4OH + NH4HCO3.
В воде аммиак в аммониевой форме NH4+ подвергается двухступенчатой окислительной реакции нитрификации с помощью автотрофных бактерий-нитрификаторов:
2 NH3 + 3O2 → 2H+ +2 NO2- +2 H2O
и азотобактерий:
2NO2- + O2 → 2NO3-.
Схематично эту цепочку превращений можно представить в следующем виде:
NH3 (NH4+) → NO2- → NO3-.
На рисунке 3.6 представлена схема превращений соединений азота в водоеме.
Завершая кругооборот, нитрат- и нитрит-ионы преобразуются с помощью бактерий в процессе денитрификации в газообразное состояние в виде N2 и N2O.
Чрезмерные загрязнения водоемов органическими веществами приводят к тому, что темпы биохимических превращений денитрификации становятся медленнее процессов нитрификации. Поэтому в водоемах повышаются концентрации нитритов и нитратов.
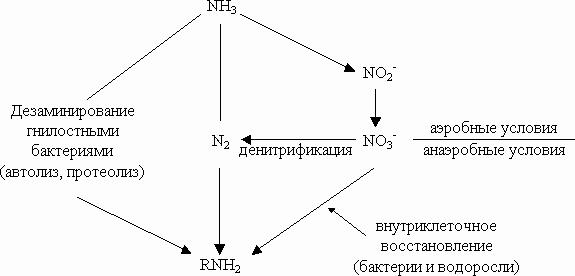
Рисунок 3.6 - Превращение соединений азота в водоеме
В последние годы, повышенные уровни нитратов в окружающей среде получили новую, более серьезную интерпретацию. Она связана с возможностью образования при взаимодействии нитритов и вторичных аминов новых соединений – нитрозоамины, которых следует отнести к наиболее опасным веществам. Нитрозоамины не только не имеют себе равных по канцерогенной активности, но и способны активировать и другие, более слабые канцерогены (например, бенз(а)пирен). Они могут накапливаться в окружающей среде в значительных количествах не только после внесения азотных удобрений и различных почвенных гербицидов в повышенных дозах. В любых объектах, где присутствуют нитритные ионы в кислой среде и вторичные амины, образуются нитрозоамины по следующей схеме:
(R2) NH + HO-NO → R2N- NO + H2O.
При усиленном обеспечении азотом в определенных микробиологических условиях в почве отмечается поглощение нитритных ионов растениями, которые, реагируя с вторичными аминами растений, также могут образовывать нитрозоамины. В этом случае возникает серьезный практический вопрос – степень канцерогенной опасности нитрозоаминов для человека
Мочевина (карбамид), будучи одним из важных продуктов жизнедеятельности водных организмов, присутствует в природных водах в заметных концентрациях: до 10-50 % суммы азотсодержащих органических соединений в пересчете на азот. Значительные количества мочевины поступают в водные объекты с хозяйственно-бытовыми сточными водами, с коллекторными водами, а также с поверхностным стоком в районах использования ее в качестве азотного удобрения. Карбамид может накапливаться в природных водах в результате естественных биохимических процессов как продукт обмена веществ водных организмов, продуцироваться растениями, грибами, бактериями как продукт связывания аммиака, образующегося в процессе диссимиляции белков. Значительное влияние на концентрацию мочевины оказывают внеорганизменные ферментативные процессы. Под действием ферментов происходит распад мононуклеотидов отмерших организмов с образованием пуриновых и пиримидиновых оснований, которые в свою очередь распадаются за счет микробиологических процессов до мочевины и аммиака. Под действием специфического фермента (уреазы) мочевина распадается до аммонийного иона и потребляется водными растительными организмами.
Повышение концентрации мочевины может указывать на загрязнение водного объекта сельскохозяйственными и хозяйственно-бытовыми сточными водами. Оно обычно сопровождается активизацией процессов утилизации мочевины водными организмами и потреблением кислорода, приводящего к ухудшению кислородного режима.
3.4 Поведение соединений фосфора в поверхностных водоемах
Значительные количества фосфора поступают с удобрениями, которые могут вымываться обильными дождями и попадать в грунтовые и поверхностные воды.
В настоящее время в результате широкого применения моющих и чистящих средств и их последующего сброса в водоемы добавляются соединения фосфора. Одним из компонентов многих синтетических моющих средств являются конденсированные фосфаты, например, триполифосфаты. При гидролизе они могут переходить в форму фосфат-ионов различной степени диссоциации:
P3O105- + 2H2O = 2HPO42- + H2РО4-.
Полифосфаты удаляются из вод в виде труднорастворимых фосфатов железа:
Fe3+ + PO43- = FePO4.
Рост применения удобрений, моющих и чистящих средств, содержащих биогенные элементы привел к такой ситуации, когда процессы естественного цикла превращения этих элементов не справляются с возросшей нагрузкой. Следствием этого положения является накопление соединений биогенных элементов в природных водоемах, а это, в свою очередь, способствует зарастанию естественных водных систем водорослями и другими водяными растениями (антропогенное эвтрофирование водоемов).
