
- •Содержание
- •Введение
- •Классификация химических превращений в окружающей среде Все химические превращения загрязняющих веществ в окружающей среде можно разделить на:
- •1.2 Миграция химических элементов в окружающей среде
- •Перенос почва – вода
- •Лекция № 2 ФизиКо-химические процессы в атмосфере
- •2.1 Пыли и аэрозоли
- •2.1.1 Химический состав аэрозолей
- •2.1.2 Сток аэрозолей в тропосфере
- •2.3 Газы в атмосфере
- •2.3 Химические превращения в атмосферном воздухе
- •Состав облачных и дождевых капель. Химические процессы в жидкой фазе
- •2.4 Фотохимические реакции в нижних слоях атмосферы
- •Фотохимические реакции оксидов азота (фотохимический смог)
- •Другие химические реакции оксидов азота
- •Химические реакции соединений серы. Кислотные дожди
- •Влияние кислотных дождей на природные объекты, здания, памятники и технику
- •Окисление монооксида углерода
- •Химия парникового эффекта
- •2.5 Атмосферная химия органических веществ Окисление метана и его гомологов
- •Хлорорганические соединения. Пестициды
- •2.6 Фотохимические реакции в верхних слоях атмосферы
- •Лекция № 3 Физико-химические процессы в гидросфере
- •3.1. Сведения о свойствах воды и её загрязнении
- •Вторичное загрязнение
- •3.2 Физико-химические превращения металлов в гидросфере
- •Превращения металлов при участии микроорганизмов
- •3.5 Эвтрофирование водоемов
- •Трофический статус водного объекта
- •Эвтрофирование и сукцессия
- •Стадии эвтрофирования
- •Хозяйственные последствия эвтрофирования
- •Борьба с эвтрофированием
- •Формы нефтяных загрязнений
- •Последствия загрязнения морей и океанов нефтью
- •3.7.2 Поверхностно-активные вещества
- •3.7.3 Пестициды
- •Лекция № 4 Физико-химические процессы в литосфере и почвенном покрове
- •4.1 Поведение тяжелых металлов и их соединений в почвах
- •4.2 Поведение пестицидов в почвах
- •4.3 Загрязнение почв нефтью
- •4.4 Процессы биологического разложения твердых бытовых отходов
- •Лекция № 5 физико-химические превращения в окружающей среде суперэкотоксикатов
- •5.1 Стойкие органические загрязнители
- •5.2 Полихлорированые бифенилы
- •Полиароматические углеводороды (пау)
- •5.4 Дихлордифенилтрихлорэтан (ддт)
- •Лекция № 6 Радиоактивные вещества в окружающей среде
- •6.1 Взаимодействие ионизирующего излучения с компонентами атмосферы
- •Радиационно-химические превращения вещества под действием радиоактивных излучений
- •6.2 Искусственные радионуклиды в морских экосистемах
- •Радиолиз воды
- •6.3 Поведение радионуклидов в почвах
- •6.4 Поступление радионуклидов в растения
- •Лекция № 7 биохимические процессы трансформации загрязняющих веществ в окружающей среде
- •Процессы, протекающие при нарушении экологического равновесия в круговороте биогенных элементов
- •Список литературы Основная
- •Дополнительная
- •Физико-химические превращения загрязняющих веществ в окружающей среде конспект лекций
2.5 Атмосферная химия органических веществ Окисление метана и его гомологов
Метан (СН4) – газ биогенный, хотя человечество в своей хозяйственной деятельности косвенно поставляет его в атмосферу: идет разложение органического мусора, органики вод очистных сооружений и т. д. Увеличение поголовья скота, масштабов выращивания риса, общее повышение температуры болот - все, что ведет к усилению микробной деятельности, способствует образованию и повышению концентрации метана в атмосфере. Максимум содержания метана расположен над высокими и умеренными широтами северного полушария. Концентрация метана возрастает примерно на 1,2 % в год. Его содержание в атмосфере истекшие два столетия повысилось примерно в двое и оценивалось к началу ХХІ в. величиной 4000-5000 млн. т. По своей способности усиливать парниковый эффект метан в 20 раз превосходит углекислый газ.
Молекула метана химически довольно устойчива и ее нелегко вывести из атмосферы. Метан мало растворим в воде (30 смЗ/дм3 воды), и вымывание его осадками из атмосферы не наблюдается. Разложение молекулы метана в атмосфере происходит в результате взаимодействия с радикалом гидроксила:
•HO + CH4 → H2O + •CH3.
Источником радикалов °ОН в тропосфере является тропосферный озон, который под действием ультрафиолета с длиной волны < 310 нм разрушается с образованием молекулы кислорода и чрезвычайно реакционноспособного атома кислорода.
В тропосфере протекает цепь последовательных реакций, которые приводит к выводу метана из атмосферы:
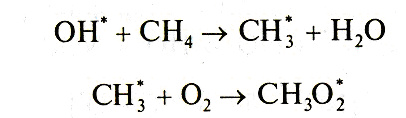
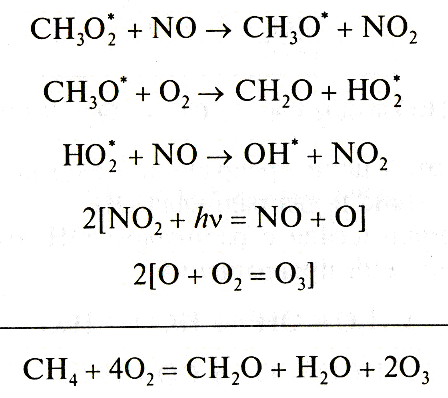
В результате последовательной цепи превращений из одной молекулы метана образуется по одной молекуле формальдегида (СН2О), воды и две молекулы озона. Требуемые для осуществления реакций оксиды азота NOx находятся в атмосфере в количествах, обеспечивающих приемлемые условия.
Молекулы формальдегида, образующиеся в ходе выше приведенныx реакций окисления метана, обладают значительной химической активностью и в условиях атмосферы испытывают следующие превращения:
CH2O + hν → H2 + CO• (2.13)
CH2O + hν → H• + HCO• (2.14)
CH2O + OH• → HCO• + H2O (2.15)
Вероятности осуществления этих реакций оцениваются соответственно как 0,5:0,25:0,25. Реакции 2.13 и 2.14 в приведенной выше схеме являются родоначальниками дальнейших циклов превращений. Цикл, в основе которого лежит реакция 2.15, состоит из следующих реакций:
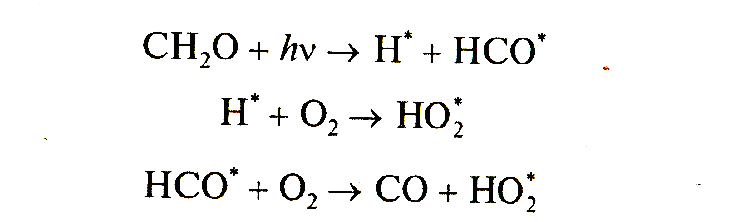
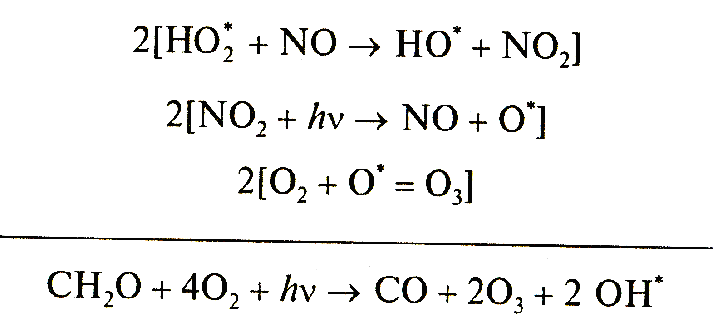
Продуктами этой цепи превращений формальдегида являются две молекулы озона и два радикала ОН°. Реакция формальдегида с радикалом ОН° открывает начало многоступенчатой цепи превращений:
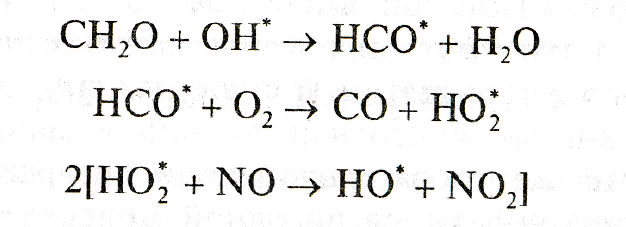
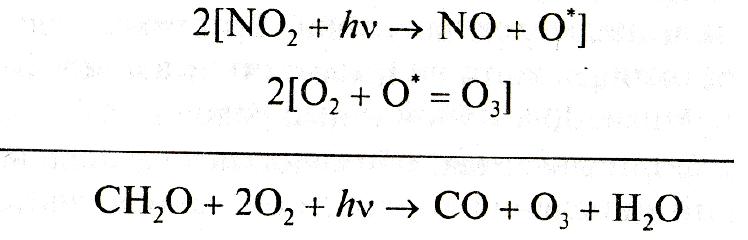
Завершающей стадией на пути трансформации молекулы метана в конечные продукты служит цикл реакций, начало которому дает взаимодействие образовавшегoся на промежуточных ступенях монооксида углерода (СО) с радикалом гидроксила:
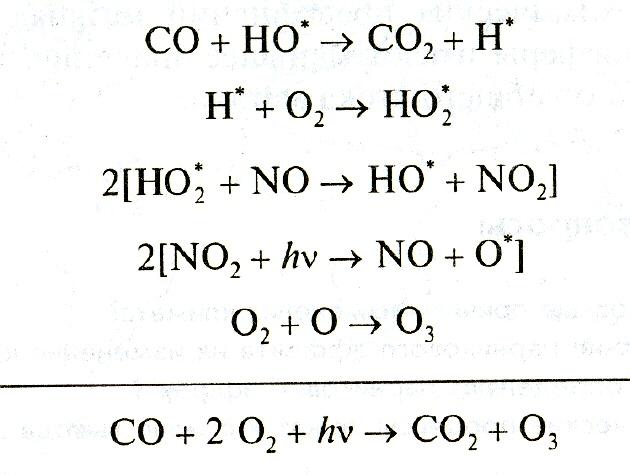
Схема превращений метана в атмосфере представлена на рисунке 2.15.
 (1)
СН4
+ 4О2
СН2О
+ Н2О
+ 2О3
(1)
СН4
+ 4О2
СН2О
+ Н2О
+ 2О3
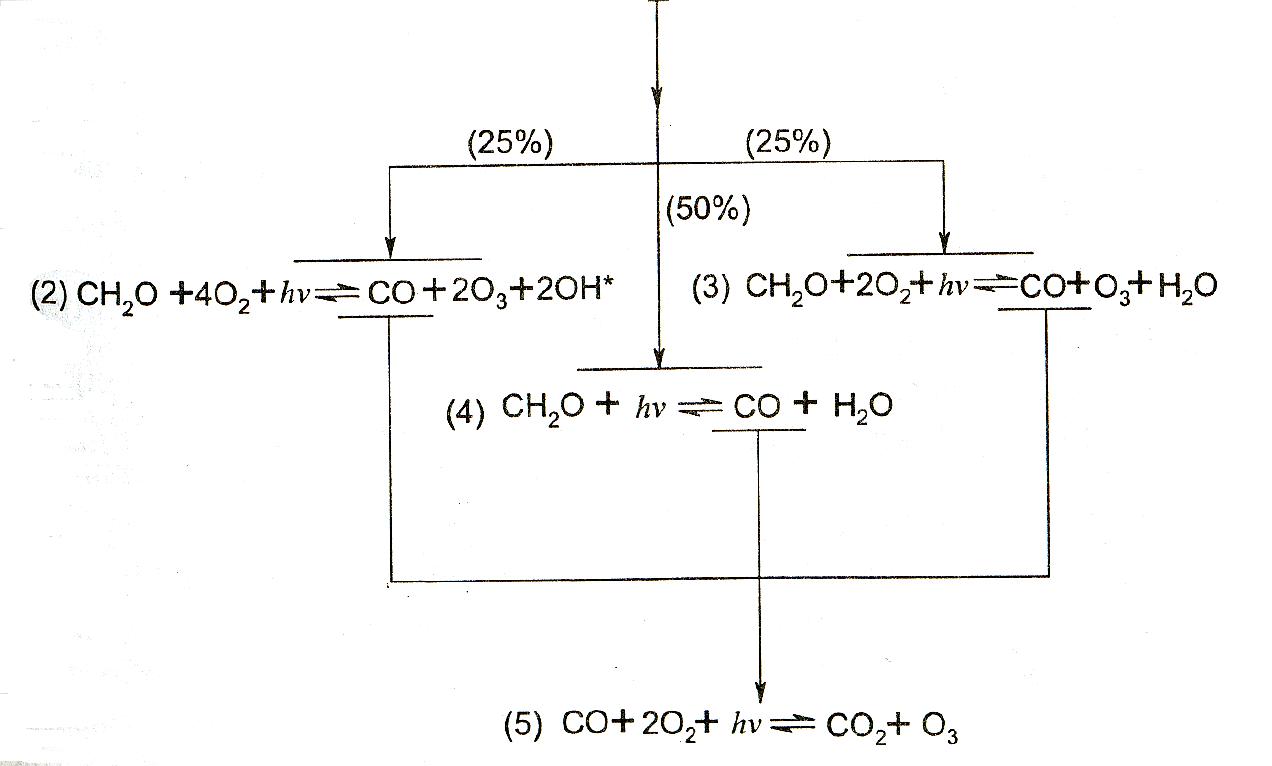
Рисунок 2.15 – Схема превращений метана в атмосфере
Таким образом, в загрязненном воздухе накапливаются озон и радикалы гидроксила, поэтому окислительный потенциал атмосферного воздуха увеличивается.
Дополнить выше перечисленные схемы можно реакциями, завершающимися образованием муравьиной кислоты:
CH2O + HO2• ↔ CH2(OH)O2•,
CH2(OH)O2• + NO → CH2(OH)O• + NO2,
CH2(OH)O• + O2 → HCOOH + HO2•.

СН2О + NO + O2 → HCOOH + NO2.
Гомологи метана. Скорость взаимодействия с гидроксильным радикалом сильно зависит от строения молекулы алкана.
Вторичные и третичные атомы водорода метиленовых (СН2) и метиновых (СН) групп отщепляются легче, чем первичные. Поэтому, скорость реакции увеличивается при переходе от метана к его гомологам и от линейных алканов к их разветвленным изомерам.
Окислительная деструкция насыщенных углеводородов начинается с отщепления атома водорода при взаимодействии с гидроксилрадикалом, а в ночное время с радикалом NOx.
RH + HO• → R• + H2O
R• + O2 → ROO• .
В атмосфере, состоящей на 98,9 % из азота и кислорода, главным направлением превращения является разложение образовавшегося алкилпероксидного радикала:
ROO•+ NO → RO•+ NO2.
ROO•+ ROO• → О2 + 2 RO•.
В качестве побочного процесса может происходить присоединение оксидов азота к алкильному радикалу:
ROO• + NO → RNO2
ROO• + NO2 → RNOO2 .
В дальнейшем происходят химические реакции по разным направлениям с участием молекул NО, NO2 или радикальных частиц M.
Пероксиды, образовавшиеся при реакции с NO2 и гидропероксидным радикалом, легко разлагаются под действием солнечной радиации или атаке гидроксильного радикала.
Другим направлением стока алкилпероксидного радикала может оказаться его взаимодействие с НО2•:
RO2• +HO2• → ROOH + O2.
Образовавшийся алкилпероксид либо удаляется из атмосферы на подстилающую поверхность, либо вновь разлагается по одному из двух направлений:
ROOH + hν → RO• + HO•,
ROOH + HO• → RO2• + HO.
Одно из главных направлений превращений алкильных радикалов – образование карбоксильных соединений:
R1R2CHO + O2 → R1R2C=O + HO2•. (2.16)
R1R2C=O → R1CH=O + •R2. (2.17)
Таким образом, инициируемое радикалом гидроксида окисление алканов с числом атомов углерода более трех включает множество промежуточных частиц и прогрессивно усложняется. В частности, радикалы RO° могут взаимодействовать с молекулярным кислородом, диссоциировать или перегруппировываться (реакции 2.16-2.17).
Алкены. Углеводороды с двойной связью имеют высокую реакционную способность. Главным направлением окисления таких соединений является присоединение по двойной связи.
Присоединение радикала НО° инициирует цепь превращений, последовательность которых можно проследить на примере пропилена:
CH3CH=CH2 + НО• → CH3•CHCH2OH, (2.18)
CH3CH=CH2 + НО• → CH3CH(OH) •CH2. (2.19)
CH3•CHCH2OH + O2 → CH3CH(OO•)CH2OH, (2.20)
CH3CH(OO•)CH2OH + NO → CH3CH(O•)CH2OH + NO2, (2.21)
CH3CH(O•)CH2OH + O2 → CH3COCH2OH +HO2•, (2.22)
CH3CH(OO•)CH2OH → CH2CH=O + •CH2OH, (2.23)
•CH2OH + O2 → CH2O + НО•. (2.24)
Из уравнений 2.18-2.24 видно, что инициируемое радикалом гидроксида окисление алкенов в условиях антропогенного загрязнения воздуха сильно влияет на конверсию монооксида азота в диоксид азота и, тем самым, на образование озона. Действительно, даже неполное окисление пропилена приводит к образованию четырех молекул диоксида азота:
С3H8 + 4O2 + 4NO → CH3CH=O + 4NO2 + CO2 + H2O (2.25)
Другими продуктами окисления в загрязненном воздухе являются низшие карбоновые кислоты и пероксиацетилнитрат:
hν O2 NO2
 CH3CHO
CH3•C=O
CH3C(O)OO•
CH3(O)OONO2.
CH3CHO
CH3•C=O
CH3C(O)OO•
CH3(O)OONO2.
•OH
Одним из существенных стоков алкенов из атмосферы служит их реакция с озоном с образованием озонидов.
Ароматические углеводороды. Бензол и его гомологи составляет примерно 30-40 % от всего количества углеводородов в атмосферном воздухе городов. Реакционная способность ароматических углеводородов в значительной степени зависит от степени замещенности бензольного кольца и возрастает с увеличением числа алкильных заместителей.
Отмечено несколько направлений, по которым протекают химические реакции аренов:
- одно из них – замещение в бензольном кольце. В этом случае из бензола и толуола образуются фенол и крезол. В присутствии оксидов азота образуются также нитробензол, нитротолуол, нитрофенол и нитрокрезол. Однако, по этому пути происходят химические реакции только с 15 % исходных аренов;
- основное направление превращения бензола и толуола происходит посредством раскрытия цикла. Оно начинается с присоединения радикала ОН- с образованием аддукт-радикала, который быстро реагирует с кислородом. В результате образуются дикарбонильные соединения. В случае бензола образуется глиоксаль и бутендиаль.
Альдегиды и кетоны. Для них характерна высокая реакционная способность. Химические превращения протекают преимущественно по двум направлениям:
- фотолитическое разложение;
- окисление, инициируемое радикальными частицами.
При фотолизе ацетальдегида по одному из направлений образуется метан и оксид углерода.
Окисление ацетальдегида происходит по реакции:
СН3СН=О + 4О2 + 4NO → 2CO + 4NO2 + H2O + 2OH•.
Атмосферная химия альдегидов существенно влияет на цикл оксидов азота: неполное окисление одной молекулы ацетальдегида сопровождается окислением четырех молекул NO.
Ароматические альдегиды. Главным направлением превращений ароматических альдегидов в атмосферном воздухе является отщепление атома водорода гидроксильным радикалом. Образующийся бензоильный радикал после ряда химических взаимодействий приводит к образованию устойчивого, сильного окислителя - пероксибензоилнитрата C6H5C(O)OONO2.
Серосодержащие органические соединения. В тропосферу поступают преимущественно в результате жизнедеятельности живых организмов. Это меркаптаны, сульфиды, ди- и полисульфиды. Окисление этих соединений приводит к образованию диоксида серы, сильных кислот и кислых сульфатов. Эти процессы оказывают влияние на формирование кислотных осадков.
