
- •Содержание
- •Введение
- •Классификация химических превращений в окружающей среде Все химические превращения загрязняющих веществ в окружающей среде можно разделить на:
- •1.2 Миграция химических элементов в окружающей среде
- •Перенос почва – вода
- •Лекция № 2 ФизиКо-химические процессы в атмосфере
- •2.1 Пыли и аэрозоли
- •2.1.1 Химический состав аэрозолей
- •2.1.2 Сток аэрозолей в тропосфере
- •2.3 Газы в атмосфере
- •2.3 Химические превращения в атмосферном воздухе
- •Состав облачных и дождевых капель. Химические процессы в жидкой фазе
- •2.4 Фотохимические реакции в нижних слоях атмосферы
- •Фотохимические реакции оксидов азота (фотохимический смог)
- •Другие химические реакции оксидов азота
- •Химические реакции соединений серы. Кислотные дожди
- •Влияние кислотных дождей на природные объекты, здания, памятники и технику
- •Окисление монооксида углерода
- •Химия парникового эффекта
- •2.5 Атмосферная химия органических веществ Окисление метана и его гомологов
- •Хлорорганические соединения. Пестициды
- •2.6 Фотохимические реакции в верхних слоях атмосферы
- •Лекция № 3 Физико-химические процессы в гидросфере
- •3.1. Сведения о свойствах воды и её загрязнении
- •Вторичное загрязнение
- •3.2 Физико-химические превращения металлов в гидросфере
- •Превращения металлов при участии микроорганизмов
- •3.5 Эвтрофирование водоемов
- •Трофический статус водного объекта
- •Эвтрофирование и сукцессия
- •Стадии эвтрофирования
- •Хозяйственные последствия эвтрофирования
- •Борьба с эвтрофированием
- •Формы нефтяных загрязнений
- •Последствия загрязнения морей и океанов нефтью
- •3.7.2 Поверхностно-активные вещества
- •3.7.3 Пестициды
- •Лекция № 4 Физико-химические процессы в литосфере и почвенном покрове
- •4.1 Поведение тяжелых металлов и их соединений в почвах
- •4.2 Поведение пестицидов в почвах
- •4.3 Загрязнение почв нефтью
- •4.4 Процессы биологического разложения твердых бытовых отходов
- •Лекция № 5 физико-химические превращения в окружающей среде суперэкотоксикатов
- •5.1 Стойкие органические загрязнители
- •5.2 Полихлорированые бифенилы
- •Полиароматические углеводороды (пау)
- •5.4 Дихлордифенилтрихлорэтан (ддт)
- •Лекция № 6 Радиоактивные вещества в окружающей среде
- •6.1 Взаимодействие ионизирующего излучения с компонентами атмосферы
- •Радиационно-химические превращения вещества под действием радиоактивных излучений
- •6.2 Искусственные радионуклиды в морских экосистемах
- •Радиолиз воды
- •6.3 Поведение радионуклидов в почвах
- •6.4 Поступление радионуклидов в растения
- •Лекция № 7 биохимические процессы трансформации загрязняющих веществ в окружающей среде
- •Процессы, протекающие при нарушении экологического равновесия в круговороте биогенных элементов
- •Список литературы Основная
- •Дополнительная
- •Физико-химические превращения загрязняющих веществ в окружающей среде конспект лекций
2.6 Фотохимические реакции в верхних слоях атмосферы
Участие озона в фотохимических реакциях приводит к возникновению смога, т.е. загрязнению нижних слоев атмосферы.
Напротив, фотохимические реакции в верхних слоях атмосферы крайне важны для жизни на Земле.
К наиболее важным фотохимическим процессам, протекающим в верхних слоях атмосферы, относится фотодиссоциация молекул газа, в первую очередь, кислорода:
O2(г) + hν → 2O(г)
Фотодиссоциация кислорода происходит под воздействием ультрафиолетового излучения.
Кроме фотодиссоциации на этот же высоте происходит ионизация газов, в результате которой образуются молекулярные ионы:
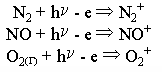
Образовавшиеся молекулярные ионы затем рекомбинируют с образованием атомов:
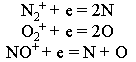
Прошедшая через стратосферу часть коротковолнового излучения поглощается нижележащим озоновым слоем.
Озон образуется в основном по реакции:
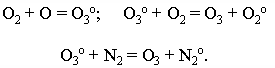
Озон, поглощая коротковолновые излучения, диссоциирует:
![]()
Процесс фотодиссоциации озона исключительно важен, так как защищает Землю от коротковолнового излучения.
Слой озона имеет определенную толщину.
Обнаруженные в последнее время так называемые "озоновые дыры" представляют собой области или с пониженной концентрацией озона в атмосфере, или с уменьшенной толщиной озонового слоя.
Образование "озоновых дыр" в настоящее время связывается с техногенной деятельностью человека. Одной из причин образования "озоновых дыр" являются фреоны.
Фреоны – это фторохлорзамещенные метана переменного состава: CFxCly(г), где (x+y)=4.
Высокая химическая устойчивость фреонов и их плохая растворимость в воде (они не вымываются дождем) позволяет этим веществам высоко подниматься в атмосфере. Оказавшись вблизи поверхности Земли, фреоны беспрепятственно проходят тропосферу и оказываются в стратосфере, где сосредоточено 90 % атмосферного озона. Путь в стратосферу долгий, т.к. фреоны, как и другие вещества, могут попасть в стратосферу с поверхности Земли только с тропическими конвективными потоками. До тропиков вещества переносятся приблизительно месяц. Движение вверх по тропосфере до высоты 10-15 км за счет конвекции занимает несколько суток, иногда часов. Но для того, чтобы оказаться на высоте 35 км, веществам требуется 15 лет. Поэтому, влияние на озоновый слой могут оказать только такие вещества, время жизни которых в атмосфере превышает несколько десятков лет. Именно такими веществами являются фреоны. Время их жизни составляет более 50 лет.
На рисунке 2.22 представлено изменение концентрации озона с высотой. О количестве озона судим по его парциальному давлению (на оси абсцисс – Р, мПа). Пик содержания озона соответствует высоте 20-25 км. Здесь же приведена схема разрушения озона фреонами. Из аэрозольного баллончика фтортрихлорметан CFCl3 поднимается в стратосферу.
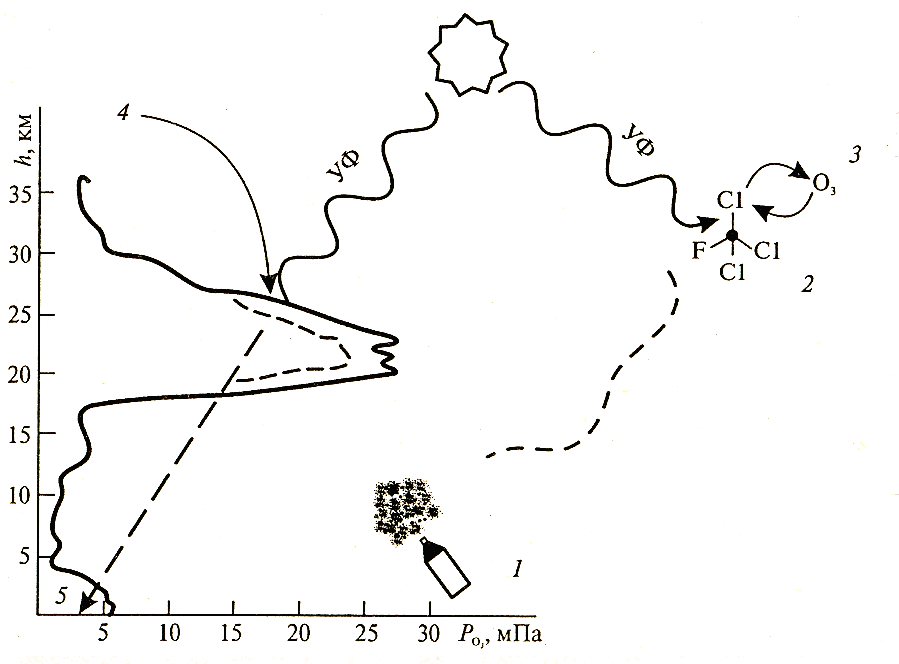
1 – фреоны высвобождаются человеком; 2 – фреоны разрушаются только в стратосфере; 3 – атом хлора разрушает озон; 4 – более тонкий озоновый слой пропускает больше УФ-излучения; 5 – увеличенное количество УФ опасно для живых организмов
Рисунок 2.22 – Изменение по высоте концентрации озона
Разрушающее воздействие фреонов на озоновый слой объясняется их фотолизом:
![]()
Образующийся атом хлора с неспаренным электроном является химически активной частицей.
При встрече с молекулой озона атом хлора разрушает его:
О3 + Cl° = ClО + О2
ClО + О = Cl° + О2
О3 + О = 2О2
В данном процессе атом хлора играет роль катализатора.
В 1970 г. было установлено, что озоновый слой истончается, следовательно, он перестает в полной мере выполнять свою защитную функцию. Уменьшение озонового слоя позволяет большему количеству УФ-лучей достигать поверхности Земли, что является вредным для живых организмов.
Механизм разрушения озона представлен на рисунке 2.23.
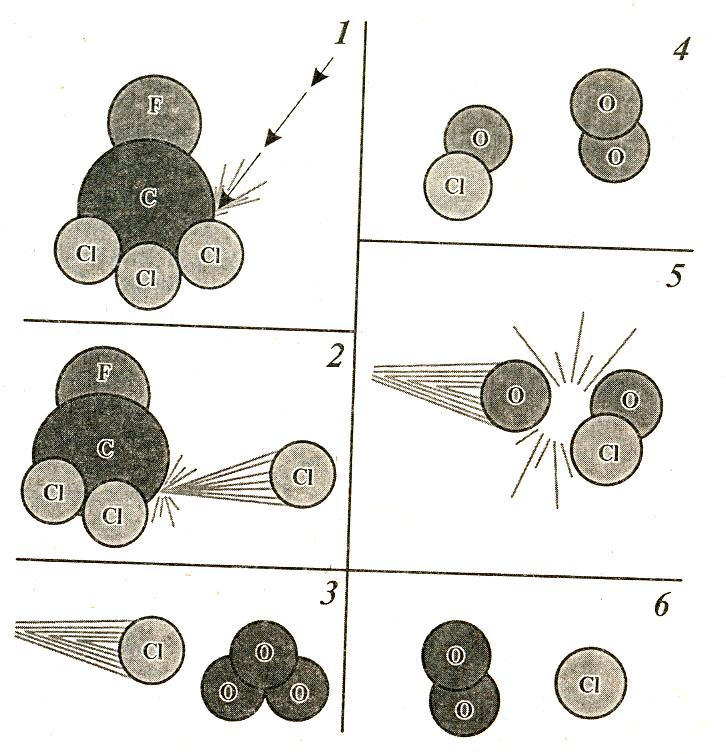
1 – УФ-излучение воздействует на молекулу СCl3F; 2 – в результате происходит отрыв атома хлора; 3 – атом хлора сталкивается с молекулой озона; 4 – при столкновении образуется монооксид хлора и высвобождается молекула кислорода; 5 – свободный атом кислорода может сталкиваться с монооксидом хлора; 6 – при столкновении два атома кислорода образуют молекулу кислорода, а атом хлора высвобождается, т.е. может дальше разрушать озон.
Рисунок 2.23 – Механизм разрушения озона в результате действия фреонов
Вопросы для самопроверки:
Привести определение аэрозоля. Какие есть виды аэрозолей?
Определение атмосферной пыли, дыма, тумана.
От каких параметров зависит время пребывания аэрозолей в атмосфере?
За счет каких процессов аэрозоли выводятся из атмосферы?
Частицы какого размера дольше остальных пребывают в атмосфере?
«Время жизни» аэрозольных частиц в тропосфере и стратосфере.
Какие вещества входят в состав аэрозолей?
В какой форме существуют тяжелые металлы в атмосфере?
Какие газы, входящие в состав атмосферного воздуха являются неустойчивыми?
Какие загрязняющие вещества являются наиболее распространенными в атмосферном воздуха?
Какими факторами определяется распространение газов в атмосферном воздухе?
Что называют фотохимическими реакциями?
Перечислить и охарактеризовать основные типы фотохимических процессов.
Привести определение свободных радикалов. В ходе каких процессов образуются свободные радикалы?
Привести химические реакции, в которых может участвовать радикал органического вещества.
Какие вещества составляют основу фотохимического смога?
Какие условия благоприятны для образования фотохимического смога?
Охарактеризовать механизм образования фотохимического смога.
Охарактеризовать механизмы образования кислотных дождей.
Что является катализатором окисления SO32- в SO42-? Каким образом протекает каталитический процесс?
Охарактеризовать влияние кислотных дождей природные объекты, здания, сооружения, памятники.
Охарактеризовать схему превращений метана в атмосферном воздухе.
Привести и объяснить химические реакции алканов и алкенов в атмосферном воздухе.
Привести и объяснить химические реакции альдегидов и серосодержащих соединений в атмосферном воздухе.
Охарактеризовать механизм разрушения озона.
