
- •Содержание
- •Введение
- •Классификация химических превращений в окружающей среде Все химические превращения загрязняющих веществ в окружающей среде можно разделить на:
- •1.2 Миграция химических элементов в окружающей среде
- •Перенос почва – вода
- •Лекция № 2 ФизиКо-химические процессы в атмосфере
- •2.1 Пыли и аэрозоли
- •2.1.1 Химический состав аэрозолей
- •2.1.2 Сток аэрозолей в тропосфере
- •2.3 Газы в атмосфере
- •2.3 Химические превращения в атмосферном воздухе
- •Состав облачных и дождевых капель. Химические процессы в жидкой фазе
- •2.4 Фотохимические реакции в нижних слоях атмосферы
- •Фотохимические реакции оксидов азота (фотохимический смог)
- •Другие химические реакции оксидов азота
- •Химические реакции соединений серы. Кислотные дожди
- •Влияние кислотных дождей на природные объекты, здания, памятники и технику
- •Окисление монооксида углерода
- •Химия парникового эффекта
- •2.5 Атмосферная химия органических веществ Окисление метана и его гомологов
- •Хлорорганические соединения. Пестициды
- •2.6 Фотохимические реакции в верхних слоях атмосферы
- •Лекция № 3 Физико-химические процессы в гидросфере
- •3.1. Сведения о свойствах воды и её загрязнении
- •Вторичное загрязнение
- •3.2 Физико-химические превращения металлов в гидросфере
- •Превращения металлов при участии микроорганизмов
- •3.5 Эвтрофирование водоемов
- •Трофический статус водного объекта
- •Эвтрофирование и сукцессия
- •Стадии эвтрофирования
- •Хозяйственные последствия эвтрофирования
- •Борьба с эвтрофированием
- •Формы нефтяных загрязнений
- •Последствия загрязнения морей и океанов нефтью
- •3.7.2 Поверхностно-активные вещества
- •3.7.3 Пестициды
- •Лекция № 4 Физико-химические процессы в литосфере и почвенном покрове
- •4.1 Поведение тяжелых металлов и их соединений в почвах
- •4.2 Поведение пестицидов в почвах
- •4.3 Загрязнение почв нефтью
- •4.4 Процессы биологического разложения твердых бытовых отходов
- •Лекция № 5 физико-химические превращения в окружающей среде суперэкотоксикатов
- •5.1 Стойкие органические загрязнители
- •5.2 Полихлорированые бифенилы
- •Полиароматические углеводороды (пау)
- •5.4 Дихлордифенилтрихлорэтан (ддт)
- •Лекция № 6 Радиоактивные вещества в окружающей среде
- •6.1 Взаимодействие ионизирующего излучения с компонентами атмосферы
- •Радиационно-химические превращения вещества под действием радиоактивных излучений
- •6.2 Искусственные радионуклиды в морских экосистемах
- •Радиолиз воды
- •6.3 Поведение радионуклидов в почвах
- •6.4 Поступление радионуклидов в растения
- •Лекция № 7 биохимические процессы трансформации загрязняющих веществ в окружающей среде
- •Процессы, протекающие при нарушении экологического равновесия в круговороте биогенных элементов
- •Список литературы Основная
- •Дополнительная
- •Физико-химические превращения загрязняющих веществ в окружающей среде конспект лекций
Вторичное загрязнение
Широкий круг разнообразных химических соединений, вызывающих первичное загрязнение, поступает в водоемы во время весенних и осенних паводков с территории водосбора с поверхностным и подземным стоком (пестициды, нефтепродукты, минеральные и органические удобрения).
Аллохтонные и автохтонные органические вещества, подвергаясь микробиологической деструкции и трансформации, аккумулируясь в живых организмах водоемов и вновь высвобождаясь при их отмирании, вызывают вторичное загрязнение. Источниками вторичного загрязнения могут стать:
продукты метаболизма сине-зеленых водорослей в период их массового развития;
растворенные и взвешенные органические соединения аллохтонного происхождения;
отмирающая биомасса гидробионтов, затопленная древесина;
разнообразные соединения и вещества, аккумулированные в донных отложениях.
Специфика вторичного загрязнения заключается в том, что невидимые и неконтролируемые процессы трансформации и биоаккумуляции органических соединений и токсичных веществ в конечном итоге приводят к реальным последствиям – изменению качества природных вод, нарушению кислородного режима, смене видового разнообразия гидробиоценозов.
Следует отметить, что факт вторичного загрязнения связан с функционированием самой водной экосистемы в пространственно – временных границах. В процесс вторичного загрязнения вовлекаются как автохтонные органические соединения, образующиеся непосредственно в самом водоеме, так и аллохтонные вещества природного и антропогенного происхождения, поступающие извне.
Суммарное воздействие первичного и вторичного загрязнения на общее экологическое состояние водной экосистемы можно выразить в виде схемы (рис. 3.1).
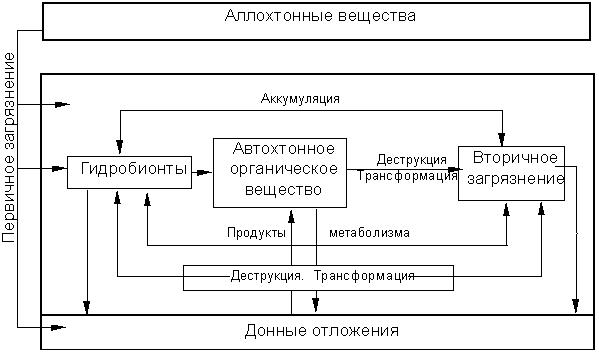
Рисунок 3.1 - Общая схема первичного и вторичного загрязнения водных экосистем
Наиболее яркое проявление вторичного загрязнения водоемов наблюдается в период массового “цветения” водорослей.
Развитию водорослей и многочисленных групп микроорганизмов, участвующих в круговороте веществ, способствует загрязнение водоемов органическими и минеральными соединениями, в том числе биогенными элементами (азот, фосфор, калий).
Интенсивное развитие водорослей и макрофитов является результатом нарушения экологического равновесия в водных экосистемах под влиянием антропогенных факторов (Сиренко, Козицкая,1988). Между тем “цветение” водорослей как следствие первичного загрязнения, приводит ко вторичному загрязнению внеклеточными и внутриклеточными органическими веществами, поступающими прижизненно в форме продуктов жизнедеятельности, а также при деструкции водорослевой биомассы после их отмирания. Обе группы соединений становятся факторами экологического риска, так как обладают высокой биологической активностью, проявляя аллергенные, мутагенные, канцерогенные, антигормональные, бактериоцидные и другие свойства.
Микробиологическое разложение прижизненных выделений и биомассы водорослей происходит в ходе минерализации и различных типов брожения (молочнокислое, спиртовое, ацетобутиловое, маслянокислое и др.) и приводит к накоплению в водоемах разнообразных органических соединений (кислот, спиртов, ацетона и др.), ухудшающих качество природных вод.
Высокомолекулярные полисахариды водорослей тормозят и снижают эффективность удаления примесей при очистке воды, а также задерживают удаление из нее низкомолекулярных метаболитов. Кроме того, белки, полипептиды и углеводы водорослей принимают участие в комплексообразовании тяжелых металлов, снижая их подвижность и способствуя аккумуляции в донных отложениях. Запахи и привкусы, появляющиеся в период “цветения”, при использовании обычной технологической схемы очистки воды не устраняются.
Таким образом, токсичные продукты, накапливающиеся в водоемах во время “цветения” и после отмирания водорослей, относятся к важным факторам вторичного загрязнения, влияющего не только на качество воды, но и на функционирование всех звеньев трофической цепи водной экосистемы.
Загрязнение природных вод обусловлено элементами первых двух групп. Это элементы: Hg, Pb, Cr, Cd, Sr, Mn, Mo, Al, Cl, S, Se, As, N, C. Соединения углерода присутствуют в гидросфере как в неорганической форме (СО, СО2, СО32-, НСО3-, Н2СО3), так и в органической.
В настоящее время известны более 2000 веществ, загрязняющих водоемы. Наиболее распространены нефть и нефтепродукты, поверхностно-активные вещества (в том числе синтетические моющие средства, широко используемые человеком), соли тяжелых металлов (свинца, железа, меди, ртути и др.). Вследствие сельскохозяйственной деятельности из почвы в поверхностные и грунтовые воды попадают удобрения, ядохимикаты (пестициды, гербициды). Наиболее опасными загрязнителями являются радиоактивные и биологически активные вещества. Такое разнообразие загрязняющих веществ делает невозможным контроль за содержанием каждого из них.
Поэтому компетентными органами стран Европейского сообщества выделены 13 групп приоритетных загрязняющих компонентов, включающих около 200 индивидуальных веществ.
Классификационные группы с примерами веществ перечислены ниже:
- хлорорганические пестициды (гептахлор, ДДТ, линдан);
- фосфорорганические пестициды (дихлофос, кумафос);
- пестициды на основе феноксиуксусной кислоты (2,4-Д, дихлорпроп, мекопроп);
- азотосодержащие пестициды на основе триазина и мочевины (атразин, 2,4,6-трихлор-1,3,5-триазин);
- летучие хлорорганические соединения (бензилхлорид, винилхлорид, 1,2-дибромэтан, 1,1- и 1,2-дихлорэтаны, 1,2-дихлорпропан, 1,3 и 2,3-дихлорпропены, хлоропрен);
- "малолетучие" хлорорганические соединения (гексахлорбутадиен, хлорнафталины);
- хлорфенолы (пентахлорфенол, трихлорфенол);
- хлоранилины и хлорнитроароматические соединения (дихлоранилин);
- полихлорированные и полибромированные бифенилы (2,3/ и 2,4/ и 4,4/ - дихлорбифенилы, 2,2/, 4,4/, 5,5/ - гексахлорбифенилы, 2,2/, 4,5/- тетрахлорбифенилы);
- ароматические углеводороды (бензол, n-ксилолы, кумол, толуол, этилбензол);
- полиароматические углеводороды - ПАУ (антрацен, без(а)пирен);
- металлорганические соединения (дибутилдихлорид олова, тетрабутилолово, диметилртуть, метилртуть);
- другие соединения (бензидин, бифенил, пиразон).
Большая часть этих приоритетных загрязняющих компонентов является галогенсодержащими органическими соединениями.
Такие соединения способны к интенсивному биоаккумулированию по причине высокой персистентности (продолжительность сохранения ксенобиотиком биологической активности в окружающей среде или её отдельных объектах в почве, атмосфере, гидросфере, растениях, тканях и т. д.) и липофильности.
Суммарное содержание органических примесей в воде определяют по величине БПК – биологической потребности в кислороде.
В природной воде живут так называемые аэробные бактерии, которые питаются органическими веществами, окисляя их с помощью растворённого в воде кислорода. Органические соединения содержат следующие элементы: С, Н, О, S, N, P. Органические вещества, способные окисляться бактериями, называются биоразложимыми.
В результате реакций окисления элементы, составляющие органические вещества, превращаются в СО2, Н2О, SO42-, NO3-, PO43-, PO33-.
В результате протекания окислительных реакций содержание кислорода в воде понижается.
Количество растворённого кислорода, необходимого для разложения всех биоразложимых органических веществ, находящихся в воде, называется биохимической потребностью в кислороде.
Суммарной пробой на органические загрязнители в воде является пятидневная БПК, обозначаемая БПК5.
БПК5 вычисляют по понижению содержания кислорода в воде при 20 oС за 5 суток. У питьевой воды БПК5 не превышает 1,5 млн.д. кислорода; канализационная вода до предварительной обработки имеет БПК5 до 400 млн. д. кислорода. Одна миллионная доля (1 млн. д.) подразумевает одну молекулу примеси на миллион молекул основного вещества, или 1 грамм примеси на миллион грамм основного вещества. Следовательно, 1,5 млн.д. – это 1,5 мг О2 в 1 дм3 воды, 400 млн.д. – 400 мг О2 в 1 дм3 воды.
Если БПК5 не превышает 30 млн.д. (30 мг/дм3), вода считается чистой, с БПК5 от 30 до 80 млн. д. – слабо загрязненной, если же БПК5 превышает 80 млн.д. – сильно загрязненная
Если содержание органических загрязнителей в источнике высоко, содержание кислорода может понизиться до такого низкого уровня, что существование аэробных бактерий станет невозможным. Дальнейшее разложение органических веществ будет продолжено анаэробными бактериями в условиях отсутствия кислорода или его низкого содержания. Под влиянием анаэробных бактерий элементы органических соединений будут восстанавливаться, образуя: NH3, H2S, PH3, CH4. Такой водный источник приобретает отвратительный гнилостный запах.
Большую группу органических загрязнителей составляют ПАВ (поверхностно-активные вещества), которые входят в состав стиральных порошков и всех моющих средств (способствуют образованию пены). Благодаря своему строению ПАВ, полярной частью молекул растворяются в воде, а неполярной ориентируются в неполярную фазу – воздух. Поверхность воды покрывается пеной, препятствующей нормальной аэрации воды. Водный источник обедняется кислородом, что может привести к гибели его обитателей.
Наиболее опасными из органических загрязнителей являются диоксины, признанные в мире абсолютным ядом. Диоксины попадают в окружающую среду из природных и, в основном, из техногенных источников. Диоксины – ароматические органические соединения, относящиеся к классу простых эфиров. Наиболее токсичными являются галогенопроизводные диоксинов, в частности, 2,3,7,8-тетрахлордибензопарадиоксин.
С органическими веществами диоксины образуют прочные комплексы, поэтому они накапливаются в микроорганизмах и растениях. В водоёмах диоксины первоначально накапливаются в донных отложениях и частично поглощаются природным зоопланктоном. По мере образования растворимых компонентов с органическими веществами диоксины переходят в воду, где они вызывают перерождение аэробных бактерий или уничтожают их. Такой водоём заселяется анаэробными бактериями, а также фотосинтезирующими бактериями, которые относительно устойчивы к воздействию диоксинов. Подобные водоёмы становятся источником разрушения прибрежных экосистем. Способность диоксинов к комплексообразованию приводит к повышению их концентрации в источниках в десятки раз выше ожидаемой на основе их растворимости. Диоксины являются ядами для высших животных и человека. По мере прохождения диоксинов по биологической цепи, на каждой стадии происходит аккумуляция и, следовательно, увеличение концентрации диоксинов, причём, увеличение концентрации может быть от 10 до 100 раз. Кроме того, диоксины накапливаются в организмах высших животных и человека. Время полураспада диоксинов в организмах составляет 10 – 12 лет. В настоящее время приняты нормы допустимого попадания диоксинов в организм человека. В разных странах эта норма составляет от 10-11 до 10-14 мг на один кг массы человека в сутки.
Вещества, попавшие в гидросферу, вовлекаются в цепь разнообразных перемещений и превращений под влиянием многочисленных факторов.
При этом происходят процессы:
- физические (механическое перемешивание, осаждение, адсорбция, десорбция, испарение);
- химические (диссоциация, гидролиз, комплексообразование, окислительно-восстановительные реакции);
- биологические (поглощение живыми организмами, разрушение и превращение с участием ферментов и метаболитов);
- геологические (захоронение в донных осадках и породообразование).
На рисунке 3.1 представлены основные потоки химических веществ в море.
Бентос - совокупность организмов, обитающих на грунте и в грунте морских и материковых водоёмов. Бентос делят на животный (зообентос) и растительный (фитобентос).
Зоопланктон удаляет из морской воды органическое вещество и минеральную взвесь, связывая их в пеллеты - комки, быстро (до 500 м/с) оседающие на дно.
Биотурбация – совокупность нарушений в почвах, породах и донных отложениях в водных объектах, вызванных деятельностью живых организмов: норы, ходы, следы копания и ползания, а также переработка минерального материала в результате прохода его через желудок организмов. Например, дождевые черви за 100 лет могут пропустить через себя слой почвы толщиной до 0,5 м. Активной биотурбации подвержены донные отложения озёр и Мирового океана.
Рассмотрим поведение основных газов, которые присутствуют в водоемах.
Диоксид углерода (CO2) находится в воде главным образом в виде растворенных молекул газа CO2. Однако часть их (около 1 %) вступает во взаимодействие с водой, образуя угольную кислоту:
CO2 + H2O ↔ H2CO3.
Обычно же не разделяют CO2 и H2CO3 и под диоксидом углерода подразумевают их сумму (CO2 + H2CO3). В природных водах источником диоксида углерода являются прежде всего процессы окисления органических веществ, происходящие с выделением CO2 как непосредственно в воде, так и в почвах и илах, с которыми соприкасается вода. К ним относятся дыхание водных организмов и различные виды биохимического распада и окисления органических остатков. В некоторых подземных водах важным источником диоксида углерода являются вулканические газы, выделяющие из недр земли, происхождение которых связано с дегазацией мантии и со сложными процессами метаморфизации осадочных пород, протекающими в глубинах под влиянием высокой температуры. Поэтому часто в подземных водах и источниках
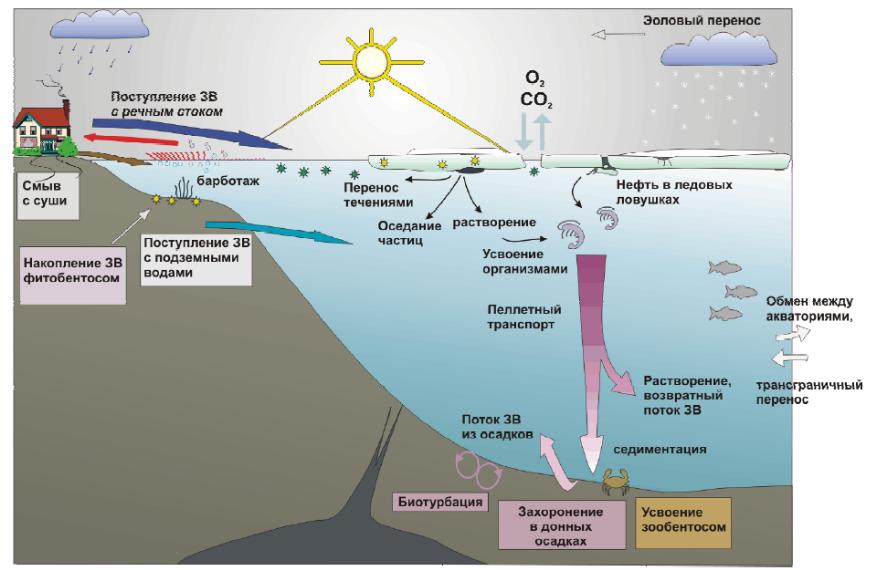
Рисунок 3.1 - Основные потоки химических веществ в море
глубинного происхождения наблюдается высокое содержание диоксида углерода. Поглощение водой диоксида углерода из атмосферы имеет более важное значение для воды морей и океана и менее значимо для вод суши. Уменьшение содержания диоксида углерода прежде всего происходит при фотосинтезе. При очень интенсивном фотосинтезе, когда отмечается полное потребление газообразного CO2, последний может быть выделен из ионов HCO3-.
HCO3- ↔ CO32- + CO2.
Диоксид углерода расходуется также на растворение карбонатов:
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2.
Также расходуется на химическое выветривание алюмосиликатов. Уменьшение содержания CO2 в воде, особенно в поверхностных водах суши, происходит также при выделении его в атмосферу. Вообще CO2 атмосферы имеет большое значение для CO2 содержащегося в поверхностных водах, регулируя его содержание там. Между CO2 атмосферы и CO2 поверхностных вод существует непрерывный обмен, направленный на установление между ними равновесия, согласно закону Генри-Дальтона. Поскольку парциальное давление диоксида углерода в атмосфере очень невелико (33 Па), то, несмотря на большую растворимость его (при давлении 1013 гПа и температуре 12 °С до 2166 мг/дм3), равновесие между водой и атмосферой достигается при очень малом содержании CO2 в воде. При парциальном давлении CO2 в атмосфере 33 Па растворимость его в воде будет 2166•0,00033=0,715 мг/дм3 (при 12 °С). Обычно же поверхностные воды суши, в которых протекают различные процессы разложения органического вещества и которые связаны с почвами, имеют большее содержание CO2 и поэтому выделяют его в атмосферу. Лишь при очень сильном фотосинтезе, когда CO2 практически исчезает, может происходить поглощение CO2 из атмосферы. Содержание диоксида углерода в природных водах чрезвычайно разнообразно - от нескольких десятых долей до 3000-4000 мг/дм3. Наименьшая концентрация CO2 наблюдается в поверхностных водах, особенно минерализованных (моря, соленые озера), наибольшая - в подземных и загрязненных сточных водах. В реках и озерах концентрация CO2 редко превышает 20-30 мг/дм3.
На рисунке 3.2 представлена схема изменения рН с участием диоксида углерода.
Абсолютное содержание форм угольной кислоты зависит не только от количества растворенного диоксида углерода, но и от концентрации ионов кальция, которые, лимитируя растворимость карбоната кальция в составе твердой фазы, контактирующей с водной средой и почвенной влагой, влияют на содержание карбонат-ионов. Таким образом, общим в процессах, определяющих кислотно-основные свойства и буферность конденсированных природных сред (водных сред, иловых отложений, почв), является ведущая роль
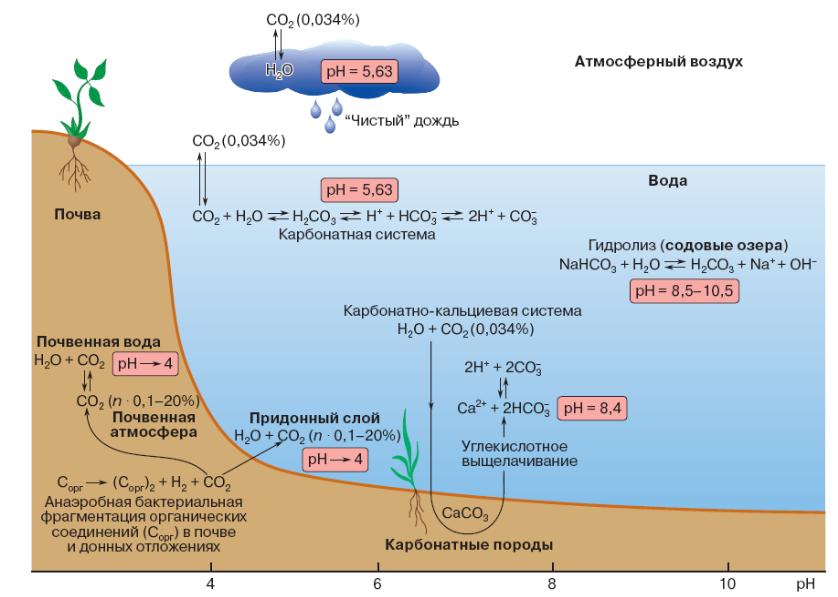
Рисунок 3.2 – Схема изменения рН воды с участием диоксида углерода
карбонатной и карбонатно-кальциевой систем, способных изменить кислотность вод.
Кислород (O2) находится в природной воде в виде растворенных молекул. Кислород, являясь мощным окислителем, играет особую роль в формировании химического состава природных вод. Кислород поступает в воду в результате происходящих в природе процессов фотосинтеза и из атмосферы. Расходуется кислород на окисление органических веществ, а также в процессе дыхания организмов. Концентрация растворенного кислорода в природных водах колеблется в ограниченных пределах (от 0 до 14 мг/дм3, при интенсивном фотосинтезе, в полдень, возможна и более высокая концентрация). Вследствие зависимости концентрации кислорода в поверхностных водах от целого ряда факторов его концентрация значительно меняется в течение суток, сезона и года. Так как потребление кислорода сравнительно мало зависит от суточных изменений солнечной радиации, а фотосинтез всецело определяется ею, то в течение дня происходит накопление кислорода, а в темное время суток расходование его. Кислород необходим для существования большинства организмов, населяющих водоемы. Как сильный окислитель кислород играет важную санитарно-гигиеническую роль, способствуя быстрой минерализации органических остатков.
Газ сероводород (H2S) является одним из продуктов распада белкового вещества, содержащего в своем составе серу, и поэтому скопление его часто наблюдается в придонных слоях водоемов вследствие гниения различных органических остатков. В нижних частях глубоких озер и морей, где отсутствует водообмен, часто образуется сероводородная зона. При парциальном давлении сероводорода в атмосфере, равном нулю, длительное присутствие его в поверхностных водах невозможно. Кроме того, он окисляется кислородом, растворенным в воде. В реках сероводород наблюдается лишь в придонных слоях, главным образом в зимний период, когда затруднена аэрация водной толщи. Присутствие сероводорода в природных незагрязненных поверхностных водах - сравнительно редкое явление. Гораздо чаще сероводород присутствует в подземных водах, изолированных от поверхности и в сильно загрязненных поверхностных водах, в которых он служит показателем сильного загрязнения и анаэробных условии.
