
- •Содержание
- •Введение
- •Классификация химических превращений в окружающей среде Все химические превращения загрязняющих веществ в окружающей среде можно разделить на:
- •1.2 Миграция химических элементов в окружающей среде
- •Перенос почва – вода
- •Лекция № 2 ФизиКо-химические процессы в атмосфере
- •2.1 Пыли и аэрозоли
- •2.1.1 Химический состав аэрозолей
- •2.1.2 Сток аэрозолей в тропосфере
- •2.3 Газы в атмосфере
- •2.3 Химические превращения в атмосферном воздухе
- •Состав облачных и дождевых капель. Химические процессы в жидкой фазе
- •2.4 Фотохимические реакции в нижних слоях атмосферы
- •Фотохимические реакции оксидов азота (фотохимический смог)
- •Другие химические реакции оксидов азота
- •Химические реакции соединений серы. Кислотные дожди
- •Влияние кислотных дождей на природные объекты, здания, памятники и технику
- •Окисление монооксида углерода
- •Химия парникового эффекта
- •2.5 Атмосферная химия органических веществ Окисление метана и его гомологов
- •Хлорорганические соединения. Пестициды
- •2.6 Фотохимические реакции в верхних слоях атмосферы
- •Лекция № 3 Физико-химические процессы в гидросфере
- •3.1. Сведения о свойствах воды и её загрязнении
- •Вторичное загрязнение
- •3.2 Физико-химические превращения металлов в гидросфере
- •Превращения металлов при участии микроорганизмов
- •3.5 Эвтрофирование водоемов
- •Трофический статус водного объекта
- •Эвтрофирование и сукцессия
- •Стадии эвтрофирования
- •Хозяйственные последствия эвтрофирования
- •Борьба с эвтрофированием
- •Формы нефтяных загрязнений
- •Последствия загрязнения морей и океанов нефтью
- •3.7.2 Поверхностно-активные вещества
- •3.7.3 Пестициды
- •Лекция № 4 Физико-химические процессы в литосфере и почвенном покрове
- •4.1 Поведение тяжелых металлов и их соединений в почвах
- •4.2 Поведение пестицидов в почвах
- •4.3 Загрязнение почв нефтью
- •4.4 Процессы биологического разложения твердых бытовых отходов
- •Лекция № 5 физико-химические превращения в окружающей среде суперэкотоксикатов
- •5.1 Стойкие органические загрязнители
- •5.2 Полихлорированые бифенилы
- •Полиароматические углеводороды (пау)
- •5.4 Дихлордифенилтрихлорэтан (ддт)
- •Лекция № 6 Радиоактивные вещества в окружающей среде
- •6.1 Взаимодействие ионизирующего излучения с компонентами атмосферы
- •Радиационно-химические превращения вещества под действием радиоактивных излучений
- •6.2 Искусственные радионуклиды в морских экосистемах
- •Радиолиз воды
- •6.3 Поведение радионуклидов в почвах
- •6.4 Поступление радионуклидов в растения
- •Лекция № 7 биохимические процессы трансформации загрязняющих веществ в окружающей среде
- •Процессы, протекающие при нарушении экологического равновесия в круговороте биогенных элементов
- •Список литературы Основная
- •Дополнительная
- •Физико-химические превращения загрязняющих веществ в окружающей среде конспект лекций
Другие химические реакции оксидов азота
На рисунке 2.7 представлена обобщенная схема химических реакций оксидов азота без учета образования фотохимического смога.
Темновое окисление оксида азота в диоксид азота происходит с участием пероксирадикала:
HOO• + NO → OH• + NO2.
Диоксид азота может участвовать в ряде других химических реакций. В присутствии пыли, содержащей карбонаты щелочных и щелочноземельных реакций, происходит образование соответствующих нитритов и нитратов:
2NO2 + Na2CO3 + H2O → NaNO3 + NaNO2 + H2CO3,
4NO2+ 2 CaCO3 + 2H2O → Ca(NO2)2 + Ca(NO3)2 + 2H2CO3.
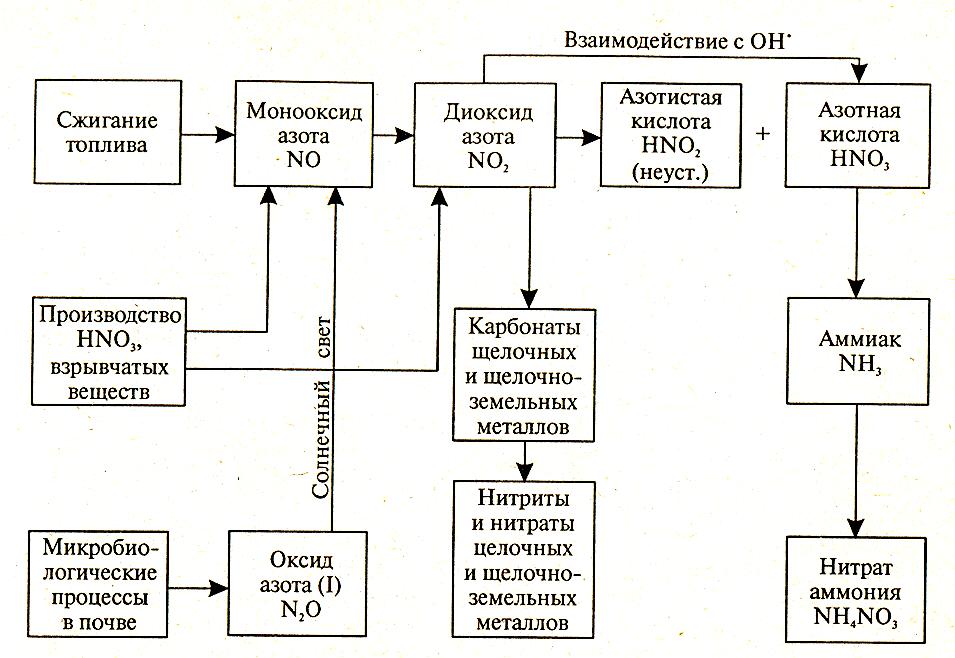
Рисунок 2.7 – Химические превращения оксидов азота в атмосфере (без учета образования фотохимического смога)
Образующиеся соли менее токсичны, чем исходный диоксид азота.
Во влажном воздухе диоксид азота вступает в реакцию с водой с образованием азотистой и азотной кислот, которые наряду с серной и сернистой кислотами являются составляющими кислотных дождей:
2NO2 + H2O → HNO3 + HNO2.
Оксид дизота (N2O), содержащийся в атмосфере, под действием солнечного излучения может превращаться в оксид азота NO. Оксид азота после ряда превращений также вносит свой вклад в проблему кислотных дождей.
2N2O → 2NO + N2,
2NO + O2 → 2NO2,
2NO2 + H2O → HNO3 + HNO2.
Азотная кислота, в атмосфере, взаимодействуя с различными веществами, образует нитраты, которые затем выпадают на землю с осадками в виде минеральных аэрозолей. Одной из таких реакций является взаимодействие его с аммиаком:
HNO3 + NH3 →NH4NO3.
В водном растворе аммиак имеет щелочную реакцию, вследствие чего может частично нейтрализовывать атмосферные кислые осадки.
Химические реакции соединений серы. Кислотные дожди
Сера в атмосферном воздухе представлена сероводородом, оксидом и диоксидом серы, сульфитами и сульфатами. Круговорот серы представлен на рисунке 2.8.
Основные источники восстановленной серы - биологические: цикл состоит из серосодержащих органических соединений SO2, SO-24, (CH3)2S (диметилсульфид) и сероводорода (H2S). Вулканическая сера поступает в атмосферу, как правило, в более окисленных формах, чем биологическая. В атмосфере подавляющая часть восстановленной серы окисляется до сульфатов. Определенная доля серосодержащих газов выводится путем сухого поглощения.
Источником громадного количества окисленной серы служит Мировой океан (сульфаты морской воды). Большая часть этих солей тут же выпадает обратно в океан. Однако, несмотря на это, этот элемент цикла является самым мощным сравнительно с остальными потоками. Сульфаты, образованные в результате окисления, являются донорами свободных протонов и, таким образом, становятся источником закисления окружающей среды.
Термином "кислотные дожди" называют все виды метеорологических осадков, рН которых меньше, чем 5,6, т.е. ниже, чем рН "чистого", или "фонового" дождя.
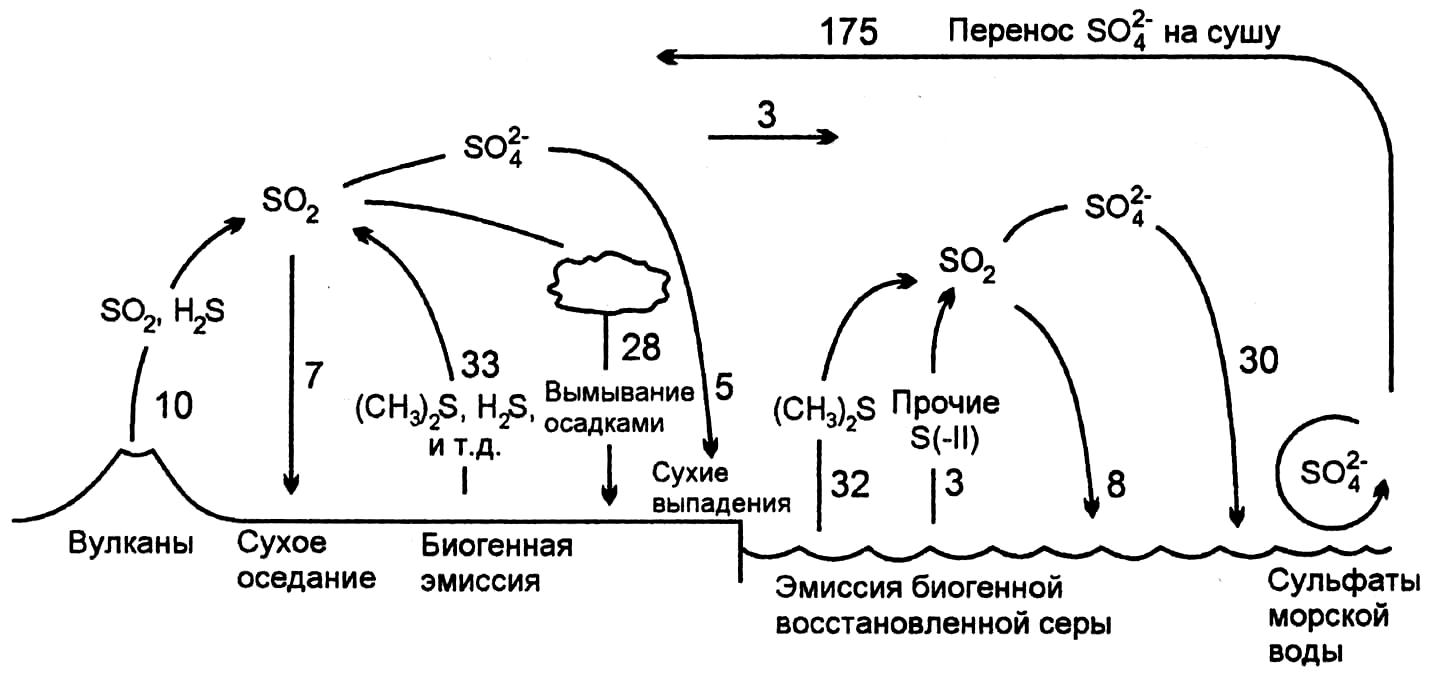
Рисунок 2.8 – Круговорот серы
О кислотных дождях заговорили в середине XIX в, когда английский химик Смит в 1852 г обнаружил в дождевой воде серную кислоту. Последующие исследования показали, что дождевая вода содержит, кроме серной кислоты, также сернистую, азотную, азотистую, муравьиную, щавелевую, уксусную. Кроме перечисленных кислот в дождевой воде содержаться ионы: NH4+, Fe2+, Na+, Ca2+, Mg2+, Mn2+.
Миллионы тонн кислых оксидов, выбрасываемых в атмосферу, превращают выпадающие дожди и другие осадки в слабый раствор кислот. Чтобы понять, как в дождевой капле образуется такой химический набор, необходимо познакомиться с образованием облаков. Примерно 15 % облаков выпадают в виде осадков, а остальные 85 %, попадая в области с более высокой температурой или меньшей влажностью, испаряются, и облака, теперь уже газовые, двигаются дальше.
Попеременно испаряясь и конденсируясь, облако может перемещаться на большие расстояния. Перемещение облаков через границы называется трансграничным переносом. Образуются облака в тропосфере, на высоте от 1 до 5 км. Поднимаясь вверх, пары воды попадают в область всё более низких температур, и поначалу ненасыщенный водяной пар становится насыщенным. В этом состоянии он должен сконденсироваться и превратиться в каплю. Но для этого необходимы центры конденсации.
Механизм образования облаков различен над поверхностью океанов и над континентальными областями.
Над поверхностью океанов, где больше всего и образуется облаков, центрами конденсации служат кристаллики соли, чаще всего NaCl. Ветер поднимает с поверхности океана капли воды, высушивает их, и образовывающиеся кристаллики соли поднимаются вверх. Хлорид натрия является гидрофильным веществом, и на его кристалликах легко конденсируется вода. Капля быстро растёт и через 5 минут достигает размера 10 микрон. Это устойчивый размер капли, и в этом состоянии она существует около часа, что и составляет срок жизни облака.
Над индустриальными зонами центрами конденсации водных капель чаще всего служат частицы оксидов железа и марганца. Их выбрасывают в воздух промышленные предприятия, например ТЭС, работающие на угле или мазуте. В топках железо- и марганецсодержащие соединения сгорают и вылетают в атмосферу в виде прокалённых, обезвоженных оксидов. Оксиды металлов гидрофильны и служат центрами конденсации для облачных капель. Fe2+ и Mn2+ содержатся в дождевых каплях в достаточно больших концентрациях (до 10-4 моль/дм3 и 10-6 моль/дм3, соответственно).
Ионы аммония появляются в дождевых каплях в результате растворения атмосферного аммиака, и тем легче, чем кислее капля:
NH3 + H+ → NH4+
Ионы кальция и магния имеют частично антропогенное происхождение.
Если расположить кислоты по мере убывания их содержания в дождевой капле, то получится следующий ряд: H2SO4, H2SO3, HNO3, HNO2, HCOOH, H2C2O4. Их концентрации уменьшаются примерно на порядок при переходе от одной кислоты к следующей. Больше всего в дождевой капле серной кислоты.
На рисунке 2.9 представлена блок-схема образования кислотных дождей.
Естественные источники Естественные источники
Процессы разрушения биосферы
Вулканическая деятельность
Почвенная эмиссия оксидов азота.


Грозовые разряды
Атмосфера

Горение биомассы.
2H2S
+ 3O2
=
2SO2
+ 2H2O
2SO2
+ O2
= 2SO3
SO3
+
H2O
= H2SO4
Антропогенные источники
Сжигание ископаемого топлива
Промышленность (химическая и
металлургическая).
2NO + O2
= 2NO2
4NO2
+ 2H2O
+ O2
=
= 4HNO3
Антропогенные источники
Сжигание
ископаемого
топлива
Транспорт






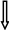




 NOx
NOx
Рисунок 2.9 – Блок-схема образования кислотных дождей
Рассмотрим образование серной кислоты, входящей в атмосферные осадки. Над поверхностью океана реализуются три механизма образования H2SO4.
1) Основной механизм образования данной кислоты заключается в окислении H2SO3 пероксидом водорода. Эта реакция протекает во влажном воздухе.
Сернистая кислота образуется по известной реакции:
SO2 + H2O → H2SO3.
Сернистый газ в природе образуется из диметилсульфида, который выделяется в результате жизнедеятельности морских организмов:
(СН3)2S+ О2 → SO2 + C2H6.
Пероксид водорода над поверхностью океанов образуется при окислении метана.
В конечном итоге:
H2SO3 + H2O2 → H2SO4 + H2O.
По данному механизму серная кислота образуется в жидкой фазе.
2) Но серная кислота может образовываться и в сухом воздухе. В этом механизме образования серной кислоты участвуют свободные радикалы – •ОН.
Данный механизм образования серной кислоты реализуется по следующим реакциям:
hν
О3 + Н2О → O2 + 2•OH
SO2 + •ОН → •SO2OH
•SO2ОН + О2 → •НO2 + SO3
SO3 + Н2O → Н2SO4.
3) По третьему механизму серная кислота образуется в жидкой фазе, но с участием радикалов •OH:
SO2 + H2O ↔ H+ + HSO3-
•OH + HSO3- → H2O + •SO3-
Ион – радикал •SO3-, очень активная частица, легко соединяется с атмосферным кислородом:
•SO3- + О2 → •SO5-
•SO5- + НSО3- → HSO5- + •SO3-
HSO5- - ион надсерной кислоты H2SO5 (кислота Каро).
В результате гидролиза кислоты Каро образуется серная кислота:
Н2SO5 + Н2O ↔ Н2SO4 + Н2О2.
Эта реакция является цепной как все реакции, протекающие по радикальному механизму.
Стадия возникновения радикал-иона •SO3- инициирует зарождение цепи.
Дальнейшее окисление •SO3- в •SO5- и взаимодействие радикал-иона •SO5- с кислотой приводит к росту цепи.
Однако, в отличие от разветвлённых цепных реакций в данном случае быстро происходит обрыв цепи, поскольку концентрация Н2SO3 в дождевой капле над океаном невысока.
В атмосферном воздухе содержаться оксиды металлов, такие как оксид кальция, оксид железа (II). Они могут вступать в химическую реакцию с серной кислотой с образованием твердых частиц – оксидов кальция и железа.
СаО + H2SO4 → CaSO4 + H2O,
FeО + H2SO4 → FeSO4 + H2O.
Если в атмосфере содержится аммиак, то серная кислота вступает с ним во взаимодействие с образованием гидросульфата и сульфата аммония:
NH3 + H2SO4 → NH4HSO4,
NH4HSO4 + NH3 → ( NH4)2SO4.
Cодержание частиц сульфатов и капель серной кислоты в воздухе городов может достигать от 5 до 20 %. Исследования показали, что большая часть диоксида серы превращается в серную кислоты и сульфаты в течение нескольких суток после поступления в атмосферу. За это время ветер может отнести эти загрязнения на сотни км от места выброса. Замеры показали, что сернистый газ и образующиеся в облаках кислоты могут переноситься мощными потоками воздуха на расстояния до 1500 км.
Во время переноса диоксид серы и образуемые им кислоты могут быть нейтрализованы только в том случае, если в воздухе находится пыль, содержащая гидроксиды щелочных и щелочноземельных металлов.
В районах размещения цементных заводов, заводов строительных материалов в атмосферный воздух выбрасывается аэрозоль оксида кальция. Оксид кальция взаимодействует с водой и образует гидроксид кальция Са(ОН)2.
СаО + H2O → Ca(OH)2.
Это основной источник, так называемых, щелочных дождей.
В свою очередь гидроксид кальция в атмосфере взаимодействует с SO2, SO3, H2SO3. H2SO4 с образованием, соответственно, сульфитов и сульфатов кальция:
SO2 + Ca(OH)2 → CaSO3 + H2O,
SO3 + Ca(OH)2 → CaSO4 + H2O,
H2SO4 + Ca(OH)2 → CaSO4 + 2H2O,
H2SO4 + Ca(OH)2 → CaSO4 + 2H2O.
Однако в результате нейтрализации лишь небольшая часть диоксида серы удаляется из атмосферы, и встречается она не во всех регионах.
Перечисленные превращения SO2 в атмосфере представлены на рисунке 2.9.
Помимо SO2 в дождевой капле растворяется и формальдегид, который образуется в результате окисления метана в атмосфере:
СН4 + О2 → СН2=О + Н2О.
Концентрация формальдегида в дождевой капле даже выше, чем Н2SO3. В результате ряда реакций формальдегид окисляется в уксусную кислоту, а та, в свою очередь – в щавелевую.
Тем не менее, кислотность дождевой воды над океаном редко опускается ниже, чем рН = 5,0.
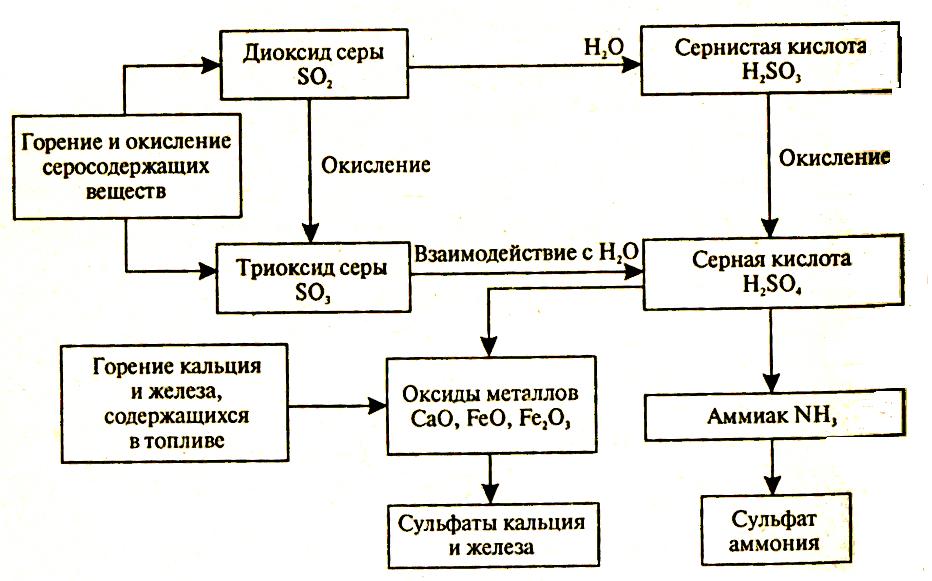
Рисунок 2.9 – Химические превращения диоксида серы в атмосфере
Над промышленными районами серная кислота в дожде образуется по другим механизмам – каталитическому и цепному.
Катализатором окисления SO32- в SO42- являются ионы Fe2+, а ионы Mn2+ ещё и усиливают этот процесс. Причём, эти катализаторы настолько активны, что роль радикалов •OH становится малозначимой.
Каталитический процесс протекает следующим образом:
Fe2+ + •OH → •Fe(OH)2+
•Fe(OH)2+ + •НSO3- → Fe2+ + •SO3- + Н2О
•SO3- + O2 → •SO5-
•SO5- + Fe2+ + Н2О → •Fe(OH)2+ + НSO5-
НSO5- + Н2О → НSO4- + Н2О2.
Ион-радикал •SO5-, в свою очередь, начинает цепную реакцию:
•SO5- + •НSO3- → НSO5- + •SO3-
•SO3- + О2 → •SO5-
•SO5- + НSO3- → НSO5- + •SO3-
НSO5- + Н2О ↔ НSO4- +Н2О2.
Получается сочетание каталитического и цепного процессов – цепно-каталитическая реакция.
Кроме того, над океаном окисление происходит в основном днём, когда высока концентрация в воздухе радикалов •OH.
Над промышленными районами каталитическое окисление SO2 идет с одинаковой скоростью и днём, и ночью.
Образование азотной и азотистой кислот, которые также содержатся в дожде, гораздо проще. В атмосфере имеются, как правило, все оксиды азота, три из которых (N2О3, NО2, N2О5) являются кислотными и при взаимодействии с атмосферной влагой образуют соответствующие кислоты.
