
- •Методичні вказівки
- •«Характерні реакції катіонів і аніонів»
- •«Методи виявлення і ідентифікації(якісний аналіз)»
- •6.040106 “Екологія, охорона навколишнього середовища та збалансоване природокористування ”,
- •6.051401 „Біотехнологія»,
- •6.051302 “Хімічна технологія та інженерія»
- •1.Загальні положення
- •2. Правила безпеки при виконанні лабораторних робоіт
- •3.Правила пожежної безпеки
- •4. Основні положення якісного аналізу
- •5. Лабораторні роботи
- •5.1. Лабораторна робота №1
- •5.1.2. Реакції катіону амонію .
- •5.2. Лабораторна робота № 2.
- •5.3. Лабораторна робота № 3.
- •5.4.Лабораторна робота № 4.
- •5.5. Лабораторна робота № 5.
- •5.6.Лабораторна робота № 6.
- •Сумарне рівняння має вигляд:
- •Виконання. До 4-5 крапель розчину солі купруму додати 3-4 краплі k4[Fe(cn)6]. Перевірити розчинність осаду в hno3, nh4oh(конц.).
- •Виконання. До 4-5 крапель розчину солі кадмію додати 3-4 краплі k4[Fe(cn)6]. Перевірити розчинність осаду в hno3, nh4oh(конц.).
- •Виконання. До 4-5 крапель розчину солі кобальту додати 3-4 краплі k4[Fe(cn)6]. Перевірити розчинність осаду в hno3, nh4oh(конц.).
- •Виконання. До 4-5 крапель розчину солі ніколю додати 3-4 краплі k4[Fe(cn)6]. Перевірити розчинність осаду в hno3, nh4oh(конц.).
- •5.7. Лабораторна робота № 7 Реакції аніонів
- •5.7.1. Реакції сульфат-іону .
- •5.7.2. Реакції хлорид-іону
- •5.8. Лабораторна робота № 8 Аналіз невідомої речовини, розчиненої і у воді
- •6.Перелік посилань
5.4.Лабораторна робота № 4.
Реакції катіонів Cr3+, Al3+, Zn2+, Sn2+, Sn4+, As3+, As5+.
Цю групу утворюють типові амфотерні елементи Алюміній, Цинк, Хром, Станум, Арсен. З катіонів цієї групи в даних методичних вказівках розглядається тільки катіон Cr3+.
Груповим реактивом на катіони цієї групи є натрій гідроксид, або калій гідроксид, які утворюють з ними аморфні осади гідроксидів. Останні розчиняються в надлишку лугу з утворенням відповідних гідроксокомплексів. Для того, щоб можна було виявити катіони у розчині дрібним методом, додають гідроген пероксид Н2О2 для окисненя Cr3+ до CrО42-, [As(OH)4]- до [As(OH)6]-, [Sn(OH)4]2- до [Sn(OH)6]2-.
5.4.1.Реакції катіону Хрому Cr3+.
5.4.1.1. З груповий реагентом NaOH або KOH іони Cr3+ утворюють осад гідроксиду сіро-фіолетового або сіро-зеленого кольору:
![]() .
.
Гідроксид хрому (Ш) - амфотерна сполука, розчиняється в кислотах і лугах:
Cr(OH)3![]() + 3H+
+ 3H+
![]() Cr3+
+ 3H2O,
Cr3+
+ 3H2O,
Cr(OH)3 + OH- [Cr(OH)4]- + 3H2O.
Розчини гідроксокомплексів хрому мають яскраво-зелений колір.
Виконання. До 3-4 крапель розчину солі хрому Cr3+ додати 1-2 краплі 2 н розчину NaOH. Випробувати осад, що утворився, на розчинність у HNO3 і NaOH.
5.4.1.2.
Окислення
хрому (Ш) до хрому (VІ)
може бути здійснено дією різних
окислювачів, наприклад H2O2,
Br2,
KMnO4,
![]() ,
(NH4)2S2O8
і т.п. При цьому в лужному середовищі
утворяться хромат-іони
,
(NH4)2S2O8
і т.п. При цьому в лужному середовищі
утворяться хромат-іони
![]() яскраво-жовтого
кольору, а в кислому середовищі –
біхромат-іони
оранжевого кольору.
яскраво-жовтого
кольору, а в кислому середовищі –
біхромат-іони
оранжевого кольору.
а)
Окислювання
пероксидом водню H2O2
проводиться в лужному середовищі.
Оскільки в лужному середовищі хром (Ш)
знаходиться у виді хроміт-іону
![]() ,
то реакцію можна представити рівнянням:
,
то реакцію можна представити рівнянням:
2[Cr(OH)4]- + 3H2O2 + 2OH- 2CrO42- + 8H2O.
Виконання. До 2-3 крапель солі хрому (Ш) додати стільки крапель 2н розчину NaOH, щоб осад гідроксиду Cr(OH)3, що спочатку утворився, розчинився. Потім додати 6-8 крапель 3%-го розчину H2O2 і нагріти до переходу зеленого кольору [Cr(OH)4]- у жовтий .
б) Окиснення персульфатом амонію (NH4)2S2O8 проводиться в кислому середовищі в присутності каталізатору AgNO3:
![]()
1
![]()
3 ![]()
Виконання.
У пробірку внести кілька кристалів
(NH4)2S2O8
або 5-6 краплин його концентрованого
розчину, 2 краплі AgNO3
(каталізатор), 2-3 краплі 2 н розчину HNO3.
Додати 4-5 краплин розчину солі хрому
Cr(NO3)3
або Cr2(SO4)3
(але не
![]() ,
тому що іон
заважає реакції) і обережно прокип'ятити
до появи оранжевого кольору розчину.
,
тому що іон
заважає реакції) і обережно прокип'ятити
до появи оранжевого кольору розчину.
5.4.1.3. З трилоном Б (двунатрієва сіль етилендіамінтетрауксусної кислоти, комплексон Ш) у присутності ацетатного буферного розчину (рН 5-6) іони Cr3+ утворюють внутрікомплексну сполуку бузкового кольору:
CH2COONa CH2COO
N



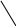
 CH2COOH N CH2COO
CH2COOH N CH2COO
C
+Cr(NO3)3
Cr+2HNO3+NaNO3
 H2 CH2
H2 CH2
C H2 CH2
H2 CH2
N
 CH2COOH N CH2COO
CH2COOH N CH2COO
CH2COONa CH2COONa
Виконання. До 3 крапель розчину солі хрому додати 5-8 крапель розчину CH3COOH, 10-15 крапель насиченого розчину CH3COONa і 7-8 краплин трилону Б. Обережно прокип'ятити отриману суміш до появи бузкового кольору.
