
- •Передмова
- •Частина 1. Молекулярні основи спадковості
- •Введення в молекулярну біологію.
- •1.2. Макромолекули як обьекты вивчення молекулярної біології
- •1.2.2. Будова, функції і властивості днк.
- •Молекулярна організація генів.
- •Рнк і її роль в збереженні і реалізації спадкової інформації.
- •Лікарські засоби, що впливають на синтез нуклеїнових кислот і білків.
- •1.3. Експресія генів і її регуляція
- •1.4. Організація геномів неклітинних і клітинних організмів
- •Геном бактерій
- •Організація генома эукариот.
- •Частина 2. Молекулярні основи спадкових захворювань
- •2.1. Молекулярні механізми генних, хромосомних і геномів мутацій
- •2.2. Регуляція клітинного циклу. Апоптоз. Онкогенетика.
- •Частина 3. Сучасні питання генних технологій
- •3.1 Дослідження нуклеїнових кислот. Методи днк-діагностики
- •3.2 Методи генної інженерії
- •3.3 Клонування організмів і кліток.
- •Додатки контрольно-повчальні питання
- •Відповіді на контрольному – повчальні питання
- •Термінологічний словник
- •Література
1.4. Організація геномів неклітинних і клітинних організмів
Геноміка. Організація геномів неклітинних організмів і прокариотов. Організація генома вірусів. Поняття про лизогенном і літичному циклах вірусів. Особливості генома і життєвого циклу ретровірусів. Геном бактерій. Плазміди.
Організація генома эукариотов. Сучасні уявлення про геном людини. Унікальна ДНК, що умеренно- і багатоповторюється . Гени, що кодують поліпептиди, РНК. Мультігенниє сімейства. Суперсімейства генів і їх продукти. Псевдогени. Транспозони. Розсіяні і тандемні повтори. Міні- і ДНК мікросателіта. Внеядерная спадковість. Мітохондріальний геном.
Геноміка. Тривалий час геномом називали гаплоидный набір хромосом. Накопичення відомостей про інформаційну роль внехромосомной ДНК змінило визначення терміну «геном». В даний час він означає повний склад ДНК клітки, тобто сукупність всіх генів і міжгенних ділянок. Можна вважати, що геном — повний набір інструкцій для формування і функціонування індивіда.
Загальні принципи побудови геномів і їх структурно-функціональну організацію вивчає геномика, яка проводить секвенирование, картирование і ідентифікацію функцій генів і внегенных елементів. Методи геномики направлені на розшифровку нових закономірностей біологічних систем і процесів. Геноміка людини є основою молекулярної медицини і має найважливіше значення для розробки методів діагностики, лікування і профілактики спадкових і неспадкових хвороб. Для медицини першорядне значення мають дослідження в області геномики патогенних мікроорганізмів, оскільки вони проливають світло на природу інфекційного процесу і створення ліків, направлених на специфічні мішені бактерій.
Геноміка, не дивлячись на її «молодий вік», підрозділяється на декілька майже самостійних напрямів: структурну, функціональну, порівняльну, еволюційну, медичну геномику, фармакогеномику і ін.
Структурна геномика вивчає послідовність нуклеотидов в геномах, визначає межі і будову генів, міжгенних ділянок і інших структурних генетичних елементів (промоторов, энхансеров і так далі), тобто складає генетичні, фізичні і транскриптные карти організму.
Функціональна геномика. Дослідження в області функціональної геномики направлені на ідентифікацію функцій кожного гена і ділянки генома, їх взаємодію в клітинній системі. Очевидно, це здійснюватиметься шляхом вивчення білкових ансамблів в різних клітках. Цю область досліджень називають протеомикой.
Порівняльна геномика вивчає схожість і відмінність в організації геномів різних організмів з метою з'ясування загальних закономірностей їх будови і функціонування.
Еволюційна геномика пояснює шляхи еволюції геномів, походження генетичного поліморфізму і біорізноманітності, роль горизонтального перенесення генів. Еволюційний підхід до вивчення генома людини дозволяє простежити за тривалістю формування комплексів генів, окремих хромосом, стабільністю його частин, недавно виявленими елементами «непостійності» генома, процесом расообразования, еволюцією спадкової патології.
Медична геномика вирішує прикладні питання клінічної і профілактичної медицини на основі знання геномів людини і патогенних організмів (наприклад, діагностика спадкових хвороб, генотерапия, причини вірулентності хвороботворних мікроорганізмів і так далі). Всі кроки еволюції живої природи, поза сумнівом, повинні були закріплюватися в інформаційній системі ДНК (а для деяких істот — в РНК), а також в організації її в клітці для виконання консервативної функції збереження спадковості і протилежної функції — підтримки мінливості. Таке уявлення про формування генома кожного виду найбільш обгрунтовано. Стосовно генома людини можна сказати, що еволюція людини — це еволюція генома. Таке уявлення підтверджується тепер численними молекулярно-генетичними дослідженнями, оскільки стало можливим зіставлення геномів різних видів ссавців, зокрема людиноподібних мавп, а також в межах виду Homo sapiens геномів різних рас, етносів, популяцій людини і окремих індивідів.
Фармакогеноміка. У другій половині 50-х років ХХ сторіччя було встановлено, що індивідуальна вариабельность реакції організму на дію лікарських засобів може бути обумовлена генетичними чинниками. Тоді ж було сформульовано і поняття про фармакогенетике як про науку, що вивчає вплив генетичних чинників на особливості реакції організму у відповідь на медикаментозну дію. Відомо, що один і той же ген у різних людей може бути представлений різними варіантами (аллелями). Генетичний поліморфізм має місце в тих випадках, коли носії кожного з аллелей складають не менше 1–2% людської популяції. Останніми роками накопичилася велика кількість даних про гени, які кодують синтез білкових молекул, що роблять вплив на процеси всмоктування, розподілу, метаболізму і виведення лікарських засобів. У зв'язку з поліморфізмом таких генів у деяких пацієнтів лікарські препарати можуть бути неефективними або надавати виражену токсичну дію. Відомо, наприклад, що в нормі у різних груп досліджуваних людей швидкість елімінації ліків з організму може відрізнятися в 4–40 разів. З урахуванням поліморфної експресії ферментів системи цитохрома Р450 (CYP2D6, CYP2C9 і CYP2C19) людську популяцію можна розділити на дві групи: «поволі» і «швидко» метаболизирующих деякі лікарські речовини. При цьому швидкість метаболізму ліків у представників різних груп може відрізнятися в 10–100 разів. Відповідно можливий розвиток побічних реакцій у відповідь на прийом лікарських препаратів в звичайних дозах. Так, за даними Американської медичної асоціації в США в 1994 р. розвиток побічних реакцій з'явився причиною госпіталізації 2 млн. чоловік і більше 100 тис. випадків смерті. Останніми роками побічні реакції на прийом лікарських препаратів займають 4–6-е місце серед причин смерті в США. Більшість з них обумовлена поліморфізмом генів, що детермінують метаболізм лікарських засобів.
До теперішнього часу лікарські препарати розробляли і призначали на основі «популяції», без урахування індивідуальних особливостей реакції організму. В середньому 10–40% людей не реагують на фармакотерапию. Протягом десятиліть фармакогенетические дослідження носили академічний характер і були в основному направлені на біохімічне вивчення поліморфізму ферментів, метаболизирующих лікарські речовини. Це було обумовлено відсутністю методів, що дозволяють використовувати дані фармакогенетических досліджень для розробки лікарських препаратів у фармацевтичній промисловості і застосування в клінічній практиці. Реалізація Проекту людського генома сприяла швидкому вдосконаленню нових технологій геномів, супроводжувалася накопиченням великої кількості генетичної інформації, створенням різних баз даних (зокрема генетичного типирования населення або груп пацієнтів з певними захворюваннями) і розвитком засобів біоінформатики для їх аналізу. Якісний стрибок в розвитку методів ідентифікації і аналізу генів, зокрема різних захворювань, що обумовлюють розвиток, або що визначають особливості реакції організму на лікарські речовини, сприяв розвитку фармакогеномики. Виявлення генів, що детермінують реакції на фармакологічні засоби, дозволяє розробити прогностичні тести, які дають можливість визначити ще до початку проведення медикаментозного лікування вірогідність розвитку побічної реакції у конкретного пацієнта. Переваги застосування таких тестів очевидні. По-перше, лікування стане ефективнішим, оскільки пацієнтові відразу призначатимуть саме «його» лікарський препарат. По-друге, вибір оптимального методу фармакотерапии на найранішому етапі лікування і зниження вірогідності розвитку побічних реакцій сприятимуть чіткішому дотриманню режиму лікування пацієнтом і скороченню медичних витрат. По-третє, ідентифікація генетичних чинників вариабельности реакції організму на лікарські засоби допоможе розробляти нові, ефективніші лікарські препарати.
Сьогодні в багатьох країнах світу приймаються заходи по обмеженню витрат на медикаментозне лікування. В той же час крупні фармацевтичні компанії розробляють менше нових активних з'єднань, чим це необхідно для збереження 10% темпу зростання об'ємів виробництва, що забезпечує нормальний розвиток фармацевтичних підприємств. Дефіцит інновацій привів до того, що якщо витрати на наукові дослідження і розробки в 70-х роках складали 11–12% від об'єму продажів фармацевтичній продукції, то в 1994–1999 рр. 19–21%. Одночасно зростають витрати на дослідження і розробку лікарських препаратів, зокрема на проведення клінічних випробувань. Відомо також, що близько 90% потенційних лікарських препаратів «відсіваються» на етапі проведення клінічних випробувань. В більшості випадків це пов'язано з недостатньою ефективністю або безпекою досліджуваних речовин. Таким чином, фармацевтична промисловість потребує корінної зміни методів пошуку і розробки нових лікарських засобів.
Фармакогеноміка допоможе вирішити ці завдання, оскільки сприятиме виявленню оптимальних «мішеней» для фармакологічної дії, відсіву неперспективних з'єднань на доклінічних етапах їх розробки, цілеспрямованому відбору груп пацієнтів для проведення клінічних випробувань. В той же час створення лікарських препаратів для лікування окремих груп пацієнтів приведе до більшої фрагментації ринку.
Недавно віце-президент компанії «Glaxo Wellcome» А. Роузес в одному з інтерв'ю відмітив, що коли хворий йде до лікаря, його цікавлять тільки 4 речі: діагноз повинен бути точний в 100% випадків, ефективність лікарського засобу 100%, побічні ефекти — 0% і все це повинно надаватися безкоштовно. «Ми працюватимемо над першими трьома проблемами», — відзначив він. Враховуючи ці потреби, біотехнологічні компанії почали пропонувати послуги в проведенні досліджень по фармакогеномике. Деякі компанії створюють бази даних медичної інформації і даних генотипирования хворих з певною патологією. Компанії, що мають бази геномів даних, об'єднують їх з даними по фармакогеномике і пропонують крупним фармацевтичним компаніям співпрацю в розробці нових лікарських засобів і оптимізації застосування вже використовуваних препаратів. Крім того, вони розробляють діагностичні тести для експериментального і клінічного застосування.
Сьогодні широко обговорюються можливості розробки тестів, що дозволяють одночасно визначати весь «генетичний профіль» пацієнта. Проте поки такі тести не розроблені. В найближчому майбутньому, очевидно, застосовуватимуть фармакогеномные тести, завдяки яким з'явиться можливість визначити вірогідність виникнення побічних реакцій, що розвиваються в результаті застосування конкретного лікарського препарату або групи лікарських засобів, які метаболизируются в організмі аналогічним чином. Проте для практичного застосування в клінічних цілях необхідно, щоб такі тести відповідали ряду вимог. Вони повинні бути відносно недорогими і попереджати про можливість розвитку виражених побічних реакцій на препарат, який застосовують для лікування достатньо великої кількості хворих. Вони повинні бути точними, відсоток ложноположительных або негативних результатів повинен бути мінімальним. Необхідно, щоб вони були автоматизованими і достатньо простими в застосуванні, щоб їх могли виконувати в звичайних клінічних лабораторіях. Для розробки діагностичного тесту необхідно ідентифікувати відповідний ген, що детермінує реакцію організму на дію лікарського засобу. Потім слід провести клінічні дослідження за участю репрезентативних груп пацієнтів, щоб визначити, які послідовності ДНК дозволяють передбачити реакцію організму на дані ліки. Після чого необхідно розробити тест, який можна буде використовувати в умовах клінічних лабораторій.
У міру відкриття нових генів і з'ясування їх властивостей можлива розробка і таких тестів, які одночасно визначатимуть реакцію організму на самі різні лікарські препарати. Наприклад, в майбутньому можна використовувати ДНК-чіп, на якій будуть розташовані послідовності всіх відомих генів, що визначають типи реакції на різні лікарські засоби.
Використання фармакогеномики на практиці. По оцінках фахівців нові лікарські препарати, при застосуванні яких в клініці враховуватимуть індивідуальні реакції організму пацієнта, можуть з'явитися через 3 — 5 років. Але спочатку дані фармакогеномики будуть використані для підвищення терапевтичної ефективності і зниження риски розвитку побічних реакцій відносно тих лікарських препаратів, які вже використовують в клінічній практиці. За кордоном фармакогеномика є перспективним напрямом в області біотехнології. У 1996 р. такого поняття просто не існувало. Сьогодні ж міжнародні зустрічі по фармакогеномике проходять щомісячно, щонеділі з'являються статті в пресі.
Відомо, що через свої природжені генетичні відмінності люди по-різному реагують на одні і ті ж медичні препарати. Багато побічних ефектів можуть залежати саме від генетичних особливостей індивідуумів. Отже, знаючи, які гени відповідають за чинники, що викликають як позитивні, так і негативні наслідки, можна сказати, як даний організм реагуватиме на ліки.
Завданням фармакогеномики є розробка спеціальних тестів, за допомогою яких можна визначити, чи підходить те або інші ліки певному індивідуумові чи ні. У основі подібних тестів лежать нові технології, які з високою швидкістю дозволяють визначати точну нуклеотидную послідовність ДНК (сиквенирование). Окрім них фармакогеномика використовує так звані карти генотипу людини, за допомогою яких можна порівнювати дві групи індивідуумів (наприклад, в першій групі певний препарат викликає побічний ефект, в другій групі цей ефект відсутній). В цьому випадку, порівнюючи карти генотипу людини, можна з'ясувати, який ген приводить до появи даного побічного ефекту.
Розробка подібних тестів є одному з головних короткострокових завдань фармакогеномики. При цьому тести повинні бути надійними, простими у використанні.
Введення подібних тестів може привести до зниження вартості лікування, оскільки хворий з їх допомогою зможе вибрати собі оптимальні ліки, замість того щоб приймати безліч препаратів, перш ніж зупинитися на одному – найбільш відповідному. В найближчому майбутньому найбільші зусилля учених будуть направлені на розробку тестів для дорогих препаратів.
Існує також надія включити в один тест всю послідовність генів для однієї людини. Витрати провідних фармацевтичних компаній на дослідження в області геномики збільшилися з 10 до 20% від засобів, виділених на розробку і дослідження нових ліків, і найбільш ефективні препарати в майбутньому будуть створені саме на основі фармакогеномики. З її допомогою виробники ЛС зможуть краще прогнозувати можливі побічні ефекти препарату, планувати клінічні випробування.
Зараз на стадії розробки з використанням досягнень геномики знаходиться більше 100 препаратів. Серед них засоби для лікування серцево-судинних, інфекційних і онкологічних захворювань.
Організація геномів неклітинних організмів і прокариотов. Один структурний ген в середньому складається з 1500 н.п.. Найменші вірусні геноми складаються з 3 генів (3600н.п. - фаг f2.).
Геном прокариот містить мінімум 468 генів (паразитична мікоплазма).
Мінімальна величина генома эукариот характерна для дріжджових грибів. Вона еквівалентна 10 000 генам.
У людини (3.5х109 н.п.) кількість ДНК достатня для освіти 1.5 млн. генів.
Приведені дані показують, що еволюція організмів пов'язана з прогресивним збільшенням кількості ДНК.
Організація генома вірусів. При вивченні природи гена дуже широко використовуються віруси. Як відомо, вони відносяться до облігатних внутріклітинних паразитів. Проте характерною особливістю вірусів, що відрізняє їх від інших внутріклітинних паразитів (наприклад, бактерій), є те, що вони паразитують на генетичному рівні. Вони підпорядковують собі синтезуючий апарат клітки, в яку вони упровадилися, заміщаючи своїми власними генами гени господаря, внаслідок чого замість синтезу продуктів власних генів клітинні механізми починають синтезувати продукти вірусних генів.
Віруси були відкриті в 1892г Д.І.Івановським, а в 1917г Д’ерелль відкрив бактеріофаги – віруси бактерій (близько 4500 фагов відомо на сьогоднішній день). Краще всього вивчені бактеріофаги кишкової палички – фаги Т-группы (7 штамів).
У 50-х роках 20-го століття вдалося провести хімічний аналіз високоочищених Т-четных фагов, який дав несподівані результати.
По-перше, було встановлено, що ДНК Т-четных фагов, на відміну від всіх інших відомих у той час типів ДНК не містить цитозина. Вона містить його аналог – 5-оксиметилцитозин (ОМ-С), т.ч. нуклеотидные пари у фага – А =Т і Г=[ОМ-С]. Цей фаг має двухцепочечную ДНК.
По-друге, ДНК Т-фага містить глюкозу, приєднану до деяких з оксиметильных груп ОМ-С.
Серед фагов найменша молекула ДНК у фага Х174. Це теж паразит Е.coli. ДНК цього фага складається з 5000 нуклеотидов: А=25%, Т=33%, Г=24%, Ц=18%. Різний зміст азотистих підстав показує, що вони не можуть утворювати пари, а значить, ДНК не має двухцепочечной конфігурації. Вона складається з одного ланцюга і має форму кільця.
Геном цього вірусу містить всього 10 генів. Причому три гени знаходяться в межах інших генів, тобто ці гени перекриваються (рис.25).

Ріс.25. Кільцева ДНК фага Х174
Цей феномен (перекриття генів) згодом був виявлений і у інших бактеріофагів Е.coli. Так, у ряду РНК-бактериофагов (R17, MS2, QB) були відомі всього три гени: репликазы, білка оболонки і дозрівання вірусної частинки. Проте після виявлення мутації, блокуючої лізис зараженої клітки, виявлений ген, для якого вже не залишалося місця на РНК фактериофага.
Проте, виявили білок L розміром в 75 амінокислот, кодований цим геном. Виявилось, що перший ген локалізований частиною в гені білка оболонки (47 підстав), частиною в міжгенному інтервалі (36 підстав) і частиною в гені Рнк-реплікази (142 підстави).
Перекриття генів - нерідке явище у вірусів і транспозонов, але це не означає, що код може бути таким, що перекривається. У кожному з генів, що перекриваються, триплети всі також прочитуються з фіксованої крапки, а кожен нуклеотид належить одному кодону.
5’ 3’
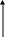


ген ген ген
білка дозрівання білка капсули репликазы
Ріс.26. Геном бактеріофага f2
У 1961г. Леб і Циндер дуже ретельно досліджували бактеріофаг Е.coli – f2 (рис.26). Виявилось, він містить одноцепочечную молекулу РНК (3600н.). Коли РНК цього фага проникає в клітку, то через 50 хвилин (латентний період) відбувається її лізис і вивільняється від 1000 до 10000 інфекційних частинок потомства.
У проміжках між генами даного фага розташовані не трансльовані ділянки.
Типи вірусних геномів
РНК-геномы
Одноцепочечная нефрагментована РНК, що володіє матричною активністю (позитивна, або +РНК). Вірус поліомієліту і інші пикорнавирусы.
Одноцепочечная нефрагментована РНК, що не володіє матричною активністю (негативна, або eРНК). Віріон має в своєму складі фермент РНК-зависимую РНК-полімеразу, звану транскриптазой. Вона синтезує на вирионной РНК матричну РНК, необхідну для трансляції вирусспецифических білків. Параміксовіруси, рабдовирусы і ін.
Одноцепочечная фрагментована РНК, що не володіє матричною активністю (негативна РНК); віріон має транскриптазу. Ортоміксовіруси (РНК віріона складається з 8 фрагментів).
Двухцепочечная фрагментована РНК; віріон має транскриптазу. Реовіруси (10 фрагментів).
Віруси, геном яких представлений двома ідентичними нитками позитивної РНК (диплоидный геном). Віріони мають фермент зворотну транскриптазу. Ретровіруси.
Одноцепочечная кільцева РНК. Такий геном має тільки один вірус. Вірус дельта-гепатита. Це дефектний вірус, для розмноження його необхідний вірус-помічник (вірус гепатиту В).
ДНК-геном
Одноцепочечная лінійна ДНК. Парвовіруси: «+» і «e» нитки знаходяться в різних віріонах, але транскрибируется тільки «e» нитка.
Одноцепочечная кільцева ДНК. Фаги М13, 0Х174.
Двухцепочечная лінійна ДНК. Віруси герпесу та інші; рання мРНК синтезується в ядрі клітинним ферментом.
Двухцепочечная кільцева ДНК. Паповавіруси, вірус гепатиту В та інші; рання мРНК синтезується в ядрі клітинним ферментом.
Двухцепочечная ДНК з ковалентно зв'язаним термінальним гидрофобным білком. Аденовіруси; рання мРНК синтезується клітинним ферментом в ядрі.
Двухцепочечная ДНК, замкнута на кожному кінці ковалентной зв'язком. Вірус віспи; розмноження відбувається в цитоплазмі, рання мРНК синтезується вірусним ферментом.
Взаємодія вірусу з кліткою господаря (життєві цикли). Взаємодія вірусу з кліткою хозяина— це складний багатоступінчатий процес, який починається з адсорбції вірусних частинок на рецепторах клітки господаря і продовжується після їх проникнення всередину клітки. В результаті такої взаємодії розвивається або продуктивна (літична), або абортивна, або інтеграційна (лизогенная) форма клітинної інфекції. При продуктивній формі відбувається розмноження, точніше, репродукція (лат. reproduce — відтворювати) вірусу, при абортивній — її порушення на одному з етапів, при інтеграційній — інтеграція вірусної нуклеїнової кислоти в клітинний геном.
Продуктивна інфекція. Репродукція вірусів. У 50-х роках було встановлено, що розмноження, або репродукція, вірусів відбувається шляхом реплікації їх нуклеїнової кислоти і біосинтезу білків з подальшою самосборкой віріона. Цей процес відбувається в різних частинах клітки — ядрі або цитоплазмі, унаслідок чого отримав назву диз'юнктивного, тобто роз'єднаного розмноження.
Вірусна репродукція є унікальною формою виразу чужорідній (вірусною) інформації в клітках людини і тварин, комах, рослин і бактерій, яка полягає в підпорядкуванні клітинних генетичних для матриці механізмів вірусній інформації.
1-а стадія — адсорбція — характеризується прикріпленням віріона до клітинних рецепторів, гликопротеины клітинної мембрани, що містить нейраминовую кислоту, що є. Такі рецептори є у ряду кліток, зокрема еритроцитів, на яких адсорбуються багато вірусів. Для орто- і параміксовірусів специфічними рецепторами є гликолипиды, що містять сиаловую кислоту (ганглиозиды), для інших — білки або ліпіди клітинної мембрани.
Рецепторами вірусів є, так звані, прикріплювальні білки, розташовані у складі капсидов простих віріонів і суперкапсидов складних віріонів. Вони можуть мати форму ниток (фібри у аденовірусів) або шпильок (гликопротеиновые утворення на зовнішній оболонці орто- і парамиксо-, рабдо-, арено- і буньявирусов).
Перший етап адсорбції визначається неспецифічними силами міжмолекулярного тяжіння, другою — специфічною структурною гомологией або комплементарністю рецепторів чутливих кліток і вірусів.
2-а стадія — проникнення вірусу в клітку господаря — відбувається декількома шляхами.
Рецепторно-опосередкований эндоцитоз характеризується освітою в місці взаємодії віріона з клітинним рецептором облямованих бульбашок, у формуванні яких беруть участь белки-клатрины.
Віропексис. Цим шляхом в клітку проникають сложноустроенные віруси. Він полягає в злитті мембран — вірусного суперкапсида з клітинною або ядерною мембраною. Даний процес відбувається за допомогою спеціального білка злиття — F-белка, який знаходиться в суперкапсиде. В результаті виропексиса капсид опиняється в клітці господаря, а суперкапсид разом з білком вбудовується в її плазматичну мембрану (унаслідок чого клітка набуває здатності зливатися з іншими клітками, що приводить до передачі вірусу цим кліткам).
Фагоцитоз. Даним шляхом вірус проникає у фагоцитирующие клітки, що приводить до незавершеного фагоцитозу.
3-а стадія — транспорт вірусу усередині клітки. Він відбувається за допомогою внутріклітинних мембранних бульбашок, в яких вірус переноситься на рибосомы, эндоплазматическую мережа або в ядро.
4-а стадія — «роздягання» віріона — полягає в їх депротеинизации і звільненні від суперкапсида і капсида, що перешкоджають реплікації вірусної нуклеїнової кислоти. «Роздягання» віріона починається відразу ж після його прикріплення до клітинних рецепторів і продовжується в эндоцитарной вакуоли і її злитті з лизосомами за участю протеолітичних ферментів, а також в ядерних порах і околоядерном просторі при злитті з ядерною мембраною.
5-а стадія називається эклипс-фазой, яка характеризується зникненням віріона, оскільки він перестає виявлятися при електронній мікроскопії. У цю стадію починається синтез компонентів віріона, тобто його репродукція. Вона носить диз'юнктивний (роздільний) характер, оскільки компоненти віріона синтезуються в різних частинах клітки: білки на рибосомах, нуклеїнові кислоти в ядрі або цитоплазмі. Вірус використовує для цього генетичний апарат клітки, пригнічуючи необхідні їй самій синтетичні реакції.
Ця стадія починається з транскрипції і реплікації вірусного генома. Транскрипція вірусного генома двунитевых ДНК-СОДЕРЖАЩИХ вірусів відбувається, так само як і клітинного генома, по тріаді ДНК — РНК — білок. Відмінності стосуються тільки походження ферменту ДНК-ЗАВІСИМОЙ РНК-полімерази, необхідної для даного процесу. У вірусів, геном яких транскрибируется в цитоплазмі клітки господаря (наприклад, вірус віспи), є власна вирусспецифическая РНК-полімераза. Віруси, геноми яких транскрибируются в ядрі (папова- і аденовіруси, віруси герпесу), використовують клітинну РНК-полімеразу, що міститься там, II або III.
У вірусів, що РНК-содержащих, транскрипція їх генома здійснюється декількома шляхами.
Віруси з негативним геномом (минус-нитевые), до яких відносяться орто-, парамиксо- і рабдовирусы, мають в своєму складі вирусспецифическую РНК-полімеразу або транскриптазу. Вони синтезують мРНК на матриці генома РНК. Подібний фермент відсутній в нормальних клітках, але синтезується клітками, зараженими вірусами. Він знаходиться в складі як однонитевых, так і двунитевых вірусів, що РНК-содержащих.
У вірусів з позитивним геномом (плюс-нитевые), до яких відносяться пикорна-, тогавирусы і ін., функцію мРНК виконує сам геном, який транслює інформацію, що міститься в нім, на рибосомы клітки господаря.
Осібно коштує група ретровірусів, що РНК-содержащих, у складі яких є зворотна транскриптаза, або ревертаза. Унікальність цього ферменту полягає в його здатності переписувати інформацію з РНК на ДНК. Цей процес називається зворотною транскрипцією.
Як наголошувалося вище, кількість генів у вірусному геномі вельми обмежена. Тому для збільшення кількості вірусної інформації існує своєрідний механізм трансляції, що функціонує через мРНК, який передає значно більше інформації, чим записано у вірусній нуклеїновій кислоті. Це досягається різними шляхами, наприклад, при транскрипції інформації з ділянок ДНК, що переписуються, на мРНК шляхом сплайсинга (вирізування безглуздих кодонів і зшивання кінців), а також при прочитуванні антикодонами тРНК однієї і тієї ж молекули мРНК з разных нуклеотидов. При цьому утворюються нові триплети, що збільшують кількість трансльованої інформації.
Регуляція транскрипції здійснюється клітинними і вирусспецифическими механізмами. Вона полягає в послідовному прочитуванні інформації з так званих «ранніх» і «пізніх» генів. По-перше - закодована інформація для синтезу вирусспецифических ферментів транскрипції і реплікації, в других — для синтезу капсидных білків. Вірусспецифічеськая інформація транслюється на рибосомы клітки господаря, які заздалегідь звільняються від клітинних білків і збираються у вирусспецифические полісоми. Реплікація вірусних геномів полягає в синтезі молекул ДНК або РНК, які накопичуються у фондах цих нуклеїнових кислот, що використовуються при збірці віріонів.
Реплікація вірусної ДНК відбувається на обох нитках за участю клітинної ДНК-полимеразы. У однонитевых вірусів спочатку утворюється друга нитка (репликативная форма).
Реплікація вірусних РНК відбувається тільки за участю того ж вирусспецифического ферменту, який каталізує транскрипцію вірусного генома. У плюс- нитевых вірусів реплікація РНК практично не відрізняється від їх транскрипції. У минус- нитевых вірусів реплікація відрізняється від транскрипції довжиною дочірніх молекул РНК, що утворилися. При реплікації вони повністю відповідають по своїй протяжності материнської нитки, а при транскрипції утворюються укорочені молекули иРНК.
У ретровірусів реплікація, так само як і транскрипція ДНК, відбувається у складі клітинного генома за участю клітинної ДНК-полимеразы.
6-а стадія — збірка віріона — полягає, перш за все, в утворенні нуклеокапсидов. Оскільки синтез вірусних нуклеїнових кислот і білків в клітці відбувається в разных її структурах, необхідне транспортування складових частин віріона в одне місце збірки. При цьому вірусні білки і нуклеїнові кислоти володіють здатністю дізнаватися і мимоволі з'єднуватися один з одним. У основі самосборки простих віріонів лежить здатність вірусних поліпептидів з'єднуватися в капсомеры, які, розташовуючись навколо осей симетрії, утворюють многогранник. У інших випадках поліпептиди у вигляді спіралі оточують вірусну нуклеїнову кислоту.
Багато простих віріонів збираються на репликативных комплексах — мембранах эндоплазматического ретикулума. У складних віріонів збірка нуклеокапсида починається на репликативных комплексах, а потім продовжується на плазматичній мембрані, із зовнішнього боку якої розташовуються суперкапсидные гликопротеиды. Потім гликопротеидные і що примикають до них з іншого боку нуклеокапсидные ділянки випинаються через клітинну мембрану, утворюючи нирку, як це має місце у орто- і параміксовірусів, рабдовирусов. Після відділення нирки, нуклеокапсид, що містить, і суперкапсидные білки, утворюються вільні віріони. Вони або через клітинну плазматичну мембрану проходять в позаклітинний простір, або через мембрану эндоплазматического ретикулума проникають у вакуоль эндоплазматической мережі. При цьому мембранні ліпіди обволікають нирку, витісняючи з неї білки. Багато ДНК-СОДЕРЖАЩИЕ віруси, наприклад вірус герпесу, збираються в ядрі клітки на її мембрані, де утворюються нуклеокапсиды. Потім вони відгалужуються в перинуклеарний простір, набуваючи зовнішньої оболонки. Подальше формування віріона відбувається в мембранах цитоплазми ретикулума і в апараті Гольджі, звідки вірус транспортується на поверхню клітки.
7-а стадія — вихід вірусних частинок з клітки — відбувається двома шляхами. Прості віруси, позбавлені суперкапсида, наприклад пикорнавирусы, аденовіруси і ін., викликають деструкцію клітки і потрапляють в позаклітинний простір. Інші віруси, липопротеидную, що мають, зовнішню оболонку, виходять з клітки шляхом брунькування, внаслідок чого протягом тривалого часу вона зберігає свою життєздатність. Такий шлях характерний для вірусу грипу і ін.
Інтеграційна інфекція. Інтеграція (вбудовування) вірусної нуклеїнової кислоти в клітинний геном. Даний шлях взаємодії між вірусом і кліткою господаря не однаковий для вірусів, що ДНК- і РНК-содержащих. У першому випадку вірусна ДНК в кільцевій формі інтегрує в клітинний геном. При цьому місце інтеграції визначається гомологичными нуклеотидными послідовностями, наявними в певних ділянках, — ДНК сайтах за участю ряду ферментів: рестриктаз, эндонуклеаз, лигаз. Вірус, інтегрований в клітинний геном, називають провирусом.
Провірус може реплицироваться у складі клітинного генома пропорційно діленню клітки. При цьому кожна дочірня клітка отримує копію провірусного генома. У іншому випадку ампліфікація провірусної ДНК із збільшенням числа копій провируса без його выщепления з клітинного генома може привести до вбудовування провируса в іншу хромосому. Вищепленіє провируса з клітинного генома і його проникнення в нову клітку може викликати продуктивну інфекцію.
У разі вірусів, що РНК-содержащих, включення РНК в клітинний геном відбувається шляхом зворотної транскрипції. Механізм зворотної транскрипції полягає в первинному утворенні ДНК-ТРАНСЬКРІПТА на матриці РНК при обов'язковій участі зворотної транскриптазы. Цей транскрипт є однією ниткою ДНК, що є матрицею для утворення другої нитки. Що потім утворився двунитевой ДНК-ТРАНСЬКРІПТ замикається в кільце і вбудовується в клітинний геном. Даний процес об'єднання вірусної нуклеїнової кислоти з хромосомою клітки господаря називається вирогенией. У інтегрованому стані вірусна ДНК може транскрибироваться у складі клітинного генома за участю клітинних РНК-полімераз.
Біологічний сенс інтеграційного типу взаємодії між вірусом і кліткою господаря можна бачити, перш за все, в збереженні вірусної інформації у складі клітинного генома і її передачі потомству. Разом з тим це певною мірою відбивається і на еволюції деяких вірусів (наприклад, бактеріофагів), які при выщеплении з складу клітинної хромосоми можуть захоплювати окремі її гени.
З іншого боку, подібний тип взаємодії може позначитися на долі кліток господаря залежно від розташування локуса, в якому відбувається інтеграція вірусного генома, аж до розладу регуляції синтезу білка і неконтрольованого ділення клітки. Це може привести до онкогенної трансформації кліток господаря і розвитку різноманітних пухлин.
Особливості генома і життєвого циклу ретровірусів. Ретровіруси - обширне сімейство вірусів, виділених від ссавців і людини. Назва пов'язана з ферментом зворотною транскриптазой, який міститься у складі віріонів і є каталізатором зворотної транскрипції. Ретровіруси мають диплоидный геном, представлений двома ідентичними копіями однонитевой РНК, сполученими на одному з кінців водневими зв'язками. З вірусним геномом асоційована вирусспецифическая зворотна транскриптаза, необхідна для утворення ДНК- провируса, що інтегрується в клітинний геном. Вихід зрілих віріонів з клітки відбувається шляхом брунькування від зовнішньої клітинної мембрани.
Сімейство ретровірусів включає три підродини: спумавирусы (непатогенні віруси ссавців і людини), лентивирусы (збудники повільних смертельних інфекцій ссавців і людини), онковирусы (збудники Т-клеточного лейкозу людини, а також лейкозу-саркоми птахів і ссавців).
До лентивирусам відноситься вірус імунодефіциту людини (ВІЧ). Синдром придбаного імунодефіциту був вперше виділений як особливе захворювання в 1981 р. в США у зв'язку з виявленням у ряду молодих людей важких захворювань, збудниками яких були такі мікроорганізми, які для здорових людей є або непатогенними, або слабопатогенными. Дослідження імунологічного статусу таких хворих виявило у них різке зменшення кількості лімфоцитів взагалі і Т-хелперов особливо. Це багатство отримала назва AIDS (від англ. Acquired Immune Deficiency Syndrome — синдром придбаного імунодефіциту, або СНІД).
Спосіб зараження (статевий контакт, через кров і її препарати) указував на інфекційний характер захворювання.
Збудник СНІДУ був відкритий в 1983 р. незалежно один від одного двома ученими — французом Л. Монтанье, який назвав його LAV (Lymphoadenopathy Associated Virus), оскільки він виявив його у хворого лимфоаденопатией, і американцем Р. Галло, який назвав його HTLV-III (від англ. Human T-lymphotropic Virus III — Т-лімфотропний вірус людини III), оскільки раніше їм були виявлені лимфотропные віруси I і П. Сопоставленіє властивостей вірусів LAV і HTLV-III показало їх ідентичність, тому щоб уникнути плутанини вірус отримав в 1986 р. назву HIV (від англ. Human Immunodeficiency Virus — вірус імунодефіциту людини, або ВІЧ).
ВІЧ кулястої форми, його діаметр близько 100 нм. Оболонка вірусу має форму многогранника, складеного з 12 п'ятикутників і 20 шестикутників. У центрі і кутах кожного шестикутника розташована молекула гликозилированного протеїну gpl20 (цифра 120 означає молекулярну масу білка в килодальтонах). Всього на поверхні віріона розташовується у вигляді своєрідних шпильок 80 молекул gpl20, кожна з яких пов'язана з внутрішньомембранним білком gp41. Ці білки разом з подвійним ліпідним шаром утворюють суперкапсид (мембрану) віріона (рис.27).
Нуклеокапсид віріона має форму усіченого циліндра, дельта-икосаэдра. Він утворений білками р24, р7 і р9. Білок р17 примикає до внутрішньої поверхні мембрани. Білки р7, р9 пов'язані з геномом РНК. У серцевині міститься геном віріона, представлений двома ідентичними молекулами РНК з 9213 нуклеотидов. Крім того, в ній містяться: одна молекула приманки РНК (тРНКлиз), одна молекула pol-комплекса (зворотна транскриптаза, РНК-аза Н і ДНК-ЗАВІСИМАЯ ДНК-полимераза), одна молекула протеазы і одна молекула интегразы (эндонуклеаза).
РНК-геном в клітці за допомогою зворотної транскриптазы перетворюється на ДНК-геном (ДНК-ПРОВІРУС), пару, що складається з 9283 нуклеотидных. Він обмежений зліва і справа так званими довгими кінцевими повторами, або LTR (від англ. long terminal repeat): 5'-LTR — зліва і З'-ltr — справа.

Ріс.27. Структура ВІЧ
LTR містить по 638 нуклеотидных пару. Геном ВІЧ складається з 9 генів, частина з яких перекривається між собою і має экзон-интронную структуру. Схематично структура генома ВІЧ виглядає так:
5'-LTR-gag- pol -vif – tat- rev- env- nef- vpu- vpr-3'-LTR.
9 генів вірусу контролюють синтез 9 структурних і 6 регуляторних білків.
Таким чином, 9 генів вірусу кодують синтез 15 білків. Це пов'язано з тим, що деякі гени мають декілька рамок прочитування і экзон-интронную структура.
Значення LTR для вірусного генома полягає в тому, що в них розташовані наступні регуляторні елементи, контролюючі його роботу:
а) сигнал транскрипції (область промотора)
б) сигнал додавання Полі-а
в) сигнал кэпирования
г) сигнал інтеграції
д) сигнал позитивної регуляції (TAR для білка ТАТ)
е) елемент негативної регуляції (NRE для білка NEF)
ж) ділянка прикріплення приманки РНК (тРНКлиз) для синтезу минус-цепи ДНК на З'-конце; сигнал на 5'-конце LTR, який служить приманкою для синтезу плюс-цепи ДНК.
Крім того, в LTR є елементи, що беруть участь в регуляції сплайсинга мРНК, упаковки молекул вРНК в капсид (елемент Psi). Нарешті, при транскрипції генома в довгих мРНК утворюється два сигнали для білка REV, які перемикають синтез білків: CAR — для регуляторних білків і CRS — для структурних білків. Якщо білок REV зв'язується з CAR, синтезуються структурні білки; якщо він відсутній, синтезуються тільки регуляторні білки.
У регуляції роботи генома вірусу особливо важливу роль грають наступні гени-регулятори і їх білки: 1) білок ТАТ, який здійснює позитивний контроль розмноження вірусу і діє через регуляторну ділянку TAR; 2) білки NEV і VPU, що здійснюють негативний контроль розмноження через ділянку NRE; 3) білок REV, що здійснює позитивно-негативний контроль. Білок REV контролює роботу генів gag, pol, env і здійснює негативну регуляцію сплайсинга. Таким чином, розмноження ВІЧ знаходиться під потрійним контролем — позитивним, негативним і позитивно-негативним.
З білком VIF пов'язана інфекційність знов синтезованих віріонів. Білки VPU і VPR беруть участь в регуляції репродукції вірусу. Реплікація відбувається за участю зворотної транскриптазы.
Спочатку на вРНК зворотна транскриптаза синтезує комплементарну їй «мінус» ланцюг ДНК, а потім на ній — «плюс» нитка ДНК. Двунітевая ДНК інтегрується в хромосому клітки і там служить матрицею для синтезу різних класів вірусних РНК. Таким чином, реплікація ретровірусів відбувається по схемі: РНК > ДНК > РНК.
Патогенез. Існує багато гіпотез про патогенез ВІЧ. В цілому можна сказати, що ВІЧ, упроваджуючись в клітки імунної системи, або руйнує їх за допомогою різних механізмів або видозмінює їх функції, ініціюючи різноспрямовані зміни в синтезі цитокинов, що, кінець кінцем, порушує всі ланки імунітету. Це є тій патологічно основою, на якій розвивається симптомокомплекс СНІДУ.
Епідеміологія. Джерелом інфекції є ВІЧ-ІНФІЦИРОВАННИЙ чоловік на всіх стадіях захворювання. Вірус міститься в крові, спермі, вагінальному і цервикальних секретах, в грудному молоці, які є чинниками передачі інфекції. Передбачається, що інфікуюча доза вірусу складає близько 10 тис. віріонів. Слина, мочивши, слізна рідина також містять вірус, але кількість його недостатньо для зараження.
Профілактика Віл-інфекції. Пандемія ВІЧ/СНІДУ продовжується, при цьому 90% з числа всіх випадків інфікування пов'язані з країнами світу, що розвивається, де по економічних причинах застосування дорогого лікування недоступне. У зв'язку з цим очевидна необхідність ефективної стратегії вакцинопрофілактики. Проте для дослідників із самого початку було очевидне, що Віл-інфекція не схожа на інші вірусні захворювання, контрольовані вакцинацією. Хронічна течія, стан вирусоносительства, інтеграція провірусної ДНК в геном клітки, зараження не тільки вільними віріонами, але і інфікованими клітками, висока мінливість вірусу, неухильний прогрес хвороби на тлі специфічної імунної відповіді, необхідність індукції Т-еффекторного відповіді при вакцинації і забезпечення імунітету слизових оболонок, відсутність лабораторних моделей — це не повний перелік проблем, які утрудняють створення вакцини.
В той же час нові дані про виявлення ВІЧ-ІНФІЦИРОВАННИХ довгожителів, а також індивідуумів, які залишаються серонегативными, не дивлячись на неодноразову експозицію ВІЧ (сімейні пари, де один з подружжя інфікований) свідчать про потенційну можливість резистентності.
До теперішнього часу на основі класичних підходів і їх комбінацій створено більше 50 препаратів, що розглядаються як потенційні «кандидати» профілактичних вакцин. Більше 20 з них (субъединичные/рекомбинантные, пептидні, живі векторні, ДНК-вакцина і вірусоподібні частинки) пройшли первинні випробування на добровольцях. Найбільш перспективним представляється підхід з первинним використанням живих векторних вакцин з подальшою ревакцинацією субодиничними вакцинами. Через відсутність єдності в думках дослідників компромісне рішення, підтримуване Програмою ООН/ВІЗ, полягає в продовженні фундаментальних досліджень для розробки нових концепцій з паралельним переходом до «польових» випробувань найбільш перспективних кандидатів. До таких в першу чергу відноситься рекомбинантная вакцина з використанням як вектор поксвірусів птахів, а також субодинична вакцина gpl20 (Vax Gen).
Іншим аспектом протидії Віл-інфекції є підхід до неї як соціально обумовленій хворобі, пов'язаній з характером поведінки людини і соціально-економічним і політичним пристроєм суспільства. На міжнародному рівні вже показана ефективність соціальних профілактичних програм, що включають широке розповсюдження знань об Віл-інфекції, навчання безпечній статевій поведінці, лікування інших хвороб, що передаються статевим шляхом (ко-факторы зараження ВІЧ), анонімне тестування і консультування, впровадження «політики зниження шкоди» серед наркоманів, організацію не тільки медичної, але і соціальної підтримки ВІЧ-ІНФІЦИРОВАННИМ і їх сім'ям, увага до проблеми на державному рівні.
Онковіруси. Існують два типи онковирусов:
1. Віруси, онкоген, що містять (віруси оnс+).
2. Віруси, онкогена, що не містять (віруси оnсe).
Віруси оnс+ можуть втрачати онкоген, але це не порушує їх нормальної життєдіяльності. Інакше кажучи, сам по собі онкоген вірусу не потрібний. Основна відмінність між вірусами оnс+ і оnсe полягає в наступній: вірус опсe, проникнувши в клітку, не викликає її трансформації в ракову або викликає украй рідко. Віруси опс+, потрапляючи в ядро клітки, трансформують її в ракову.
Отже, перетворення нормальної клітки на пухлинну відбувається унаслідок того, що онкоген, будучи привнесеним в хромосому клітки, наділяє її новою якістю, яка дозволяє їй розмножуватися в організмі безконтрольно, утворюючи клон ракових кліток. Цей механізм перетворення нормальної клітки в ракову нагадує трансдукцию бактерій, при якій помірний фаг, інтегруючись в хромосому бактерій, наділяє їх новими властивостями. Це тим більше правдоподібно, що онкогенні віруси поводяться як транспозоны — вони можуть інтегруватися в хромосому, переміщатися в ній з однієї ділянки в іншій або переходити з однієї хромосоми в іншу. Суть питання полягає в наступному: яким чином протоонкоген перетворюється на онкоген, коли він взаємодіє з вірусом? Перш за все, необхідно відзначити те важлива обставина, що у вірусів у зв'язку з високою швидкістю їх розмноження промоторы працюють з набагато більшою активністю, чим промоторы в эукариотных клітках.
Тому, коли оnсe - вірус інтегрується в хромосому клітки по сусідству з одним з протоонкогенов, він підпорядковує роботу цього гена своєму промотору. Виходячи з хромосоми, вірусний геном вихоплює з неї протоонкоген, останній стає складовою частиною вірусного генома і перетворюється на онкоген, а вірус з оnсe — в оnс+- вірус. Інтегруючись в хромосому іншої клітки, такий вже оnс+-вирус одночасно трансдуцирует в неї і онкоген зі всіма наслідками. Такий найбільш частий механізм утворення онкогенних (оnс+) вірусів і початку перетворення нормальної клітки в пухлинну.
Віроїди. У природі, крім вірусів, виявлені інші дуже дрібні загадкові інфекційні агенти з незвичайними властивостями – вироиды.
Назва «вироид» була запропонована в 1971 р. Т. Дінером. Воно свідчить про те, що симптоми захворювань, які викликають ці агенти у різних рослин, схожі на симптоми захворювань, що викликаються у них вірусами. Проте вироиды відрізняються від вірусів, принаймні, по наступних чотирьох ознаках.
1. Віроїди, на відміну від вірусів, не мають білкової оболонки і складаються тільки з інфекційної молекули РНК. Вони не володіють антигенними властивостями і тому не можуть бути виявлені серологическими методами.
2. Віроїди мають дуже малі розміри: довжина молекули РНК вироидов рівна 1 • 10-6 мм, вона складається з 300-400 нуклеотидов. Віроїди — найменші здібні до розмноження одиниці, відомі в природі.
3. Молекули вироидов є одноцепочечные кільцеві РНК. Таку кільцеву структуру має ще тільки один вірус — вірус дельта-гепатита.
4. Молекули РНК вироидов не кодують власних білків, тому їх розмноження може відбуватися або аутокаталитически, або воно залежить від клітки-господаря.
З 1971 р. виявлено більше 10 різних вироидов, що відрізняються по первинній структурі, кругу господарів, що вражаються, по симптомах захворювань, що викликаються ними. Все відомі вироиды побудовані по одному плану: 300-400 нуклеотидов утворюють кільце, яке утримується парами підстав і утворює двухцепочечную паличкоподібну структуру з переміжними короткими одно- і двухцепочечными ділянками.
Питання про природу, походженні вироидов і про те, яким способом вони розповсюджуються, залишається відкритим. Існує припущення, що вироиды утворюються з нормальних клітинних РНК, проте переконливих підтверджень цьому не було представлено.
