
- •Передмова
- •Частина 1. Молекулярні основи спадковості
- •Введення в молекулярну біологію.
- •1.2. Макромолекули як обьекты вивчення молекулярної біології
- •1.2.2. Будова, функції і властивості днк.
- •Молекулярна організація генів.
- •Рнк і її роль в збереженні і реалізації спадкової інформації.
- •Лікарські засоби, що впливають на синтез нуклеїнових кислот і білків.
- •1.3. Експресія генів і її регуляція
- •1.4. Організація геномів неклітинних і клітинних організмів
- •Геном бактерій
- •Організація генома эукариот.
- •Частина 2. Молекулярні основи спадкових захворювань
- •2.1. Молекулярні механізми генних, хромосомних і геномів мутацій
- •2.2. Регуляція клітинного циклу. Апоптоз. Онкогенетика.
- •Частина 3. Сучасні питання генних технологій
- •3.1 Дослідження нуклеїнових кислот. Методи днк-діагностики
- •3.2 Методи генної інженерії
- •3.3 Клонування організмів і кліток.
- •Додатки контрольно-повчальні питання
- •Відповіді на контрольному – повчальні питання
- •Термінологічний словник
- •Література
Частина 2. Молекулярні основи спадкових захворювань
2.1. Молекулярні механізми генних, хромосомних і геномів мутацій
Мутаційна мінливість у людини. Молекулярні механізми генних мутацій. Класифікація генних мутацій. Поняття про моногенні спадкові захворювання. Молекулярні і цитологические механізми хромосомних мутацій. Сучасні методи вивчення каріотипу людини: диференційоване фарбування, FISH-метод і ін. Класифікація мутацій по причинах виникнення. Мутагенні чинники, методи визначення мутагенної активності речовин. Антимутагенез. Генератівниє і соматичні мутації.
Мутаційна мінливість у людини. Стабільність генетичного апарату і обумовлюваний цим апаратом консерватизм спадковості — лише одна сторона спадковості. Інша її сторона, така ж невід'ємна від живого, як і перша, — мінливість. В сукупності спадковість і мінливість забезпечили і збереження життя на Землі, і безперервну біологічну еволюцію. Спадкова мінливість організму забезпечує необхідну йому пристосовність до умов існування як в межах життя одного індивіда, так і в рамках існування біологічного вигляду в цілому. Спадкове різноманіття людини — результат тривалої еволюції живої матерії. При цьому треба мати на увазі особливості еволюції людини як біологічної і соціальної істоти. У людини як соціальної істоти природний відбір з часом протікав все в більш специфічних формах, що, безумовно, розширювало спадкову різноманітність популяцій. Зберігалося те, що могло «відмітатися» у тварин, або, навпаки, втрачалося те, що потрібне тваринним. Наприклад, повноцінніше забезпечення себе їжею і можливість задовольняти потребу у вітаміні С дозволили людині в процесі еволюції «загубити» ген L-гулонолактоноксидазы, що каталізує у тварин синтез аскорбінової кислоти. Наявність цього гена у тварин страхує їх від розвитку цинги, а людина із-за такої «загальної природженої помилки метаболізму» схильна до авітамінозу З. В процесі еволюції людина «набувала» і небажаних ознак, що мають пряме відношення до патології людини. Більшість видів тварин несприйнятлива до дифтерійного токсину і вірусу поліомієліту, тому що у тварин відсутні компоненти мембрани кліток, що забезпечують сприйняття того або іншого патогенного чинника. У людини ці компоненти є. Гени, що їх детермінують, вже ідентифіковані. Наприклад, для сприйняття дифтерійного токсину такий ген локалізований в 5-й, для вірусу поліомієліту — в 19-ій хромосомі.
Більшість мутацій збільшує поліморфізм людських популяцій (групи крові, колір волосся, зростання, розріз очей і ін.), але іноді мутації зачіпають життєво важливі функції, а це вже приводить до хвороби. Таким чином, спадкова патологія — частина спадкової мінливості, що накопичилася за час еволюції людини. Людина, ставши біологічним видом Homo sapiens (Людина розумна), як би заплатив за «сапиентацию» свого вигляду накопиченням патологічних мутацій. На основі цих положень формулюється одна з головних концепцій медичної генетики про еволюційне накопичення патологічних мутацій в людських популяціях. Підтвердженням цієї концепції є патологічні мутації у тварин, по своїх проявах схожі із спадковими хворобами у людини (ахондроплазии. гемофілії, м'язова дистрофія і ін.), а також наявність спадкових хвороб у людей, що жили декілька тисячоліть тому (про що можна судити по знахідках патологічних скелетів в розкопках і витворах мистецтва).
Еволюція будь-якого вигляду, у тому числі і людини, кінець кінцем, зводиться до еволюції генотипу. У біологічній еволюції людини хвороба як чинник природного відбору могла грати істотну роль, а еволюція генотипу у свою чергу міняла нозологію патологічних процесів. Залежність еволюції хвороби від еволюції генотипу навряд чи може викликати сумнів. Вище були приведені конкретні форми цієї залежності (цинга, дифтерія, поліомієліт). Чинники еволюції протягом тривалого часу впливали не тільки на формування біохімічних, імунологічних, фізіологічних або морфологічних властивостей організму, але і на його патологічні реакції, обумовлюючи значно більше різноманіття нозологічних форм хвороб у людини в порівнянні з такими у тварин.
Основним джерелом різноманіття спадкових ознак і їх безперервної еволюції служить мутаційна мінливість. Здатність ДНК мутувати склалася в еволюції і закріпилася відбором, мабуть, так само, як і здатність протистояти мутаційним змінам, тобто репарировать їх. У організації ДНК закладена можливість помилок її реплікації разом з можливістю зміни первинної структури. Вірогідність «збоївши» в точності реплікації молекули ДНК невелика: вона складає 10-5—10-7. Проте, зважаючи на виняткове велике число нуклеотидов в геномі (3,2 х 109 на гаплоидный набір), слід визнати, що в сумі на геном клітки на однієї неї покоління доводиться декілька мутацій в структурних генах. На думку різних авторів, кожен індивід успадковує 2—3 нових шкідливих мутації, яка може давати летальний ефект або підхоплюватися відбором, збільшуючи генетичну різноманітність людських популяцій.
Зміна нуклеотидной послідовності молекули ДНК може відбитися на первинній (амінокислотною) структурі білка або на регуляції його синтезу. Так, великий досвід вивчення молекулярної природи мутацій гемоглобіну показує, що значна частина таких мутацій не змінює функції гемоглобіну. Такі мутації нейтральні і не піддаються відбору. Інші мутації приводять до функціональних відхилень в молекулі білка. Ці відхилення в якихось умовах життя організму можуть виявитися корисними, тобто мати адаптивне значення, тому збережуться, а іноді і умножаться в подальших поколіннях. Саме таким шляхом виникали і зберігалися в популяціях різноманітні варіанти структурних, транспортних і ферментних білків організму. Властивий організму людини широкий білковий поліморфізм, завдяки якому кожен індивід біохімічно неповторюваний, обумовлений початково мутаційною мінливістю і відбором адаптивних білкових варіантів.
Проте, якщо структурні відхилення несумісні з виконанням білком його функції, а вона життєво важлива для клітки (організму), мутація стає патологічною і надалі або виключається з популяції разом з нежиттєздатною кліткою (організмом), або зберігається, обумовлюючи спадкову хворобу. В окремих випадках гетерозиготные носії патологічної мутації піддаються позитивному відбору. Прикладом цього служить ген серповидно-клітинної анемії, який широко розповсюдився в популяціях, що проживають в ендемічних по малярії районах, унаслідок великої стійкості гетерозиготных носіїв «аномального» гена (мутанта аллеля) до малярійного плазмодія.
Різні ознаки організму по-різному стійкі до мутаційних змін, що зв'язане, мабуть, із значенням ознаки і з його еволюційним «віком». Такі ознаки, як гистоновые білки, що входять до складу хромосом, або скоротливі білки актин і тубулин, або ферментні білки реплікації і транскрипції, вельми консервативні і однакові не тільки у різних представників людства, але і у біологічних видів значної віддаленості філогенезу. Мабуть, мутації у відповідних генах детальні. Більшість білків організму, особливо ферментних, існують в декількох изоформах і схильні до таких мутаційних змін, які ведуть до патології.
Патологічні мутації різні по здатності зберігатися і розповсюджуватися в популяціях. Одні з них, що дозволяють їх носієві зберігати плодючість і що не викликають серйозних несприятливих зрушень у фенотипе, можуть передаватися з покоління в покоління тривалий час. Такі ознаки сегрегируют (розподіляються) в поколіннях згідно законам Менделя, і обумовлений ними генетичний тягар в популяціях може довго зберігатися. Деякі комбінації умовно патологічних рецесивних аллелей можуть давати селективну перевагу індивідам (виживає, плодючість). Частота таких аллелей в популяції підвищуватиметься до певного рівня у ряді поколінь, поки не наступить рівновага між інтенсивністю мутаційного процесу і відбору. Частота різних мутантів аллелей цього роду може бути неоднаковою в різних популяціях, що визначається закономірностями популяцій (ефект родоначальника, частота кровноспоріднених браків, міграція і екологічні умови). Під ефектом родоначальника мають на увазі накопичення патологічних мутацій в обмеженій популяції від одного носія хвороби групі нащадків.
Якщо знов виникла мутація має домінантний патологічний прояв і веде до летального генетичного результату (індивід не залишає потомства), то такий мутаційний вантаж не передається наступному поколінню. Це звичайно домінантні форми важких хвороб, а також велика частина хромосомних хвороб.
В цілому ефекти генетичного тягаря у людини виражені в эволюционно- генетичних явищах збалансованого поліморфізму, летальності і пониженої фертильности.
На основі постійних протікаючих процесів зміни спадковості (мутацій) і відбору генотипів при тривалій еволюції людини в популяціях сформувався збалансований поліморфізм. Під цією назвою розуміють таке явище, коли в популяції представлено дві форми аллелей одного гена або більш, причому частота рідкісного аллеля складає не менше 1%. Оскільки виникнення мутацій — рідкісна подія (1 х 10-7), то, отже, частоту мутанта аллеля в популяції більше 1% можна пояснити тільки якоюсь селективною перевагою цього аллеля для організму і поступовим накопиченням у ряді поколінь після його появи. Прикладами збалансованого поліморфізму є групи крові АВО, резус, гени муковісцидозу, фенілкетонурії, первинного гемохроматоза. Генетичне різноманіття людини засноване на збалансованому поліморфізмі, що формувався протягом десятків і сотень тисячоліть. Таке різноманіття — основа розвитку людини як біологічного вигляду. Вірогідність виникнення і фіксації в популяціях якої-небудь мутації з позитивним ефектом в еволюційно «відладженому» людському організмі існує і в даний час, але вона украй мала. Практично нові мутації завжди дають негативний ефект.
До ефектів мутаційного вантажу відноситься летальність. Вона виявляється загибеллю гамет, зигот, ембріонів, плодів, смертю дітей. Найінтенсивніше летальні ефекти виражені в людських популяціях на рівні зигот. Приблизно 60% зигот гине до імплантації, тобто до клінічно реєстрованої вагітності. Результати всіх клінічно зареєстрованих вагітностей розподіляються таким чином: спонтанні аборти — 15%, мертвонародження — 1%, живородіння — 84%. З 1000 живонароджених дітей не менше 5 вмирають у віці до року унаслідок спадкової патології, несумісної з життям. Такий об'єм летального вантажу мутаційної мінливості в популяціях людини з медичної точки зору.
Для більшості спадкових хвороб характерна понижена фертильность, обумовлена порушенням репродуктивної функції. Це веде до зменшеного відтворення потомства (і хворого, і здорового) в сім'ях із спадковою патологією.
Медичні і соціальні наслідки мутаційного процесу: соціальна дизадаптация (інвалідність) хворих, підвищена потреба в медичній допомозі і понижена тривалість життя.
Молекулярні механізми генних мутацій. Генетичний матеріал — ДНК — дуже лабилен. Він може мінятися, мутувати в результаті як зовнішніх, так і внутрішніх дій. Підсумком виникаючих змін, якщо вони відбуваються в соматичних клітках (а вони відбуваються безперервно з найпершої хвилини існування нового людського організму — зиготы — до останньої хвилини його життя), є численні хвороби, включаючи ракові пухлини і, мабуть, старіння і смерть. Якщо ж вони відбуваються в клітках статевого шляху, то виникають мутації, які можуть в процесі еволюції закріплюватися і розповсюджуватися в популяції і приводити до поліморфізму, якщо вони не відсіваються через випадкові причини або через їх шкідливу дію на життєздатність індивідуума і його потомства.
В цілому різноманітність генів залежить від швидкості мутацій, розміру і демографічної історії популяції, в якій відбуваються мутації, часу, протягом якого відбувається накопичення цих відмінностей і селекції. Ступінь різноманітності, яка може підтримуватися в популяції, прямо пропорційний її розміру. Порівняно невелика вариабельность в популяції людини (вариабельность генома шимпанзе — нашого найближчого родича — значно вище, ніж у людини) є результатом її молодого віку і походження від порівняно невеликої початкової популяції.
Шкідливі мутації постійно виникають, але швидко відсіваються з популяції. Існує баланс між знов виникаючими мутаціями і їх відсіванням селекцією. В результаті шкідливі мутації, що викликають хворобу, володіють двома властивостями: вони зустрічаються рідко, і кожна конкретна мутація, що існує в популяції, виникла недавно. Що стосується звичайного поліморфізму, то механізм його підтримки в популяції, не дивлячись на тривалу і інтенсивну дискусію із цього приводу, неясний і, можливо, проясниться, коли вдасться достатньо швидко і порівняно недорого порівнювати безліч геномів і провести кореляції між частотами певних аллелей і історіями різних популяцій.
У молекулах ДНК може відбуватися зміни послідовності нуклеотидов. Такі зміни, якщо вони зачіпають функціонально активні гени, можуть приводити до порушень метаболізму або функцій (ознак). Якщо ці зміни не приводять до загибелі організму або клітки — вони можуть передаватися по спадку. Отже, генні мутації — це стабільні зміни структури генів, реплікації, що повторюються в подальших циклах, і що виявляються у потомства у вигляді нових варіантів ознак. Всі різновиди мутацій пов'язані із зміною нуклеотидной послідовності генів.
Класифікація генних мутацій. По особливостях структурних змін можна відзначити декілька груп різноманітних мутацій:
заміна одних азотистих підстав іншими (транспозиція) (рис.33.);
зміна кількості нуклеотидных пар в структурі гена (дупликация, инсерция, делеция);
зміна порядку послідовності нуклеотидов у складі гена (інверсії);
розрив ланцюгів;
утворення зшивань.
Заміна азотистих підстав. Причинами цього роду мутацій є:
а) помилки реплікації
б) вплив певних хімічних агентів.
Під впливом хімічних агентів може відбуватися порушення структури азотистої підстави вже приєднаного нуклеотида. Наприклад, під впливом азотистої кислоти може відбуватися мимовільне дезаминирование цитозина. В результаті цього цитозин перетворюється на урацил. Надалі в циклі реплікації урацил з'єднується аденином, який в наступному циклі приєднує тимидиновый нуклеотид.
Ще однією причиною може бути помилкове включення в ланцюг ДНК нуклеотида, що утворюється, із зміненою підставою. Якщо це залишається непоміченим ферментами репарації, змінена підстава включається в процес реплікації, що може привести до заміни основної пари на іншу.

Ріс.33. Схема виникнення мутації (транспозиції) по механізму заміни однієї азотистої підстави іншим
Мутації в результаті заміни азотистих підстав виникають спочатку в одному з ланцюгів ДНК. Якщо вони не виправляються в ході репарації, то при подальших реплікаціях вони закріплюються в обох ланцюгах молекули. Наслідком цього є утворення нового триплета в генетичному коді ДНК. Це може відбитися на первинній структурі кодованого білка, його просторової організації і функції. Зміни первинної структури пептиду не відбудеться в тому випадку, якщо новий триплет є «синонімом» колишнього, тобто кодуватиме ту ж амінокислоту. Наприклад, амінокислота лейцин кодується шістьма триплетами: УУА, УУГ, ЦУУ, ЦУЦ, ЦУА, ЦУГ. Заміна одного з нуклеотидов в цих триплетах не змінить його «сенсу». Цей приклад демонструє біологічне значення надмірності генетичного коду. Проте в більшості випадків заміна однієї амінокислоти на іншу приводить до серйозних наслідків. Наприклад, заміна глутаминовой кислоти валином в молекулі гемоглобіну приводить до зміни його структури і функцій. В результаті цього у людини розвивається хвороба — серповидно-клітинна анемія. У ряді випадків заміна азотистих підстав може приводити до появи нонсенсу-кодону некодуючих амінокислот. Наслідком цього буде дострокове переривання процесу синтезу. Вважається, що заміна азотистих підстав приводять в - 25 % випадків до утворення триплетів-синонімів, в ~ 5 % випадків — до утворення нонсенс- кодонів, і в ~ 70 % — до виникнення генних мутацій.
Зміна кількості нуклеотидов в гені. Ця мутація — результат випадання (делеции) або вставки (инсерции) однієї або декількох пар нуклеотидов в молекулу ДНК (мал. 34). Такий тип мутацій зустрічається досить часто. Вказана зміна відбувається унаслідок дії на ДНК деяких хімічних агентів, а також радіоактивного опромінювання. Результатом цієї мутації є зрушення рамки прочитування інформації з генетичного коду. Наслідком цього є синтез поліпептидів із зміненою амінокислотною послідовністю, порушення структури і функцій білків, порушення фенотипа. Проте якщо кількість відновлених або втрачених нуклеотидов кратно трьом, то зрушення рамки не відбувається. В цьому випадку в білці може з'явитися зайва амінокислота або буде на одну менше. Одній з причин мутацій, що приводять до зміни кількості нуклеотидов, є вставки або делеции в результаті активності рухомих генетичних елементів. Це певні нуклеотидные послідовності, вбудовані в геноми багатьох організмів. Ці структури ДНК здатні мимоволі міняти своє положення в результаті помилок при рекомбінації.

Ріс.34. Схема зміни кількості нуклеотидов
Зміна нуклеотидной послідовності гена (інверсія). Цей тип мутації пов'язаний з поворотом певної ділянки ДНК на 180°. Такі порушення відбуваються унаслідок дії хімічних агентів і ряду фізичних чинників на молекулярно-генетичні процеси реплікації і рекомбінації. Наслідком цього є порушення нуклеотидной послідовності гена. Це приводить до зміни первинної структури поліпептиду, порушення структури і функції білка, порушення фенотипа.
Розриви одного з ланцюгів можуть відбуватися під дією іонізуючої радіації, в результаті пошкодження хімічних зв'язків між нуклеотидами (мал. 35). Дефекти можуть відновлюватися ферментом лигазой.

Ріс.35. Схема виникнення мутації в результаті інверсії
Зшивання нуклеотидов, наприклад, два поряд тиминов, що стоять, відбувається під дією ультрафіолетового опромінювання. Це приводить помилкам транскрипції.
«Мутон». Цим терміном називають мінімальну кількість генетичного матеріалу, здібного до мутації, що приводить до появи нового варіанту ознаки. У вищевикладеному матеріалі приведені шовні типи мутацій. У всіх випадках видно, що досить змінити тільки одну пару комплементарних підстав в гені, щоб цінувати властивості білка. Тобто мутон відповідає одній парі комплементарних нуклеотидов.
Рекон. Цим терміном називають мінімальну кількість генетичного матеріалу, зміна якого в результаті рекомбінації кросинговера приводить до мутації і появи нового варіанту ознаки. Такі процеси можуть приводити до зрушення рамки прочитування порушенню синтезу необхідного білка. Наукові дослідження побувають, що достатньо рекомбінації однієї пари комплементарних нуклеотидов, щоб відбулася мутація. Отже, рекон відповідає одній парі комплементарних нуклеотидов.
Множинні аллели. Різні структурно- фунциональные варіанти гена називають аллелями. Вони відрізняються невеликими змінами в нуклеотидной послідовності. Це забезпечує варіації в прояві ознаки. Аллелі розташовуються в одних і тих в ділянках (локусах) гомологичных хромосом. Наявність в генофонді популяції більше двох варіантів аллельных генів називають множинними аллелями. Причиною множинного аллелизма є різноманітні мутації і рекомбінації. Мутації можуть відбуватися в будь-яких ділянках гена. Вони приводять до того, що один і той же ген може брати участь в декількох варіантах. Якщо мутації не викликають загибель організму, вони зберігаються в генофонді вигляду, чим обумовлюють появу нового варіанту ознаки в популяції.
Моногенні спадкові хвороби. Більшість форм спадкових захворювань обумовлена генними мутаціями, тобто молекулярними змінами на рівні ДНК (муковісцидоз, гемофілія, фенілкетонурія, нейрофіброматоз, міопатія Дюшенна і так далі). Це генні хвороби.
Мутації транскрибируемых ділянок (що визначають амінокислотну послідовність в молекулі білка, що синтезується) приводять до синтезу аномального продукту, тоді як мутації нетранскрибируемых областей можуть призводити до зниження швидкості синтезу незамінного білка різного ступеня вираженості. Фенотіпічеськи генні мутації можуть виявлятися на молекулярному, клітинному, тканинному і органному рівнях.
Множинність метаболічних шляхів, функцій білків в організмі, обмеженість наших уявлень про нормальний метаболізм утрудняють розробку обгрунтованої етіологічної класифікації генних хвороб. Навіть число генних хвороб можна визначити тільки орієнтування (3500— 4500), тому що немає строгих критеріїв нозологічних форм ні з клінічної, ні з генетичної точки зору. Наприклад, з клінічної точки зору міопатії Дюшенна (важка) і Беккера (легка). є різними формами, а з генетичної точки зору це результат мутації в одному і тому ж локусе. Встановлено, що міопатія Дюшенна розвивається при повній блокаді, а Беккера — при частковій блокаді синтезу РНК для дистрофина (при міопатії Беккера делеции гена за розміром менше).
Точніше можна говорити про ті гени, в яких ідентифіковані болезнь- обумовлюючі мутації. В даний час відомо близько 1100 таких генів. Проте можна чекати, що найближчим часом на основі знань генома людини процес виявлення генів і мутацій в них буде прискорений. У зв'язку з тим, що різні мутації в одному і тому ж гені часто приводять до порушень, що відрізняються, загальне число хвороб зі встановленою мутаційною природою можна вважати рівним 1500.
Те, що успадкувало патологічного гена (а у разі рецесивних мутацій — двох аллелей) не завжди супроводжується розгорненою клінічною картиною. Вище вже мовилося про можливий вплив чинників зовнішнього середовища на прояв генів. Проте і інші гени, що формують генотип особини, тобто генетичну конституцію індивіда, можуть модифікувати прояв патологічного гена. У таких випадках говорять про неповну пенетрантности і варіюючу експресивність. Оскільки генетичне середовище для патологічного гена завжди індивідуальне, виникають широкі можливості для різного прояву цього гена у різних індивідів.
Багато генних мутацій обумовлюють виникнення таких молекулярних форм білків, патологічна дія яких виявляється не в звичайних умовах, а тільки при взаємодії із специфічними чинниками зовнішнього середовища. Це так звані екогенетичні варіанти. Наприклад, у осіб з мутаціями в локусе глюкозо-6-фосфатдегидрогеназы при лікуванні сульфаниламидами виникає гемоліз еритроцитів, у осіб з аномальною холинэстеразой введення дитилина приводить до тривалої зупинки дихання.
У зв'язку з великим числом нозологічних форм генних хвороб, їх рідкістю, неповною клінічною і патологоанатомічною діагностикою спадкової патології дані по поширеності спадкових хвороб носять ще уривчатий характер. Проте по формах, по яких проводяться масові діагностичні або профілактичні програми, зібраний переконливий матеріал для думки про епідеміологію генних хвороб.
Загальна частота новонароджених з генними хворобами в популяціях в цілому складає приблизно 1%, з них з аутосомно-домінантним типом спадкоємства — 0,5%, аутосомно-рецессивным — 0,25%, Х-сцепленным — 0,25%; Y-сцепленные і мітохондріальні хвороби зустрічаються украй рідко.
Поширеність окремих форм хвороб коливається від 1:500 (первинний гемохроматоз) до 1:100 000 і нижче (гепатолентикулярная дегенерація, атаксия-телеангиэктазия і ін.).
Поширеність генної хвороби умовно можна вважати високою, якщо 1 хворий зустрічається на 10 000 новонароджених і чаші, середній, — 1:10 000— 1:40 000, низькою, — дуже окремі випадки. У групу поширених входить не більше 15 генних хвороб, але вони обумовлюють майже 50% обший частоти хворих із спадковою патологією.
Мутаційний процес — одна з біологічних характеристик будь-якого вигляду. Він постійно протікає у людини в зародкових і соматичних клітках і є основою виникнення і підтримки генетичної різноманітності людини. В той же час це первинне джерело виникнення спадкових хвороб. По різних оцінках, частота виникнення мутацій (спонтанний рівень) у людини орієнтування складає 1 х 10-3—1 х 10-7 генів на покоління, тобто мутаційні події в кожному гені достатньо рідкісні. Лише у декількох генах мутації виникають з підвищеною частотою (1 на 104 гамет). Ці гени відрізняються від інших незвичайно великими розмірами (360 000 пар нуклеотидов в гені нейрофіброматозу і 2х106 — в гені міопатії Дюшенна—беккера).
Таким чином, поточний мутаційний процес на генному рівні в одному поколінні не може забезпечувати спостережуваної високої частоти патологічних аллелей в популяціях. По приблизних непрямих оцінках (а точні прямі поки неможливі) загальний внесок мутаційного процесу в поширеність спадкових хвороб складає близько 20% їх загального числа.

Ріс.36. Схеми різної хромосомної аберації
Молекулярні і цитологические механізми хромосомних мутацій. Такі мутації пов'язані із зміною структури і розмірів хромосом. Їх також називають хромосомними перебудовами або хромосомною аберацією. Порушення структури хромосом є наслідком порушення процесів кросинговера, мейоза або митоза, а також дією інших чинників, що приводять до утворення фрагментів. Такі фрагменти можуть надалі навіть возз'єднатися, але без відновлення нормальної структури. Розрізняють внутри- і міжхромосомні перебудови. Серед внутрішньохромосомної аберації
виділяють наступні (рис.36.): делеция — брак внутрішніх ділянок хромосом; дупликация — подвоєння ділянок хромосоми; інверсія — поворот ділянки хромосоми на 180°; транслокация — переміщення ділянки з одного місця хромосоми в інше.
Причинами транслокаций є помилки молекулярно-генетичних процесів рекомбінації і ділення генетичного матеріалу. Міжхромосомні перестройки-транслокации пов'язані з переміщенням ділянки хромосоми, що відірвалася, на інше місце негомологичной хромосоми (хромосоми з іншої пари). Ділянка хромосоми, що відокремилася при розриві, може бути втрачений кліткою при черговому митозе, якщо він не мав центромеры. Але частіше такий фрагмент прикріпляється до однієї з хромосом. Розрізняють декілька видів транслокаций: а) реципрокные — взаємний обмін ділянками між негомологичными хромосомами, би) нереципрокные (транспозиції) — приєднання фрагмента до своєї ж хромосоми у іншому місці, в) полицентрические і ін.
Хромосомні перебудови приводять до зміни морфології хромосом, що помітно навіть в світловий мікроскоп. При цьому метацентричні хромосоми можуть перетворюватися на субметацентричних, акроцентрические, і навпаки. Можуть з'явитися кільця і полицентрические хромосоми.
Структурні перебудови хромосом статевих кліток змінюють генетичний баланс і генетичні програми розвитку і функціонування ембріона. Змінюється характер взаємодії генів і їх функціонування. Це негативно позначається на структурі і функції кліток, органів і приводить до серйозними наслідками. Часто мутації виявляються несумісними з розвитком нового організму або обумовлюють появу патологій. Проте деякі перебудови хромосом можуть бути корисними для еволюції. Наприклад, у людини 23 пари хромосом, а у сучасної людиноподібної мавпи 24 пари. Передбачається, що істотним етапом еволюції людини є робертсоновская транслокация — злиття 12 і 13 хромосом мавп, і утворення другої хромосоми людини, яка майже повністю відповідає по генетичному складу своїм попередникам. В результаті цього відбулася зміна числа пар хромосом і комбінацій генів, що, ймовірно, з'явилося одній з причин появи людини. Решта хромосом людини практично схожа з хромосомами шимпанзе, хоча є деякі відмінності, наприклад, перицентрические інверсії 4, 5, 12, 17 хромосом.
Хромосомна аберація виявляється цитогенетичним методом під світловим мікроскопом. У людини відома транслокационная форма хвороби Дауна, коли частина 21 хромосоми під час мейоза приєднується до 15-ої і разом з нею через гаметы потрапляє в зиготу, де з'являються три 21 хромосоми. Крупна хромосомна аберація в зиготах приводить до важких аномалій, несумісних з життям або загибелі зародків на початкових стадіях эмбриогенеза.
Сучасні методи вивчення каріотипу людини. Хромосомний комплекс вигляду зі всіма його особливостями: числом хромосом, їх формою, наявністю видимих в світловий мікроскоп деталей будови, генною і аллельным складом називається каріотипом. Специфічність набору хромосом для кожного виду. Всі живі організми мають постійне число специфічних хромосом в кожній соматичній клітці. Діплоїдноє число хромосом (2п) для людини — 46, для дрозофилы — 8, для коня — 66, шимпанзе — 48, собаки — 78 і так далі число (п) Гаплоїдноє для людини — 23, дрозофилы — 4 і так далі Гамети зазвичай містять тільки один набір хромосом.
Число хромосом в каріотипі індивідуума не залежить від висоти організації вигляду і не указує на спорідненість філогенезу, оскільки одна і та ж кількість хромосом може зустрічатися у дуже далеких один від одного видів. Особливість виявляється в тому, що кожен вид організмів має специфічний набір хромосом певної форми і розмірів. А головне, хромосоми організмів різних видів мають свій Унікальний набір генів, що визначають розвиток індивідуумів тільки безумовно вигляду.
Мікроскопічні методи вивчення хромосом людини застосовуються з кінця XIX століття. З'єднання цитологического спостереження хромосом з генетичним аналізом сегрегації і зчеплення генів привело до народження цитогенетики. Термін «цитогенетика» введений В. Саттоном в 1903 р. Спочатку цитогенетика концентрувалася на проблемах кореляції генетичних і цитологических (хромосомних) ознак. У подальшому цитогенетика методично відокремилася від генетики, і під терміном «цитогенетика» розуміють область науки, що вивчає структуру і функції хромосом.
Цитогенетичні методи призначені для вивчення структури хромосомного набору або окремих хромосом. Найбільш поширеним методом в цитогенетике людину є світлова мікроскопія. Електронна і конфокальная лазерна мікроскопія застосовується в сучасній цитогенетике тільки з дослідницькими цілями. У всій медико-генетической практиці застосовується світлова мікроскопія (головним чином в світлі, що проходить), включаючи люмінесцентну мікроскопію.
Об'єктом цитогенетичних спостережень можуть бути соматичні, що діляться, мейотические і интерфазные клітки. Кожен з цих об'єктів має переваги і недоліки. Вибір об'єкту визначається метою дослідження. Більшість цитогенетичних досліджень виконуються на соматичних клітках.
Отримання препаратів митотических хромосом. Перша головна умова цитогенетичної діагностики — наявність кліток, що діляться, в цитологическом препараті.
Кістковий мозок, тканини семенника і хорион мають достатній митотический індекс для того, щоб використовувати ці об'єкти для цитогенетичних цілей. Проте, як показав досвід, незрівнянно информативнее дослідження на культурах кліток: клітки звільнені від елементів сполучної тканини і добре суспендируются. Мітотічеський індекс в культурі кліток набагато вищий, ніж в тканинах організму.
Культури кліток можна отримувати з шматочків шкіри (ростуть фибробласты), кісткового мозку, ембріональних тканин, хориона, кліток амниотической рідини. Найбільш зручним об'єктом для медичних генетиків виявилася культура лімфоцитів периферичної крові. Для її отримання досить узяти 1—2 мл венозної крові і додати її в суміш живильного середовища з фитогемагглютинином (білок бобових рослин). Останній викликає імунологічну трансформацію лімфоцитів і їх ділення. Тривалість культивування складає 48-72 ч.
Другою методичною умовою цитогенетичних досліджень є використання колцемида (або колхицина), що руйнує веретено ділення і що зупиняє клітинне ділення на стадії метафази. Мітотічеський індекс в культурі кліток за 2—3 ч підвищується в 2—3 рази. Навіть без культивування експозиція з колцемидом збільшує число метафаз. Хромосоми у присутності колцемида коротшають за рахунок конденсації, що продовжується, і, отже, в препараті вони легше відділяються одна від одної. У тих випадках, коли необхідний детальний аналіз певного району хромосоми, хромосоми, що сильно конденсують, на стадії метафази (метод називається метафазным) непридатні для аналізу. Для цих цілей клітка повинна бути зафіксована на стадії, попередній метафазі, коли хромосома редуплицировалась, але ще не повністю конденсувалася. Ця стадія — стадія прометафазы. Хоча хромосоми на даній стадії погано роз'єднані (вони ще дуже довгі) і на препараті є багато накладень однієї хромосоми на іншу, все ж таки в окремих клітках можна знайти ділянку, необхідну для аналізу. Цей метод (або підхід) на відміну від метафазного методу називають прометафазным або методом высокоразрешающей цитогенетики. Суть методичного втручання при даній модифікації методу полягає в припиненні процесу тієї, що спіралізує і конденсації хромосом в профазе за допомогою препаратів, які вводять в культуру кліток за декілька годинників до фіксації.
Диференціальне фарбування хромосом. Метод простій забарвлення хромосом як єдиний метод вивчення каріотипу людини застосовувався до початку 70-х років. У 70-х роках до практики увійшли методи диференціального фарбування і хронології реплікації ДНК в хромосомах.
Диференціальне фарбування забезпечується порівняно простими температурно-сольовими діями на фіксовані хромосоми. При цьому виявляється структурне диференціювання хромосом по довжині, що виражається у вигляді чергування эу- і гетерохроматических районів (темні і світлі смуги). Протяжність цих ділянок специфічна для кожної хромосоми, відповідного плеча і району. Як видно з мал. 37.б, при диференціальному забарвленні ідентифікуються всі хромосоми, плечі і навіть певні райони. Кожна хромосома має свій малюнок покресленої. При диференціальному забарвленні метафазных хромосом в каріотипі можна оцінити близько 200-400 ділянок. Така вирішуюча можливість методу.

Ріс.37. Каріотипи при простій (а) і диференціальному (б) забарвленню
Спочатку при спеціальному фарбуванні хромосом використовували флюоресцентну алкилирующее речовину акрихін-Іприт. Цей варіант був названий Q-методом. Даний метод вимагає швидкої обробки препарату, що не завжди зручно. Для проглядання препарату треба користуватися люмінесцентним мікроскопом.
У подальшому була розроблена методика диференціального забарвлення без флюоресцентних фарбників. Найширше використовується G-окраска (Гимза). При цьому хромосоми заздалегідь обробляють (або інкубація в сольовому розчині, або обробка протеазой). Попередня обробка частково порушує структуру хромосом, яка в деяких ділянках відновлюється при забарвленні, що і додає хромосомі індивідуальну покреслену, або смугастість. Механізм утворення сегментів поки недостатньо ясний. Передбачається, що забарвлені сегменти — гетерохроматиновые, пізно реплицирующиеся ділянки хромосом з послідовностями ДНК, що повторюються, а незабарвлені — эухроматиновые ділянки, в яких розташовані кодуючі послідовності.
Для ідентифікації хромосом, крім методів виявлення лінійної структурної диференційованої, можна скористатися одній з важливих характеристик хромосом людини – асинхронностью їх реплікації по довжині (рис.38).
«Малюнки» послідовності реплікації (рано чи пізно реплицирующиеся ділянки) специфічні для кожної хромосоми. Для виявлення

Ріс.38. Метафазная пластинка з диференціальним забарвленням сестринських хроматид
послідовності реплікації застосовується аналог тимидина 5-бромде-зоксиуридин. Ділянки хромосоми, що включили цей аналог, забарвлюються погано. Використовуючи цей метод, можна ідентифікувати будь-яку хромосому або хромосомну перебудову. Введення аналога 5-бромдезоксиуридина в культуру на 24 ч і більш застосовується для диференціального забарвлення сестринських хроматид. Якщо 5-бромдезоксиуридин ввести на повний клітинний цикл, то знов утворювана хроматида включить аналог тимидина і забарвлюватиметься слабо. Інша хроматида (стара) забарвлюється, як завжди, інтенсивно (рис.38.). Цей метод дозволяє легко виявляти обміни між сестринськими хроматидами (СХО), число яких збільшується при спадкових хворобах з хромосомною нестабільністю (анемія Фанконі, пігментна ксеродерма і ін.). Число СХО збільшується також при мутагенних діях, тому метод обліку СХО широко використовується при вивченні мутаційного процесу у людини.
Молекулярно-цитогенетичні методи. Завдяки успіхам молекулярної генетики людини розроблений принципово новий метод вивчення хромосом — метод флюоресцентної гібридизації in situ (FISH). Принцип цього методу полягає в наступному (схема):
Для хромосоми, що вивчається, або конкретної її ділянки, виходячи із специфічності послідовності підстав ДНК, готують однонитевой ділянку ДНК, до якої приєднується біотваней або дигоксигенин. Така «помічена» ділянка ДНК називається зондом.
На мікроскопічному препараті in situ при лужній обробці хромосомна ДНК денатурується, тобто розриваються зв'язки між двома нитками ДНК.
Зондом обробляють препарат. Оскільки послідовність підстав ДНК-зонда і відповідна ділянка хромосоми взаємно комплементарны, то зонд приєднується до хромосоми. У цій ділянці відбувається ренатурация ДНК.
Після цього препарат обробляють речовиною, яка завдяки своїй структурі здатна вибірково приєднатися до біотвань або дигоксигенину. Як видно на схемі, для біотвань такою речовиною є стрептовидин, для дигоксигенина — антидигоксигениновое антитіло. До цих речовин можуть бути приєднані в один або два етапи флюоресцентні фарбники (родамин — червоний колір або флюоресцеин изотиоцианат — зелений колір).
За допомогою люмінесцентного мікроскопа забарвлені хромосоми візуалізуються на тлі незабарвлених.
На схемі розглянута подвійна гібридизація. Сучасні методичні можливості дозволяють збільшити число квітів.
Межі застосування методу FISH дуже широкі: від локалізації гена до розшифровки складних перебудов між декількома хромосомами. Слід підкреслити, що з'єднання молекулярно-генетичних і цитологических методів робить майже необмеженими можливості діагностики хромосомних аномалій, як дуже складних, так і дуже дрібних по розмірах.
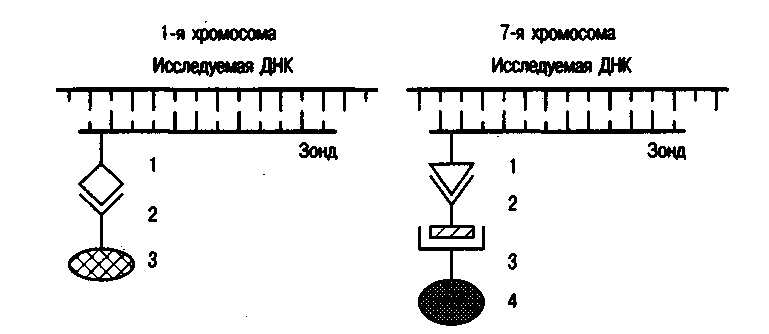
Ріс.39. Схема подвійної специфічної флюоресцентної гібридизації in situ
Дву- і трибарвна флюоресцентна гібридизація in situ застосовується для обліку симетричної хромосомної аберації у осіб, опромінених багато років тому іонізуючими випромінюваннями. Вказаний метод вимагає менше часу, чим кариотипирование диференціально забарвлених метафаз (рис.39.).
У клінічній цитогенетике метод FISH займає все більше місце. У випадках складних хромосомних перебудов, що захоплюють більше двох хромосом, диференціальне G-окраска не завжди дозволяє ідентифікувати змінені сегменти хромосом. У цих випадках застосовують трибарвний варіант методу FISH. Наприклад, у дитини з множинними природженими аномаліями при G-анализе виявлені складні перебудови в 6 хромосомах (1,4. 7, 8, 9 і 12) з 10 розривами. Повна ідентифікація розривів можлива тільки за допомогою FISH-окраски.
Метод FISH може застосовуватися для діагностики анеуплоїдій в интерфазных ядрах. Принцип методу в цьому варіанті такий же, як і для метафазных пластинок (описаний вищим). Наприклад, специфічний для хромосоми 21 зонд ДНК, сполучений з биотином, гибридизируется з денатурованими клітками з амниотической рідини на наочному склі. У нормі, тобто якщо у плоду є дисомия по хромосомі 21, в ядрі будуть видні дві флюоресцирующие відповідним кольором крапки. Якщо у плоду трисомия, то в ядрі будуть видна 3 крапки. Такий методичний прийом називають интерфазной цитогенетикой. Метод простий, економічний і вимагає мало часу (декілька годин).
Метод порівняльної гібридизації генома (CGH— comparative genome hybridization). Область використання методу — онкологічна цитогенетика. Призначення методу — визначення районів хромосом, які делегуються або амплифицируются в певному типі пухлини. Райони делеций, як правило, містять гены-супрессоры пухлинного зростання, а райони ампліфікації містять онкогены. Таким чином, метод використовується більшою мірою для картирования і клонування генів, залучених в канцерогенез.
Іноді буває достатньо складно отримати хромосомні препарати хорошої якості з солідної пухлини або у хворих з гематологічними онкозахворюваннями, тому був розроблений оригінальний метод непрямого аналізу хромосом в пухлині. Суть методу CGH в тому, що з пухлини виділяють ДНК і мітять її певним флюорохромом. ДНК, виділену з нормальної тканини, мітять іншими флюорохромом. Хромосомні препарати готують стандартним способом з лімфоцитів периферичної крові контрольного індивіда. Мічену ДНК з пухлини і незміненої тканини гібридизують з хромосомним препаратом. По інтенсивності свічення мітки визначають області делеций і ампліфікація. Область дозволу —5—10 млн пар нуклеотидов. Для обробки даних використовують програми комп'ютерного аналізу хромосом.
Спектроскопічний аналіз хромосом (SKY). Цей метод використовує флюоресцентні фарбники, що мають спорідненість до певних ділянок хромосом. При використанні набору специфічних зондів з різними фарбниками кожна пара хромосом має свої унікальні спектральні характеристики. Особливість методу — використання інтерферометра, аналогічного використовуваним для вимірювання спектру астрономічних об'єктів. Незначні варіації в спектральному складі, невиразні людським оком, враховуються при комп'ютерній обробці, і потім програма призначає кожній парі хромосом легко розпізнавані кольори. Результат у вигляді кольорового зображення частіше використовується в цифровій формі. Аналіз каріотипу значно полегшується, оскільки гомологичные хромосоми мають один і теж колір, а аберація стає легко помітними. Крім того, спектральне кариотипирование використовується для виявлення транслокаций, не розпізнаваних традиційними методами. Область використання методу — онкоцитогенетика. Завдяки такому підходу вдається точно описати множинні структурні перебудови хромосом, що відбуваються в пухлинних клітках. У клінічній цитогенетике вдається визначати дуже незначні по величині транслокации, инсерции і маленькі маркерні хромосоми. Проте використання методу обмежене високою вартістю устаткування для аналізу.
Свідчення для цитогенетичного дослідження достатньо широкі, особливо при акушерсько-гінекологічній і дитячій патології. Нижче приводиться перелік (можливо, неповний) станів, при яких з діагностичними цілями треба мати результати цитогенетичного дослідження, проведеного у пацієнта (пробанда) і при необхідності у його родичів.
Підозра на хромосомну хворобу по клінічній симптоматиці (для підтвердження діагнозу).
Наявність у дитини множинних вроджених вад розвитку, що не відносяться до генного синдрому.
Багатократні (більше двох) спонтанні аборти, мертвонародження або народження дітей з вродженими вадами розвитку.
Порушення репродуктивної функції неясного генеза у жінок і чоловіків (первинна аменорея, безплідний брак і ін.).
Істотна затримка розумового і фізичного розвитку у дитини.
Пренатальна діагностика (за віком, у зв'язку з наявністю транслокации у батьків, при народженні попередньої дитини з хромосомною хворобою).
Підозра на синдроми, що характеризуються хромосомною нестабільністю (облік хромосомної аберації і СХО).
Лейкоз (для диференціальної діагностики, оцінки ефективності лікування і прогнозу течії).
Оцінка мутагенних дій (радіаційних, хімічних). Медичних обмежень для застосування цитогенетичних методів немає.
Проте необхідно пам'ятати, що ці методи трудомісткі, дорогі, призначення їх навмання невиправдано (за принципом «якщо неясно, то давайте призначимо»). Правильніше призначати цитогенетичне дослідження по рекомендації лікаря-генетика після проведення медико-генетического консультування. Досвід роботи зарубіжних медичних установ показав необхідність створення цитогенетичних лабораторій при великих багатопрофільних лікарнях і медико-генетических консультаціях, комплексно обслуговуючих який-небудь район або місто. У Україні цитогенетичні дослідження проводяться в медико-генетических кабінетах і медико-генетических консультаціях.
Класссифікация мутацій унаслідок виникнення. Залежно від причин виникнення мутації можуть бути спонтанні або індуковані. Спонтанні — це мутації, які відбуваються в природі раптово без видимих причин під дією якихось чинників. Індуковані — це мутації, що відбуваються при направленій дії певних мутагенів.
До 1925—1927 рр. генетики мали справу тільки із спонтанними мутаціями. Різні спроби підвищити частоту мутацій, у тому числі і зроблені Т. X. Морганом, не приносили успіху. Створювалося враження, що мутаційний процес не залежить від навколишнього середовища. Це стимулювало автогенетичні концепції, згідно яким еволюцію організмів пов'язували тільки з дією внутрішніх чинників.
Оволодіння методами індукованого мутагенезу зіграло величезну роль в боротьбі з такими тенденціями, а також розширило можливості генетичного аналізу. Вперше підвищення частоти спадкової мінливості під впливом зовнішніх агентів виявили в 1925 р. радянські мікробіологи Г. А. Надсон и Г. З. Філіппов. Вони спостерігали збільшення різноманітності спадкових форм — сальтантов, як вони їх назвали, після дії «променями радію» на нижчі гриби.
У 1927 р. Г. Меллер повідомив про дію рентгеновых променів на мутаційний процес у дрозофилы і запропонував той, що став класичним кількісний метод обліку рецесивних летальних мутацій в Х-хромосоме у цього об'єкту. Майже одночасно Л. Стадлер (1928) описав вплив рентгеновых променів на мутаційний процес у ячменю. У тому ж році М. Н. Мейсель в лабораторії Г. А. Надсона отримав мутації у дріжджів під дією хімічних сполук (хлороформ і ін.).
У 30-х роках відкритий хімічний мутагенез у дрозофилы: спочатку В. В. Сахаров (1932), а потім М. Е. Лобашев і Ф. А. Смірнов (1934) показали, що деякі з'єднання (йод, оцетова кислота, аміак) здатні індукувати рецесивні літали в Х-хромосоме. У 1939 р. С. М. Гершензон відкрив сильний мутагенний ефект екзогенної ДНК у дрозофилы. Могутні хімічні мутагени були відкриті в 1946 р. І. А. Рапопортом (этиленимин) в СРСР і Ш. Ауербах і Дж. Робсоном (азотистий Іприт) в Англії.
З тих пір до арсеналу мутагенних чинників увійшли різноманітні хімічні сполуки: аналоги підстав, що включаються безпосередньо в ДНК, такі агенти, як азотиста кислота або гидроксиламин, що модифікують підстави, з'єднання, алкилирующие ДНК (этилмегансульфонат, метилметансульфонат і ін.), з'єднання, интеркалирующие між підставами ДНК (акрихіни і їх похідні), і багато інших. Разом з мутагенами були знайдені речовини-антимутагени.
Можливість змінювати швидкість мутаційного процесу послужила вирішальним стимулом до з'ясування причин спонтанних мутацій. Одна з перших спроб пояснити причини спонтанних мутацій зводилася до припущення про те, що насправді їх індукує природний фон радіоактивності. Проте з'ясувалося, що таким шляхом можна пояснити виникнення лише близько 0,1 % всіх спонтанних мутацій у дрозофилы. Не підтвердилася і гіпотеза про тепловий рух атомів як головну причину спонтанних мутацій. Були спроби пояснити спонтанні мутації результатом дії продуктів метаболізму клітки і організму.
Сучасна точка зору на причини спонтанних мутацій сформувалася в 60-х роках завдяки з'ясуванню механізмів відтворення, репарації і рекомбінації генів і відкриттю ферментних систем, відповідальних за ці процеси. Виникла тенденція пояснювати генні мутації як помилки в роботі ферментів матричного синтезу ДНК. Зараз ця гіпотеза загальновизнана. Привабливість гіпотези полягає також в тому, що вона дозволяє розглядати і індукований мутаційний процес як результат втручання зовнішніх чинників в нормальне відтворення носіїв генетичної інформації, тобто дає єдине пояснення причин спонтанних і індукованих мутацій. Великий вплив на розвиток теорії мутаційного процесу надав вивчення його генетичного контролю. Були відкриті гени, мутації яких можуть підвищувати або знижувати частоту як спонтанних, так і індукованих мутацій. Ці і інші факти, переконливі аргументи на користь існування загальних причин індукованого і спонтанного мутаційного процесу.
Перше пояснення механізму мутаційних змін (генних мутацій і хромосомної аберації) було запропоноване в 1935 р. Н. Ст. Тімофєєвим-ресовським, К. Циммером и М. Дельбрюком на підставі аналізу радіаційного мутагенезу у вищих організмів і перш за все у дрозофилы. Мутація розглядалася як результат миттєвої перебудови атомів в складній молекулі гена. Причиною такої перебудови вважалося безпосереднє попадання в ген кванта або іонізуючої частинки або ж випадкові коливання атомів.
Відкриття надалі ефекту післядії іонізуючих випромінювань показало, що мутації виникають в результаті процесу, що триває в часі, а не безпосередньо у момент проходження кванта енергії або іонізуючої частинки через ген.
Перспективи подолання цих і інших суперечностей теорії мутаційного процесу, що зароджується, були намічені у фізіологічній гіпотезі мутаційного процесу, висловленій 1946 р. М. Е. Лобашевим.
Суть гіпотези М. Е. Лобашева полягала в тому, що «завдяки здатності клітки репарировать отримані пошкодження становлення мутації повинне здійснюватися в процесі оборотності пошкодження, тобто в процесі відновлення (репарації)». Це означало, що появі мутації повинні передувати передмутаційний стан або потенційна зміна, яка може бути усунене (тотожна репарація) або реалізується у вигляді мутації (нетотожна репарація). Для доказу існування таких передмутаційних станів М. Е. Лобашев, його учні До. Ст. Ватті, М. М. Тіхомірова та інші в дослідах з дрозофилой, опроміненою рентгеновыми променями, додатково впливали на неї високою температурою, яка сама по собі мутацій практично не викликала. Мухи, піддані такій комбінованій дії, виявляли вищу мутабильность, ніж після дії тільки рентгеновыми променями.
Не дивлячись на те, що фізіологічна гіпотеза мутаційного процесу була сформульована на основі загальноприйнятих у той час уявлень про білок як носіїв генетичної інформації, вона виявилася справедливою і відносно молекул ДНК. Дійсно, багато ушкоджувальних агентів приводять до локальної денатурації молекул ДНК, а усунення цих порушень структури (репарація) — до виникнення мутацій. Зв'язок мутацій з процесами репарації в даний час доведений практично для всіх досліджених об'єктів. Нині фізіологічна теорія виросла з рамок гіпотези, символізуючи сучасний період у вивченні мутаційного процесу.
Мутагенні чинники. Забруднення навколишнього середовища небезпечне не тільки поколінню, що нині живе, але часто представляє небезпеку для прийдешніх поколінь, оскільки багато забруднювачів мутагенні (або, що майже те ж саме, генетично активні). Виявлення і усунення генетично активних чинників з місця існування людини — завдання генетичної токсикології, яка є найбільш розділом екологічної генетики, що активно розвивається. Це пояснюється її величезним прикладним значенням.
Парадоксально, але факт, що відкриття індукованого мутаційного процесу зажадало значних зусиль від дослідників: пригадаємо, що Г.Дж. Меллер отримав Нобелівську премію за відкриття мутагенної дії рентгеновых променів (1927 рік). Тепер же мутагени виявляються на кожному кроці. Багато продуктів виробничої діяльності людини, що з'являються як результат так званого технічного прогресу, володіють генетичною активністю. При цьому ми говоримо не тільки про відходи виробництва. Це можуть бути ліки, консерванти, харчові добавки і фарбники, косметика, інсектициди і пестициди, не говорячи вже про дим сигарет і випромінювання, супроводжуючі «мирний атом», тим більше зброя масового знищення — ядерне і хімічне. Складніше йде справа з новими, як правило антропогенними, чинниками зовнішнього середовища, які ніколи не зустрічалися в природі в ході біологічної еволюції. Так, наприклад, багато інсектицидів — хлоровані вуглеводні ніколи не існували в природі. Вони не трансформуються в харчових ланцюгах і тому неразложимы біологічним шляхом, що не враховувалося при їх застосуванні. До них відносяться полихлорбифенилы, зокрема пестициди: 2,4-дихлорфеноксиуксусная кислота (2,4-Д) або 2,4,5-трихлорфеноксиуксусная кислота (2,4,5-Т) — ефективні дефоліанти. Притчею во язицех стає останнім часом діоксин, що також відноситься до полихлорированным бифенилам і найактивніші отрути, що є, відомі в даний час. Один з них входив до складу сумного відомого agent orange, що застосовувався армією США у В'єтнамі як бойовий дефоліант. Діоксин утворюється також при спалюванні сміття у великих кількостях на заводах по знищенню міських відходів.
У списку найбільш значущих антропогенних чинників забруднення середовища (з 19 найменувань) перші п'ять місць займають: 1) пестициди; 2) важкі метали; 3) діоксид вуглецю; 4) діоксид сірі і продукти її окислення, суспензії; 5) розливи нафти, стічні води промислових підприємств. При цьому радіоактивні відходи, що володіють безперечною генетичною активністю, стоять тільки на 12-м місці як забруднювачі.
У генетичній токсикології прийнято говорити не тільки про мутагени, але і, ширше, про генетично активні чинники. Не завжди вдається визначити безпосередньо мутагенний ефект тієї або іншої дії, але можна показати його вплив на кросинговер, тобто на рекомбінацію генів або індукцію репаративного синтезу ДНК, супроводжуючого багато пошкоджень генетичного матеріалу.
Таким чином, мутагенез, рекомбинагенез і індукція репаративного синтезу ДНК — це показники генотоксичности або генетичній активності досліджуваного чинника.
Генетично активні чинники діляться на фізичні, хімічні і біологічні. До фізичних чинників відносяться температура, іонізуюча радіація, ультрафіолетове світло, мабуть, високочастотне електромагнітне випромінювання, ультразвук і так далі Хімічні генетично активні чинники набагато важче піддаються перерахуванню і класифікації. Досить сказати, що до них відносяться будь-які речовини, прямо або побічно порушуючу структуру і відтворення молекул ДНК. Вихлопні гази автотранспорту і викиди в атмосферу виробничих підприємств містять алкилирующие з'єднання (їх називають радиомиметиками), органічні сполуки ртуті, поліциклічні вуглеводні, що володіють генетичною активністю. Багато хімічних сполук самих по собі не проявляють генетичної активності, але їх легко активують внутріклітинні метаболиты, а іноді і з'єднання, що знаходяться в навколишньому організм середовищі. Наприклад, поширені солі азотної кислоти легко перетворюються на нітрит (солі азотистої кислоти) — мутагени, дезаминирующие підстави ДНК. У кислому середовищі шлунку ссавців нітрит і аминосо-единения дають нитрозосоединения — супермутагени, що порушують реплікацію ДНК. Багато речовин, так звані промутагены, активуються в організмі ссавців при дії цитохрома P-450. Цей фермент, що синтезується в печінці, відноситься до класу неспецифічних монооксигеназ і призначений для инактивации чужорідних з'єднань, що потрапляють в організм. Але Р-450 разом з тим здатний активувати деякі промутагены. Більш того, він може активувати не тільки промутагены, але і потенційні канцерогени — речовини, що викликають рак. Необхідно відзначити високий рівень кореляції між мутагенним і канцерогенним ефектами багатьох чинників, перш за все фізичних і хімічних.
Особливий інтерес представляють біологічні генетично активні чинники. В кінці 30-х років С.М. Гершензон встановив мутагенний ефект ДНК і вірусів. Пізніше було з'ясовано, що хромосомна аберація в соматичних клітках викликає віруси віспи, кору, вітряної віспи, грипу, гепатиту. СТРЕПТОЛІЗІН-О, токсин гемолітичного стрептокока, підвищує частоту мутацій в культурі ембріональних фибробластов людини. У контролі частота хромосомної аберації складає 4,0 ± 0,5%, а при дії токсину - 24,3 ± 0,6%. Ю.Я. Керкис показав мутагенний ефект імунологічного стресу при пересадці і відторгненні через тканинну несумісність шкірного клаптя у мишей. Могутнім мутагеном біологічного походження виявився афлатоксин — продукт життєдіяльності цвілевого гриба Aspergillusflavus.
Під керівництвом М.Е. Лобашева ще в 60-і роки на кафедрі генетики і селекції Ленінградського університету були початі експерименти, що довели роль нервової системи в контролі частоти хромосомної аберації в соматичних клітках (рогівці ока) у мишей. Розвиваючи цей напрям, учні М.Е. Лобашева (Р.І. Цапигина, С.Н. Новоков, Е.В. Даєв) показали мутагенний ефект феромонального стресу у мишей. При цьому важливо, що мова йде вже про мутації не в соматичних, а в генеративных клітках — при сперматогенезі. Схема виконаного експерименту представлена на мал. 40.
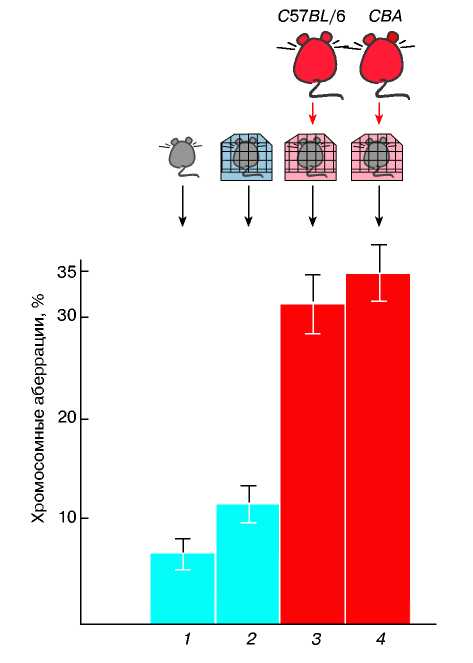
Ріс.40. Вплив феромонального стресу на частоту хромосомної аберації у мишей. Гістограма показує частоту аберації в сперматогенезі: 1 - без додаткової дії; 2 - результат приміщення мишей 30-денного віку на чисту підстилку; 3,4- результату приміщення мишей того ж віку на підстилку після перебування на ній самців 3-4-місячного віку.
Відомо, що запах у взаєминах мишей виконує функції своєрідної мови. Феромони, летючі речовини, що містяться в сечі цих тварин, грають роль сигналів, що викликають реакцію підпорядкування, агресії і так далі Користуючись цими сигналами, старі самці тримають в підпорядкуванні самок і молодих самців. Виявилось, що запах дорослого самця при одноразовій дії підвищує частоту цитологических порушень в сперматогенезі у молодих самців, збільшує частоту аномальних сперматозоїдів і домінантних летальних мутацій, що виявляються після їх спаровування з самками, що не піддавалися дії.
Методи визначення мутагенної активності речовин. З деяких пір (у нас з 1979 року) все нові хімічні сполуки (а всього їх в ужитку більше 4,5 млн) проходять перевірку на генетичну активність. Це своєрідна служба генетичної безпеки, що використовує багатий арсенал різних тест-систем для виявлення генетичної активності. Ці системи дозволяють враховувати мутації генів, їх рекомбінації, втрати і іншу аберацію хромосом, порушення ділень ядра, індукцію репарації ДНК і так далі При цьому використовуються різні об'єкти: бактерії, дріжджі і інші нижчі гриби, плодова мушка-дрозофила, рослини, культура кліток тварин і людини.
Найбільший інтерес представляє генетична активність досліджуваних агентів для людини. Оскільки пряме дослідження їх дії на людину неможливе, доводиться обмежуватися результатами, що отримуються на модельних об'єктах. Ці результати в значній мірі справедливі і для людини із-за біологічної універсальності властивостей генетичного матеріалу — це завжди ДНК. Проте екстраполяція отримуваних результатів на людину завжди представляє деякі складнощі, оскільки разом з принципом біологічної універсальності слід враховувати і специфіку об'єктів, що мають свої особливості реагування на мутагени.
Як приклад розглянемо тільки одну тест-систему, що набула широкого поширення при первинному виявленні генетичної активності. Це система, розроблена в 60-і роки XX століття американським дослідником Би. Еймсом, який тривалий час вивчав мутації в генах, контролюючих біосинтез гистидина у Salmonella typhimuium. Робота Б. Еймса, прекрасний приклад того, як спочатку чисте теоретичне дослідження, направлене на з'ясування структури і функції гена, придбала суто практичне значення. Маючи в своєму розпорядженні детально охарактеризовані мутанти сальмонеллы, що потребують гистидине, знаючи молекулярну природу мутаційних змін: заміни, вставки або випадання пар підстав в ДНК гена або крупніші перебудови генетичного матеріалу, Еймс запропонував вивчати реверсии гистидиновых мутантів, тобто відновлення у них здатності синтезувати гистидин, і, отже рости на середовищі без гистидина в результаті дії різних мутагенів.
Тест дуже простий: досить засівати середовище без гистидина мутантом сальмонеллы, що потребує гистидине (який природно не росте на такому середовищі), і нанести в центр використовуваної для цього чашки Петрі випробовувану хімічну сполуку. Через 2—3-х доби можна бачити появу колоній мутантів (в даному випадку ревертантов) навколо плями нанесеної речовини, якщо воно володіє генетичною активністю (рис.41.). Це приклад так званого спот-теста (від англ. spot — пляма). В даний час тест Еймса вдосконалений: разом з добре вивченими мутаціями потреби в гистидине в геном сальмонеллы вводять делецию по одному з генів репарації, тобто инактивируют цей процес, тим самим підвищують чутливість бактерії до мутагенів. Вводять також мутацію, блокуючу синтез липополисахаридной капсули для підвищення проникності кліток, а також плазмиды, що підвищують чутливість кліток до агентів, що підсилюють рекомбінацію. Нарешті, випробовувану речовину почали наносити разом з екстрактом мишачої або щурячої печінки, що містить цитохром Р450 для активації про-мутагенов. Таким чином, тест-системи для виявлення генетичної активності можуть бути далі вдосконалені і в значній мірі генетичними методами. Із застосуванням тесту Еймса вперше були показані мутагенні ефекти: сигаретного попелу, деяких харчових консервантів, фарбників для волосся і так далі

Ріс.41. Схема демонстрації мутагенної активності хімічної сполуки - нитрозогуанидина в спот-тесте з використанням системи Б. Еймса: а - контрольна чашка Петрі, що містить середовище без гистидина і засіває культурою мутанта S. typhimurium His, не здатного синтезувати гистидин. Зростають тільки рідкісні спонтанні ревертанты His —*• His+. У центр поміщений кружок фільтрувального паперу, змочений розчинником, але що не містить мутагену; б - така ж чашка, в центр якої поміщений кружок фільтрувального паперу, змочений розчином мутагену. Навколо нього з'являється кільце індукованих мутантів - ревертантов His+.
Велика кількість хімічних сполук, які у міру їх появи необхідно перевіряти на генетичну активність, зумовила розробку простих, надійних і дешевих методів і тест-систем для скринінгу, або просіювання, великого числа з'єднань. Для виявлення мутагенів, в цих тест-системах використовуються різні об'єкти і різні критерії. В даний час генетична активність речовин визначається по наступних основних критеріях: 1) генним мутаціям — замінам, вставкам і випаданням пар нуклеотидов; 2) конверсії і 3) реципрокной, переважно митотической, рекомбінації; 4) нерозбіжності хромосом в митозе; 5) хромосомній аберації; 6) обмінам між сестринськими хроматидами. Крім того, застосовують такі критерії, як збільшення частоти домінантних леталей у дрозофилы і мишей і частоти аномальних сперматозоїдів у мишей. Останні два тести не можна строго віднести до генетичних, проте їх результати добре корелюють з рештою тестів, заснованих на критеріях пошкодження генетичного матеріалу.
Як об'єкти при масовому визначенні генетичної активності тих або інших чинників використовують культури кліток людини і тварин, вищі рослини, мікроорганізми, дрозофилу.
Антимутагенез. Це поняття включає такі дії на клітку і організм, які блокують або зменшують вірогідність виникнення мутацій. Подібні дії можуть стимулювати системи инактивации мутагенів або пригнічувати системи активації промутагенов, можуть стимулювати процеси безпомилкової репарації або безпосередньо модифікувати мутаген, «відволікати» його від генетичного матеріалу. Крім того, в організмі є спеціальні механізми, що знижують несприятливий ефект мутацій. По-перше, це здатність ДНК-полимеразы здійснювати корекцію дефектів (на основі комплементарності ланцюгів ДНК) при утворенні нових ланцюгів ДНК. Існує також спеціальний фермент — эндонуклеаза, що редагує структуру дочірніх ланцюгів ДНК. Певну роль в стабільності генотипу грає надмірність генетичного коду, а також диплоидность каріотипу соматичних кліток. Парність аллелей (диплоидный набір хромосом) перешкоджає прояву рецесивних мутацій. До зниження проявів шкідливих мутацій призводить наявність в генотипі декількох десятків або сотень копій генів (екстракопіювання генів), що кодують життєво важливі білки. Окрім цього існують спеціальні молекулярні механізми репарації.
Антимутагенною активністю володіють радіопротектори — з'єднання, здатні зменшувати летальний ефект іонізуючої радіації, перш за все серосодержащие амінокислоти: цистеин, цистин, метіонін і ін.
Зазвичай для кожного конкретного мутагену антимутагенна активність специфічна, що утрудняє пошуки антимутагенів. Генетичну активність N'-метил-N'-нитро-N'-нитрозогуанидина (МННГ) нейтралізує кров ссавців, в якій основним антимутагеном (анти-МННГ) служить гемин. Ненасичені жирні кислоти, тониновая кислота і катехин, що міститься в чаї і каві, деякі вітаміни, наприклад а-токоферол, і інші з'єднання володіють більшою або меншою антимутагенною активністю по відношенню до окремих мутагенів.
На жаль, різноманітність досліджених з'єднань і об'єктів така велика, що не представляється можливим робити які-небудь узагальнення про природу антимутагенних ефектів. Крім того, дослідники зазвичай не можуть контролювати різні етапи становлення мутації. Відсутні тест-системи, спеціалізовані для пошуку антимутагенів.
Звертаючись до проблеми зменшення генетичної небезпеки, слід пам'ятати, що людські популяції гетерогенні по багатьом ознакам, зокрема по реакції на різні дії зовнішніх чинників. Ця обставина вже враховує фармакогенетика, що вивчає реакцію різних груп людей на лікарські речовини. Відомо, наприклад, що у деяких хворих сульфаниламидные препарати викликають гемоліз. Це пов'язано із спадковою недостатністю глюкозо-6-фосфатдегидрогеназы. Є категорія людей із спадковою хворобливою реакцією на глюкокортикоїди. При застосуванні цих препаратів у них підвищується внутрішньоочний тиск. Нестабільність деяких форм мутантів гемоглобіну зв'язана з гемолізом при застосуванні окислювачів.
Відома також спадкова чутливість до дії деяких мутагенів і канцерогенів. Наприклад, люди з підвищеною активністю арилгидрокарбонгидроксилазы схильні до захворювань раком легенів у разі контакту з поліциклічними вуглеводнями, які після гидроксилирования вказаним ферментом перетворюються на эпоксиды, що володіють високою канцерогенною активністю.
Ці обставини необхідно враховувати в різних областях людської діяльності: при лікуванні хворих, при професійному відборі людей, що мають справу з різними виробничими вредностями.
Отже, заходи по забезпеченню генетичної безпеки людини пов'язані з вирішенням багатьох проблем, загальних для генетики і екології, і, перш за все охорона навколишнього середовища від забруднення. Генетична токсикологія робить при цьому головний акцент на генетично активні чинники.
Генератівниє і соматичні мутації. Залежно від «місця» мутації розрізняють: генеративные і соматичні мутації. Генератівниє — це мутації, що виникають в генетичному апараті генеративных кліток і передаються нащадкам при статевому розмноженні (наприклад, зміни каріотипу гаметоцитов при порушенні мейоза).
Ці мутації безпосередньо не позначаються на здоров'ї даної людини, але приводять до народження потомства із спадковими хворобами. Причинами мутацій в генеративных клітках є вищезгадані мутагенні чинники, а також різного роду порушення мейоза і кросинговера при гаметогенезе. Залежно від змін генотипу статевих кліток, а потім зиготы, мутації можуть бути генними, хромосомними і геномами.
Мутації геномів. Якщо в результаті якої-небудь події відбувається зміна числа хромосом в каріотипі, то говорять про мутації геномів. До них відносяться полиплоидия і гетероплоидия (анэуплоидия).
Поліплоїдія — збільшення числа хромосом в 2,3,4 і так далі разу в результаті додавання повних хромосомних наборів із-за порушень ділення. У полиплоидных організмів наголошується збільшення числа хромосом, кратне гаплоидному набору: Зп — триплоид, 4п — тетраплоид, 5п — пентаплоид, і так далі У рослин полиплоиды життєздатні і деякі володіють підвищеною врожайністю (крупніше листя, стебла, коренеплоди, плоди, квітки).
Поліплоїдія у людини є летальною мутацією. Наприклад, триплоидия у людини (69 хромосом) є досить частою спонтанною мутацією набору хромосом в эмбриогенезе. Але більшість таких зародків гинуть на першому місяці розвитку. До 6-7 місяця розвитку дожинає 1 %, що зазвичай закінчується спонтанними абортами. Іноді такі діти (синдром триплоидии-69, XXY) народжується, але живуть тільки 5-7 днів. Такі діти мають численні пороки розвитку: головного мозку, серця, шлунково-кишкового тракту і ін. Причинами полиплоидии є наслідки дії мутагенних чинників, внаслідок чого в клітках може спостерігатися эндомитоз — подвоєння хромосом, але без подальших ділень клітки. В результаті цього відбувається кратне збільшення хромосомних наборів кліток.
Гетероплоїдія (анэуплоидия). Унаслідок порушень складних молекулярних процесів мейоза число хромосом в гаметах може змінюватися. Якщо такі гаметы беруть участь в заплідненні, то утворюються аномальні зиготы. Якщо яка-небудь з хромосом в каріотипі організму опиняється в потрійному наборі, то це називається трисомией (2п+1), а такий організм називається трисомиком. Трісомія відома у багатьох видів рослин і тварин, а також у людини. У людини описані трисомии для 8,9,13,14,18,21, X і Y. Трісомії тільки по 21 і Х-хромосомам життєздатні, всі інші приводять до загибелі в перші дні після народження. Полісомія по Х-хромосоме може доходити до п'яти із збереженням життєздатності. Приклади трисомии по аутосомах людини: по 21-ій хромосомі — синдром Дауна 47 +21; по 18-ій хромосомі — синдром Едвардса; 47 +18; по 13-ій хромосомі — синдром Патау 47,+13. Приклад анеуплоїдії по статевих хромосомах: синдром Клайнфельтера 47, XXY (але може бути XXXY, XXYY і інші зміни числа хромосом). При цьому люди найчастіше або нежиттєздатні, або відрізняються зниженою життєздатністю і поряд патологічних ознак.
Якщо в результаті порушення ділення одна з хромосом втрачається (2п—1), то це явище називається моносомією, а організм моносомным. Анеуплоїдія виникає в результаті нерозбіжності гомологичных хромосом при мейозе. Якщо відсутні дві різні хромосоми, то організм є подвійним моносомиком (2п—2). Моносомики людини зазвичай нежиттєздатні. Вважається, що близько 20 % моносомій закінчується летально, ще в перші дні ембріонального розвитку, останні гинуть на пізніших стадіях. Єдиним прикладом життєздатної моносомії у людини є синдром Шерешевського—тернера — 45, Х0.
Мутації геномів завжди виявляються фенотипически і підтверджуються цитогенетичними методами. Таким чином, анэуплоидии, тобто порушення нормального числа хромосом, приводять до смерті, різним патологіям або до зниження життєздатності організму.
Соматичні мутації. Це мутації, що відбуваються в генетичному апараті соматичних кліток і виявляються тільки у самої особини (наприклад, рак шкіри під дією ультрафіолетових променів). Вони не передаються нащадкам, але можуть передаватися дочерним кліткам і зробити істотний вплив на розвиток якого-небудь з ознак організму. Вони викликають генетичні хвороби соматичних кліток. Генетичні хвороби соматичних кліток виділені в окрему групу спадкової патології недавно. Приводом для цього послужило виявлення при злоякісних новоутвореннях специфічних хромосомних перебудов в клітках, що викликають активацію онкогенов (ретинобластома, пухлина Вільмса). Ці зміни в генетичному матеріалі кліток є этиопатогенетическими для злоякісного зростання і тому можуть бути віднесені до категорії генетичної патології. Вже є перші докази того, що спорадичні випадки вроджених вад розвитку є результатом мутацій в соматичних клітках в критичному періоді эмбриогенеза. Отже, такі випадки можна розглядати як генетичну хворобу соматичних кліток.
Мабуть, що аутоіммунні процеси і старіння можуть бути віднесені до цієї ж категорії генетичної патології.
