
- •Передмова
- •Частина 1. Молекулярні основи спадковості
- •Введення в молекулярну біологію.
- •1.2. Макромолекули як обьекты вивчення молекулярної біології
- •1.2.2. Будова, функції і властивості днк.
- •Молекулярна організація генів.
- •Рнк і її роль в збереженні і реалізації спадкової інформації.
- •Лікарські засоби, що впливають на синтез нуклеїнових кислот і білків.
- •1.3. Експресія генів і її регуляція
- •1.4. Організація геномів неклітинних і клітинних організмів
- •Геном бактерій
- •Організація генома эукариот.
- •Частина 2. Молекулярні основи спадкових захворювань
- •2.1. Молекулярні механізми генних, хромосомних і геномів мутацій
- •2.2. Регуляція клітинного циклу. Апоптоз. Онкогенетика.
- •Частина 3. Сучасні питання генних технологій
- •3.1 Дослідження нуклеїнових кислот. Методи днк-діагностики
- •3.2 Методи генної інженерії
- •3.3 Клонування організмів і кліток.
- •Додатки контрольно-повчальні питання
- •Відповіді на контрольному – повчальні питання
- •Термінологічний словник
- •Література
3.2 Методи генної інженерії
Поняття про генну інженерію. Рекомбінантниє ДНК, принципи їх конструювання. Клонування фрагментів нуклеїнових кислот in vivo. Визначення по нятия вектора в біології. Вектори: плазмиды, бактеріофаги, космиды, штучні хромосоми. Методи пошуку специфічної рекомбинантных ДНК. ДНК-бібліотека геномів, бібліотеки кДНК.
Трансгенні організми. Принцип конструювання трансгенних організмів. Трансгенні бактерії. Головні напрями застосування в народному господарстві і медицині. Рекомбінантниє лікарські препарати. Трансгенні рослини. Головні напрями використання трансгенних рослин. Трансгенні тварини як моделі захворювань і біореактори. Проблеми екологічної безпеки.
Генна терапія. Принципи генної терапії. Генотерапія ex vivo і in vivo. Вірусні і невірусні вектори в генотерапии. Перспективи і обмеження генної терапії. Генні вакцини. Генна терапія в онкології.
Генна інженерія. Технологія рекомбинантных ДНК. Генна інженерія виникла в 1972 році, в Станфордськом університеті, в США. Тоді лабораторія П. Берга отримала першу рекомбинатную (гібридну) ДНК або рекДНК. Вона сполучала в собі фрагменти ДНК фага лямбда, кишкової палички і мавпячого вірусу SV40.
На початку 1970-х молекулярні біологи розробили принципово нові технології, засновані на відкриттях в області біохімії і молекулярної генетики. Це надало величезні можливості маніпулювання генетичним матеріалом. Нові підходи і методи отримали назву «Технології рекомбинантных ДНК», часто звані «генною інженерією». Ці технології революціонізували біологію і зробили величезний вплив на медицину. З їх допомогою можна проводити обмін генетичною інформацією між хромосомами, створюючи нові геноми. Наприклад, можна отримувати трансгенні організми, бактерії, экспрессирующие гени людини, проводити генну терапію людини і ін. Таким чином, генна інженерія — це розділ молекулярної генетики, що використовує різні методи маніпуляцій з нуклеїновими кислотами (технології рекомбинантных ДНК) для цілеспрямованої зміни генетичних програм і створення нових генотипів. Генна інженерія складається з наступних основних етапів: а) отримання генетичного матеріалу, що містить потрібні гени; б) включення цих генів в автономну генетичну систему (вектор), здібну до реплікації і вбудовування в чужий геном; у) введення цієї системи в реципиентную клітку, де нові гени входять до складу ДНК. На вказаних етапах використовується багато молекулярно-генетичних підходів і методів. Розглянемо деякі з них.
Генетичний матеріал можна отримувати двома способами: шляхом хімічного синтезу і шляхом ферментативной рестрикції ДНК.
Хімічний синтез ДНК здійснюється з нуклеотидов в спеціальних умовах (рис.55 А) на основі повністю розшифрованою нуклеотидной

Ріс.55. Схеми шляхів синтезу генетичного матеріалу
А - синтез з нуклеотидов; Би - синтез на основі зворотної транскрипції мРНК: 1 - отримання мРНК з кліток; 2 — зворотна транскрипція; 3 — утворення двухцепочечной кДНК
послідовності певної ділянки ДНК. Штучний ген аланиновой тРНК був вперше синтезований Г. Кораной в 1970 р. Цей ген складався з 77 пар нуклеотидов, але не мав регуляторних відділів і тому не функціонував. Опісля декілька років Корану синтезував ген тирозиновой тРНК, промотор, що містить, і терминатор. Цей ген, введений бактеріям, функціонував як натуральний. В даний час синтезовано вже багато різноманітних генів.
Синтез деяких генів можна проводити також за допомогою мРНК і ферментів зворотної транскрипції (рис.55 Би). У певних умовах на матриці мРНК за допомогою спеціальних ферментів ревертаз синтезується комплементарний ланцюг ДНК. Потім на ній як на матриці утворюється другий ланцюг ДНК. Така штучно отримана молекула називається ДНК-копією або кДНК.
Рестрикція ДНК— це процес «розрізання» молекул ДНК прокариот і эукариот спеціальними ферментами, що дозволяє отримувати ділянки, що містять певні гени.
Одним з найважливіших інструментів генної інженерії є эндонуклеазы — ферменти, що розщеплюють ДНК по специфічних послідовностях нуклеотидов усередині ланцюга. Ці ферменти отримали назву рестриктаз. Рестріктази розщеплюють ДНК на відносно невеликі фрагменти в ділянках строго певних послідовностей (рис.56). Цим їх дія відрізняється від більшості інших ферментативных, хімічних або фізичних дій, що приводять до випадкових розривів ланцюгів ДНК. Рестріктази (вже відкрито більше 200 типів ферментів цього класу) є

Ріс.56. Схема рестрикції ДНК (А) і утворення рекомбинантной (химерною) ДНК (Б): 1. Рестріктази розпізнають певні нуклеотидные послідовності ДНК і «розрізають» її в місцях, позначених стрілками. 2. Фрагмент початкової ДНК з «липкими кінцями», готовими до комплементарної взаємодії. 3. Фрагмент «чужої» ДНК, отриманий також після рестрикції тим же видом рестриктаз. 4. Рекомбінантная (химерна) ДНК, що складається з «своїх» і «чужих» генів
частиною захисної системи бактерій, що охороняють власний геном від чужорідної, головним чином вірусної ДНК. Рестріктази прийнято іменувати по назві бактерій, з яких їх виділяють. Так, назва ECORI свідчить про те, що цей фермент з Esherichia coli. Ватн1 — з Bacillus amilolquefacientsi. Кожен фермент дізнається певну 4-7-членную послідовність в двухцепочечной ДНК. Розрізання ДНК по цих сайтах приводить до утворення або «тупих» (наприклад, при дії рестриктаз Hpal), або «липких», тобто що перекриваються (наприклад, Ватн1), кінців. Для конструювання гібридних молекул особливо зручні липкі кінці (рис.56). Будь-який фрагмент ДНК володіє характерним розташуванням сайтів пізнавання різних рестриктаз, що дозволяє будувати так звані рестриктазные карти. При розщеплюванні ДНК який-небудь одним рестриктазой отримують суміш фрагментів, кожен з яких має одні і ті ж кінцеві ділянки. Такі фрагменти можна розділити і ідентифікувати методом электрофореза в агарозном або полиакриламидном гелі.
Біологічні вектори: (плазмиды, бактеріофаги, космиды, штучні хромосоми).
Вектор — це щось ніби молекулярного «таксі», здатного переносити чужу ДНК всередину клітки-господаря так, щоб вона там могла реплицироваться.
Вектор, що включає фрагменти чужорідної ДНК, повинен проникати в реципиентные клітки, вибрані для клонування гена. Ці клітки можуть бути як про-, так і эукариотическими. Найчастіше для цієї мети використовують бактерії, оскільки їх легко отримувати у великій кількості. Вбудовані в плазмиды чужі гени передаються в клітку господаря шляхом трансдукции і вбудовуються в їх геном, де здібні до швидкої реплікації за допомогою ферментів клітки-господаря. Процес швидкого отримання великої кількості однакових копій молекул називається клонуванням. Клон — це велика популяція ідентичних молекул, кліток, організмів, отриманих від одного предка. Шляхом клонування вектора в реципиентных клітках можна забезпечити отримання великої кількості потрібного гена у високоочищеному вигляді або великої кількості білка, що кодується даним геном. У геном тварин фрагменти чужої ДНК вводять шляхом мікроін'єкції безпосередньо в ядро клітки.
Існує два основні типи векторів: бактерійні плазмиды і бактеріофаги.
Бактерійні плазмиды — це невеликі кільцеві молекули двухцепочечной ДНК, у функції яких входить, наприклад, забезпечення стійкості до антибіотиків. Плазміди володіють декількома властивостями, які роблять їх надзвичайно зручними для використання як вектори. Зокрема в бактерійній клітці вони можуть існувати в безлічі копій, можуть реплицироваться незалежно від господарської ДНК. Для багатьох плазмид відома повна нуклеотидная послідовність. Це робить можливою точну локалізацію сайтів рестрикції для клонування фрагментів ДНК. Плазміди значно менше господарської хромосомної ДНК і тому можуть бути легко відокремлені від неї. Клонований фрагмент легко виділяється з рекомбинантной плазмиды за допомогою її розщеплювання тієї ж рестриктазой.
Бактеріофаги зазвичай містять лінійну ДНК, в яку можуть бути вбудовані фрагменти чужорідної ДНК по якому-небудь з доступних сайтів рестрикції. Основною перевагою фаговых векторів перед плазмидными є те, що в них вдається вбудовувати в 2-3 рази крупніші фрагменти «чужої» ДНК.

Ріс.57. Схема основних етапів і методів генної інженерії:
1 — отримання ДНК з ядер; 2 — рестрикція ДНК на фрагменти (фрагмент 6 містить ген, що цікавить нас); 3 — розділення фрагментів за допомогою электрофореза; 4 — ідентифікація фрагмента, що цікавить нас, методом гібридизації із спеціальним ДНК-зондом; 5 — виділення потрібного фрагмента; 6 — синтез потрібного фрагмента; 7 — клонування фрагментів методом ПЦР; 8 — включення фрагмента ДНК в плазмиду (вектор); 9 — введення плазмиды в бактерію; 10 — введення фрагмента ДНК безпосередньо в ядро клітки реципієнта; 11 — рестрикція плазмиды; 12 — включення в плазмиду фрагмента ДНК
Необхідні гени вирізуються з хромосом тварин, інкубуються з плазмидами або фагами, які також розрізають спеціальними рестриктазами (рис.56 і 57). Через деякий час фрагменти різної ДНК з'єднуються відповідно до принципу комплементарності і ДНК плазмиды відновлює початкову кільцеву форму. Так можна сполучати відрізки ДНК, отримана з різних кліток і створювати комбінації різноманітних генів в одній молекулі. Для з'єднання ділянок ДНК застосовують лигазу — один з ферментів репарації. Процес ковалентного з'єднання «липких» кінців фрагментів ДНК називають «лигированием». Використовуючи різні рестриктазы і лигазы, можна розрізати і зшивати нитку ДНК в різних місцях і отримувати різноманітні рекомбинантные (химерні) молекули.
Косміди. Вектори, звані космидами, можуть включати до 40 тисяч пар нуклеотидов чужорідної ДНК і при цьому активно амплифицироваться в Е. coli як плазмиды. Косміди обьединяют в собі властивості плазмидных векторів і векторів на основі фага л. Наприклад, широко вживана космида pLFR-5 (приблизно 6 тисяч пар нуклеотидов) має два cos-сайта фага л, крапку почала реплікації ДНК і ген стійкості до тетрацикліну. Ця космида може інтегрувати чужорідну ДНК, довжина якої до 40 тисяч пар нуклеотидов.
Опинившись в бактерійній клітці, лінійна молекула pLFR-5 зі вставкою замикається в кільце завдяки спаровуванню cos-сайтов. У такій стабільній конфігурації вона може довгий час існувати в клітці і реплицироватся як гібридна плазмида, оскільки містить всі необхідні для цього елементи. Більш того, ген стійкості до тетрацикліну забезпечує зростання колоній, що несуть дану космиду, на середовищі з цим антибіотиком; трансформовані клітки при цьому гинуть. Існують і інші космидные вектори на основі фага л.
Косміди мають велику перевагу в порівнянні з плазмидами: у них можна вбудовувати довші фрагменти ДНК, а це означає, що для створення бібліотеки генома потрібне менше число клонів і буде потрібно менше часу на їх скринінг.
Векторні системи, здатні інтегрувати крупні вставки (>100 тисяч пар нуклеотидов) мають велику цінність
при аналізі складних эукариотических генів. Без таких векторів не обійтися, наприклад, при картировании генома людини. На відміну від бібліотек з невеликими вставками найчастіше буде представлений весь генетичний матеріал організму. Крім того, в цьому випадку зменшується число клонів, яке потрібно підтримувати, і збільшується вірогідність того, що кожен з генів буде присутній в «своєму» клоні.
Штучні хромосоми. Для клонування фрагментів ДНК розміром від 100 до 3000 тисяч пар нуклеотидов був сконструйований низкокопийный плазмидный вектор на основі бактеріофага Р1. Це химерна конструкція, звана штучною хромосомою. Був створений також дуже стабільний вектор, здатний інтегрувати вставки довжиною від 150 до 300 тисяч пар нуклеотидов, на основі F- плазмиды E.coli, яка представлена в клітці однією або двома копіями з селекційною системою lac Z - ця конструкція називається бактерійною штучною хромосомою.
Штучні хромосоми містять три основні елементи: кінцеві ділянки (теломеры), центромеру і точки ініціації реплікації. Властивості теломерных областей хромосом людини добре вивчені, чого не можна сказати про центромерах і точки ініціації реплікації. Існували побоювання, що штучні хромосоми не вдасться сконструювати, поки не будуть досконально вивчені всі її елементи. Проте вже отримані і підтримуються в трансфицированой культурі кліток стабільні, лінійні, штучні хромосоми людини (мікрохромосоми), ДНК повторів (завдовжки близько 1 мільйона пар нуклеотидов), центромерной області, високомолекулярних фрагментів ДНК генома і теломерных ділянок, що складається з множини. У їх центромерную область був вбудований ген стійкості до неоміцину, що дозволило використовувати середовище З 418 як селективна.
Дві з трьох мікрохромосом були отримані «усіканням» існуючої хромосоми. У одному випадку початкова центромера була збережена, а в іншому замінена трансфицированой центромерной областю. Третю, повністю штучну мікрохромосому отримали лигированием in vitro три трансфицированных ДНК-елементу. Ясно, що створення штучної хромосоми людини, що містить «терапевтичні» гени, цілком реально. Основною проблемою стане доставка цієї величезної молекули ДНК в ядро клітки-мішені. Окрім, того, експресія генів, що входять до складу ДНК-блоку, з якої побудована штучна хромосома, може надавати шкідливу дію на клітки-мішені. Спершу в тканині пацієнта можна спробувати імплантувати інкапсульовані клітки з штучними хромосомами. Зовсім недавно ученими були створені лентивирусные вектори. Вони широко використовуються при генетичних захворюваннях, оскільки їх структура допускає перенесення великих генів, наприклад генів гемоглобіну, чинників згортання VIII, IX і інших. Головна перевага лентивирусных векторів перед іншими ретровірусами - в можливості інтеграції в геном всіх кліток. Це особливо важливо для перенесення генів в примітивні стволові кровотворні клітини, оскільки основна маса останніх знаходиться поза клітинним циклом, а мобілізація в цикл істотно позначається на пролиферативном потенціалі і долі стволових кровотворних клітин при трансплантації.
Бібліотеки геномів і кДНК бібліотеки. Підібравши відповідні умови рестрикції і клонування можна добитися того, що в наборі клонованих фрагментів міститимуться практично всі гени даного генома. Такі колекції клонів, отримані від конкретного генома, називають «бібліотеками» геномів. Бібліотека генома готується з тотальної ДНК клітинної лінії або тканини.
На відміну від бібліотеки генома, бібліотека кДНК готується з мРНК тканини. Бібліотека кДНК також складається зі всіх генів даного генома готується у декілька етапів. Спочатку виділяють тотальну мРНК тканини. Потім за допомогою зворотної транскриптазы і ДНК-полимеразы проводять зворотну транскрипцію мРНК в двухцепочечную ДНК (кДНК). Вказані «бібліотеки» використовуються для вивчення нуклеотидной послідовності, локалізації генів, їх структури і патології.
Трансгенні організми. Принцип конструювання. Трансгенез - штучне перенесення гена або групи генів з одного організму в іншій і створення умов для его/их экспресии (тобто вирази: транскрипції, трансляції, що приводять до появи в клітках організму-реципієнта біологічно активного генного продукту). Основою для розвитку дослідницьких робіт по міжвидовому транспорту генів послужили серйозні досягнення останніх десяти років в області генної інженерії - тобто технології маніпулювання з рекомбинантной ДНК.
Його мета — отримання організмів з новими ознаками, зміна спадковості складних багатоклітинних організмів. Такі організми називають трансгенними. Для трансгенеза використовують декілька методичних прийомів — інтродукція генів в ізольовані клітки реципієнта з подальшою ретрансплантацией цих кліток, ін'єкція гена безпосередньо в організм реципієнта, інтродукція клонованих генів в геном ембріона на ранніх стадіях розвитку. Найчастіше використовують останній метод. При цьому з материнського організму (наприклад, миші) беруть тільки що запліднену яйцеклітину. У зону чоловічого пронуклеуса шляхом ін'єкції вводять клоновані гени, потім самкам пересаджують ембріони, які розвивалися в культуральних середовищах. При цьому досягається досить високий рівень імплантації і народження повноцінних мишей. В процесі трансгенеза відбувається вбудовування нового гена в геном зародка. Внаслідок цього отримують тварин з новим геном і вони забезпечують передачу його наступному поколінню шляхом статевого розмноження. Слід також враховувати, що введений ген зазвичай вбудовується в одну з гомологичных хромосом, тому трансгенними будуть не всі нащадки. Здійснено успішне перенесення в геном миші гена гормону зростання людини. Маса трансгенних мишей і їх нащадків була в 1,5-2 рази більше. Нині широко ведуться дослідження по отриманню трансгенних кроликів, овець, птаха, свиней. Швидкими темпами розробляються методи створення трансгенних тварин, які можуть синтезувати деякі препарати (інсулін, інтерферон, чинники згортання крові, гормони, незамінні амінокислоти).
У перспективі є можливість отримувати так званих трансгенних тварин, до зиготу яких буде внесено декілька генів (политрансгенные тварини). Але при цьому виникає небезпека руйнування еволюційно збалансованого генома тварин.
Введення генів в клітки і їх експресія. Після розчинення захисної оболонки протеолітичними ферментами з яйцеклітиною можна проводити різні маніпуляції і вводити в неї мікрокількості нуклеїнової кислоти. Яйцеклітину діаметром близько 0,1 мм поміщають на кінець мікропіпетки, і експериментатор за допомогою мікроскопа і скляного капіляра із зовнішнім діаметром не більше декількох десятків мікрон вводить в яйце декілька пиколитров (10-12 пл.) чужих фрагментів ДНК. Ін'єкція — найбільш відповідальний етап експерименту, оскільки у цей момент можна нанести значні пошкодження яйцю або ембріонові. Якнайкраща інтеграція і експресія генів досягається при ін'єкції в чоловічій пронуклеус, що дозволяє звести до мінімуму пошкодження ооцита, оскільки пронуклеус розташовується поблизу його мембрани. Таким чином, вдається добитися включення одного або декількох генів в геном ембріонів ссавців. Ці гени можуть экспрессироваться і передаватися нащадкам. Слід підкреслити деякі складнощі і неясності, з якими пов'язана ця процедура. Процес інтеграції генів в геном кліток ссавців є маловивченим. Як показали дослідження, ця інтеграція відбувається випадковим чином і не пов'язана з конкретною ділянкою хромосоми. Інша складність обумовлена нестабільністю кліток, в які вводиться ген (або гени), де він може бути загубленим, видозміненим або неактивним. Активність генів визначається не тільки послідовностями нуклеотидов, які забезпечують транскрипцію генів з утворенням мРНК, але також іншими послідовностями нуклеотидов, які стоять віддалено від власне гена. Для досягнення повної експресії гена ці послідовності необхідно вводити разом з ним.
Трансгенні бактерії. У різних сферах господарської діяльності людини використовуються трансгенні бактерії. Крім того, що бактерії використовуються для клонування генів і виробництва білка, вони реконструюються і для інших цілей.
Так, біоінженерні бактерії використовуються для оздоровлення рослин. Бактерії, що живуть в рослинах і стимулюють утворення шматочків льоду, були змінені з холод-плюс на холод-мінус рослини. Такі бактерії почали захищати вегетативні частини рослин від морозу. У бактерій, що утворюють симбіоз з корінням кукурудзи, були введені гени (від інших бактерій), що кодують токсин для шкідливих комах.
У природі існують бактерії, що можуть розщеплювати будь-яку органічну речовину. Бактерії відбираються за здатністю розщеплювати певну речовину, а потім ця здатність посилюється під час біотехнології. Таким шляхом були утворені бактерії, які поїдають нафту, що розлилася під час техногенних катастроф.
Бактерії використовують для бактерійного синтезу. Так, були реконструйовані бактерії для виробництва амінокислоти фенилаланина.
Широке використання рекомбинантных бактерій в сільському господарстві, промисловості, захисту навколишнього середовища обмежувалося тим, що такі бактерії можуть замінити природні мікроорганізми в екосистемах з виникненням несприятливих наслідків. На сьогоднішній день розроблені методи визначення, вимірювання і навіть блокування діяльності цих кліток в навколишньому середовищі.
Рекомбінантниє лікарські препарати. Серед багатьох досягнень генної інженерії, що отримали застосування в медицині, найбільш значне отримання людського інсуліну в промислових масштабах. Генні інженери як перше практичне завдання вирішили клонувати ген інсуліну. Клоновані гени людського інсуліну були введені з плазмидой в бактерійну клітку, де почався синтез гормону, який природні мікробні штами ніколи не синтезували. Починаючи з 1982 року в США, Японії, Великобританії і інших країнах проводять генно-інженерний інсулін. З 1000 літрів бактерійної культури отримують приблизно 200 г інсуліну, що рівне кількості, що отримується з 1600 кг підшлункової залози тварин. Паралельно була вирішена проблема імунологічної поразки організму діабетиків тваринним інсуліном.
Більше двадцяти фірм Японії і декількох американських фірм розробляли інший дуже важливий медичний препарат- інтерферон, який ефективний при різних вірусних захворюваннях і злоякісних новоутвореннях. Першим з цих з'єднань на ринок поступив альфа-интерферон, потім бета-інтерферон.
Ще один ефективний протираковий препарат - інтерлейкін проводиться в Японії і США. Цікаво відзначити, що сьогодні американський ринок медичних препаратів, отриманих методами генної інженерії, порівнянний з такими масовими ліками, як антибіотики.
Трансгенні рослини. На початковому етапі розвитку дослідницьких робіт по трансгенезу у эукариотических організмів однієї з основних проблем був пошук і конструювання векторів-носіїв для перекидання «корисних» генів. Зараз ця проблема в значній мірі вирішена, що дало серйозний імпульс розповсюдженню трансгенних маніпуляцій з рослинами і тваринами. Відносно рослин найбільш використовуваними векторами - носіями є Ti (tumor inducing) і Ri (root-inducing) плазмиды, виділені з бактерій, здатних утворювати з вищими рослинами складні симбиотические асоціації. Ti плазмиды містять у складі своєї ДНК так звані Т-участки (від англійського transfer - перенесення), здатні вбудовуватися в ядерний геном деяких рослин. Вбудовування в Т-участок потрібного гена перетворює Ti-плазмиду на вектор - носій для трансгенних маніпуляцій. Необхідно також відзначити, що генна інженерія і трансгенез у рослин можуть зачіпати не тільки ядерний спадковий матеріал, але і ДНК хлоропластів і мітохондрій. Так, в мітохондріях кукурудзи були виявлені плазмиды S-1 і S-2, що відкриває певні можливості для введення туди чужорідних генів.
В результаті детального вивчення молекулярно-генетичних основ пухлинного зростання у рослин за участю бактерій роду Agrobacterium виявилось, що опухолеобразующие плазмиды агробактерий (Ti - tumor inducing, що індукує пухлину), що є міні-кільцевою ДНК, є природною векторною системою, яку зараз використовують для перенесення генів в рослини. Плазміда агробактерии, яка складає 12-22 тис. пар підстав, переносить частину своєї ДНК в ДНК рослинної клітки, в яку вбудовується «потрібний» ген. Вона кодує ферменти синтезу фитогормонов і опинов - похідних амінокислот, які використовуються бактерією як джерело вуглецю, азоту і енергії.
За допомогою цього унікального вектора вже отримано велике число трансгенних рослин. Важливо також те, що методи генної інженерії зараз використовують не тільки в практиці, це найважливіша методологія для пізнання фундаментальних основ організації і функціонування рослинного генома.
Перенесення Т-ДНК з бактерії в цитоплазму рослинної клітки здійснюється за 30 мин.
Впровадження Т-ДНК в рослинний геном є багатоступінчатим процесом. У геном рослини можуть вбудовуватися декілька копій Т-ДНК. Після вбудовування в хромосому Т-ДНК стає звичайною частиною генома рослини. Т-ДНК транскрибируется в рослинних клітках РНК-полімеразой II рослини-господаря. Транськріпти мають особливості эукариотических матриць. Сама бактерія в клітку не проникає, а залишається в міжклітинному просторі і використовує рослинні клітки з вбудованою Т-ДНК як фабрику, що продукує опины -источник азоту і вуглецю.
Т-ДНК Ti-плазмид володіє двома властивостями, що роблять її по суті ідеальним вектором для введення чужорідних генів в клітки рослин.
По-перше, круг господарів агробактерий дуже широкий: вони трансформують клітки практично всіх дводольних рослин. Відомо, що можна добитися зараження однодольних, зокрема злаків.
По-друге, інтегрована до складу генома рослини Т-ДНК успадковується як простій домінантна ознака відповідно до законів Менделя, а її гени мають власні промоторы (регуляторна область гена, що визначає час і місце його експресії), під контролем яких можуть экспрессироваться вставлені в Т-ДНК чужорідні гени.
Простий спосіб введення Т-ДНК в клітки рослини полягає в тому, щоб заразити його A. tumefaciens, що містить відповідну Ti-плазмиду, і надати подальше природному ходу подій. В цілому ідеальна векторна система на основі Ti-плазмиды винна:
містити всі сигнали, необхідні для перенесення і стабільної інтеграції в ядерну ДНК рослин; систему для експресії чужорідних генів в рослинах (впізнанний рослинними полимеразами промотор), маркер, який необхідний для селекції трансформованих кліток;
не містити онкогенов, тобто генів, які пригнічують диференціювання рослинних кліток. Другий пункт досягається за допомогою транспозонного мутагенезу.
В результаті введення транспозона в Т-ДНК можна вимкнути гени, які приводять до опухолеобразованию, що не відбивається на механізмі перенесення Т-ДНК. Зазвичай використовують бактерійні транспозоны (Тп 5, Тп 7).
Крім того, при конструюванні векторних молекул повинна бути передбачене наявність промоторов, що працюють в рослинах. Промотор (ділянка, до якої приєднуються РНК-полімерази) повинен володіти набором властивостей, а саме: силою (активною експресією), можливістю регуляції, ткане- і органспецифической експресією. Так, наприклад, до регульованих промоторам відноситься промотор генів білків теплового шоку (генів, активність яких індукується при підвищеній температурі), а тканеспецифичная експресія характерна для генів, контролюючих синтез запасних білків, наприклад зеина, який виявлений тільки в тканинах насіння злаків. Найбільш популярним є промотор гена вірусу мозаїки цвітної капусти 12 (CAMV). Гени, підшиті до такого промотору, активно экспрессируются у всіх тканинах.
Нарешті, у векторі повинні бути передбачені маркери, за допомогою яких можливий відбір трансгенних рослин. У літературі маркерні гени ще називають репортерными. Їх достатні багато. Наприклад, luxA і luxB -это гени, виділені з ДНК світляків. Вони контролюють синтез люциферазы, яка забезпечує перехід люцефиринов з окисленої форми в основну, що і забезпечує свічення. Останнім часом користується популярністю інший репортерный ген - pgfp, який контролює синтез GFP-белка (green fluorescent protein). Цей ген був виділений з ДНК медузи Acquorea victoria. Трансгенні рослини з цим геном світяться в ультрафиолете зеленим світлом.
Традиційний спосіб трансформації рослинних кліток за допомогою Т- ДНК полягає в нанесенні агробактерий, що містять Ti-плазмиду, на спеціально пошкоджену втечу. Зараз використовують широкий арсенал методів для отримання трансгенних рослин. Створений навіть спеціальний прилад -«Shotgun», який стріляє найдрібнішими вольфрамовими кульками, одягненими в молекули ДНК, здійснюючи, таким чином, трансформацію рослинних кліток.

Ріс.58. Генетична колонізація вищої рослини бактерією A. tumefaciens: 1 - A. tumefaciens існує в ризосфере (кореневій сфері) рослини; 2 - в клітках бактерії разом з її хромосомою існує Тi-плазмида; 3 - Ti-плазмида проникає в клітку рослини, і частина її (T-ДНК) вбудовується в геном рослини; 4 - це приводить до утворення пухлини - корончатого галла і синтезу опинов
Експериментатори розглядають грунтову бактерію як природного геноинженера. Довелося тільки обеззброїти її: опухолеиндуцирующую область плазмиды видалили і замінили на штучно сконструйований вектор, в який включений вибраний чужий ген, переносимий в ядерний геном рослин. Слід зазначити, що всі трансгенні рослини отримані на основі схеми агробактериального перенесення (рис.58). Проте вона ефективна лише для дводольних рослин. Для однодольних, в основному злакових рослин, розроблені інші способи перенесення генетичних конструкцій, з них частіше використовується балістичний - за допомогою установки під назвами «Генна гармата», або «дробовик». На мікрочастинки золота або вольфраму поміщається ДНК-вектор і під тиском «вистрілюються» в рослинні клітки.
Зараз розробляється отримання так званих їстівних вакцин. Цим займаються багато лабораторій в світі, але поки на експериментальному рівні. На перших етапах роботи отримані трансгенні рослини тютюну і люцерни з геном Р-интерферона людини, дуже могутнього імуногенного чинника. Потім приступили до створення трансгенних рослин тютюну і люцерни з генами імуногенних білків мікобактерій, що викликають туберкульоз, і з генами оболонки вірусу гепатиту В. Прі експресії подібних генів в рослинах, які з'їдають тварини, в їх організмі передбачається отримати імунну відповідь з утворенням антитіл на продукований антиген. Іншими словами, буде проведена природна вакцинація по стійкості до захворювання туберкульозом або гепатитом Ст. В цьому і полягає сенс створення їстівних вакцин.
В даний час у 120 видів рослин існують трансгенні форми. Дозволено використання трансгенних сої, кукурудзи, бавовни, рапсу, картоплі, томатів, буряка, гарбуза, тютюну, папай, льону; закінчуються випробування трансгенного рису і пшениці. Трансгенні рослини вирощуються в 11 країнах світу - США, Китаї, Аргентині, Канаді, Австралії, Мексиці, Іспанії, Франції, Південній Африці, Португалії і Румунії. У 2000 р. під ними була зайнята площа близько 40 млн. га.
З використанням трансгенних рослин були вирішені такі проблеми, як гербицидоустойчивость, стійкість до комах, до вірусів, до грибкових і бактерійних захворювань, регуляція термінів дозрівання, підвищення загальної продуктивності, їстівні вакцини. Сьогодні вирощується 71 % трансгенних рослин, стійких до гербіцидів, 22% - до шкідників і 7% - до гербіцидів і шкідників (в основному соя, кукурудза, бавовна, рапс). Йде пошук підходів до різкого підвищення продуктивності рослин.
Ведуться роботи за освітою біоінженерних рослин, які могли б мати наступні особливості: 1) високу приспособительность до умов зовнішнього середовища; 2) вміщати більшу кількість необхідних для людини живильних речовин; 3) довгий час збережуться.
Розробляються трансгенні рослини, які здатні продукувати на користь людини хімічні речовини і ліки. Реконструйовано картоплю для продукції Альбуміну людини. Передбачається, що в майбутньому рослини зможуть утворювати в своєму насінні такі білки, як гормони людини.
Трансгенні тварини як моделі захворювань і біореактори. Трансгенних тварин, чиї клітки проводять потрібні білки, можна називати біореакторами. Від них можна отримувати потомство, тобто процес відтворюється з покоління в покоління.
Створення трансгенних тварин починається з «зшивання» двох генів, кожен з яких клонований окремо. Один ген кодує потрібний білок, інший узятий із залози або іншого органу, який проводитиме цей білок. Наприклад, якщо білок продукується з молоком, то специфічними органними генами будуть гени з молочної залози.
Гібридна ДНК ін'єктується в запліднену яйцеклітину або в ембріон. Приблизно у 5—10% випадків ДНК вбудовується в геном. Всі яйцеклітини підсаджують в самок, а тварин, що народилися, перевіряють на присутність гібридного гена. Від «тварини-засновника» отримують потомство і створюють стадо.
Одним з прикладів живих біореакторів є свиня, продукуюча НЬ (гемоглобін) людини. «Сконструйована» вона в 1991 р. Близько 15% еритроцитів свині містять людський гемоглобін. Його можна відокремлювати від свинячого за допомогою препаративных методів. Такий НЬ не містить вірусів людини. Проте в окремих випадках не виключаються алергічні реакції.
Іншою трансгенною твариною з'явилася корова, яка з молоком проводить людський лактоферрин. В результаті підсадки трансгенної яйцеклітини народився бик, від якого отримано багато трансгенних телиць, в подальшому що проводять і виділяючих лактоферрин з молоком.
Отримані і інші трансгенні тварини. Коза виділяє з молоком активатор плазминогена, який розчиняє тромби; трансгенні кролики — фермент осглюкозидазу для лікування хвороби Помпі; трансгенні кури несуть яйця з людськими антитілами.
У 70-х роках була показана можливість отримання ферментів з тканин людини і розроблені системи спостереження за долею ферментів в організмі ссавців. Перші клінічні випробування були проведені при різних лизосомных порушеннях: ганглиозидозе Ош типу 2 (Р-гексозамінідаза А з сечі), гликогенозе типу 2 (плацентарна а-галактозидаза), хвороби Фабрі (плацентарна а-галактозидаза), хвороби Гоше (плацентарна р-глюкозидаза). Перед клінічним випробуванням було встановлено, що високоочищені ферменти людини гідролізують природний субстрат. Перевірка показала, що ферменти виявляються в печінковій тканині при їх внутрішньовенному або підшкірному введенні. При цьому концентрація ферментів в крові зменшується, а в печінці підвищується. Проте вони не проникають в мозок в результаті бар'єрних функцій мозкових оболонок. Звідси слідує вивід про специфічну доставку ферментів в клітки-мішені при кожній хворобі. Доставка їх в різні клітинні структури може зажадати специфічного очищення або якої-небудь хімічної модифікації ферменту.
Експериментальні розробки в області ферментотерапии спадкових хвороб дозволили об'єктивно оцінювати захоплення молекул ферменту рецепторами, гепатоцитами, клітками ретикулоендотеліальної системи, фибробластами, клітками ендотелію судин і так далі Це збільшило можливості направлених розробок лікування спадкових хвороб і в першу чергу розробок з використанням нових методів доставки ферментів до кліток-мішеней в синтетичних «бульбашках-носіях» або микрокапсулах— ліпосомах, або природних елементах — аутологичных еритроцитах. Такі методи доставки розробляються для лікування не тільки спадкових хвороб, але і інших видів патології. Направлена доставка лікарських речовин в органи, тканини і клітки є актуальною проблемою для медицини в цілому.
Цінним інструментом для генетичних досліджень стали трансгенні миші. Вони дають інформацію при плануванні генної терапії людини. Учені, що вивчають м'язову дистрофію Дюшена, виділили ген, який відсутній у хворих. Запропонований спосіб забезпечення хворих дітей дистрофином. Але що буде, якщо дистрофії потрапить в інші тканини, або його утворюватиметься дуже багато? Для вирішення цих питань були створені трансгенні миші, в м'язах яких є дистрофина в 50 разів більше, а також відбувається продукція цього білка в інших тканинах. Дистрофії не викликає у таких мишей патологічних відхилень.
Трансгенні миші виявилися необхідними при вивченні злоякісних пухлин, моногенних і мультифакториальных хвороб людини. Але трансгенна технологія є неточною, тому що введення ДНК не направлене на визначений локус хромосоми. Ген, що переноситься, може порушити функцію іншого гена або потрапити під контроль інших генів. Навіть якщо трансген вбудовується в хромосому і экспрессируется, його ефект може бути перекритий таким же геном клітки-господаря. Тому була розроблена технологія точнішого «прицілювання» гена, при якому ген, що вводиться, займає місце свого двійника в хромосомі клітки господаря. При цьому використовується природний процес гомологической рекомбінації. Унаслідок такої технології замінюють инактивированым геном активний ген у мишей і стежать ефект його відсутності навіть в ембріонові. Так вивчають функцію білків імунної системи, механізм взаємодії онкогенов у виникненні пухлини, розвитку генетичних захворювань.
«Прицілювання» гена - складна методологія, вона не працює в заплідненій клітці ссавців. Ген можна ввести тільки в клітки на ранніх етапах розвитку зародка, до його імплантації в стінку матки.
Тварин з «виключеним» геном використовують у вивченні складних захворювань, у яких задіяно багато генів. Так, наприклад, вивчають атеросклероз шляхом инактивации з'єднання генів, продукти яких контролюють ліпідний метаболізм.
Проблеми екологічної безпеки. Вважається, що трансгенез у рослин і тварин - найбільш перспективна біотехнологія для вирішення продовольчої і медичної проблем на найближче десятиліття. Трансгенні тварини - кози, вівці, свині, корови - використовуються для секреції під промоторами «генів молока» високоактивних біологічних речовин для медицини і фармакології. Вже пройшли ліцензування і поступили на ринок отримані через трансгенних тварин антитрипсин, вживаний при легеневих захворюваннях, антитромбін III для запобігання інфарктам і інсультам, чинники згортання крові, білок З, що володіє захисними функціями, і ряд інших.
Проте у всьому світі в засобах масової інформації розгорнена дискусія про небезпеки застосування генетично модифікованих організмів - трансгенних рослин і тварин. Наукової основи для такої стурбованості немає, оскільки наш організм вже давно користується продуктами цих генів у вигляді пулу амінокислот і коротких фрагментів нуклеїнових кислот, що не відтворюються, як основи для власних біосинтетичних процесів. Додамо, що кожна трансгенна рослина, що рекомендується до застосування, проходить жорстку перевірку по багатьом параметрам з випробуванням на тварин і лише після цього отримує ліцензію.
У Росії і Україні також йдуть бурхливі дискусії про небезпеки використання трансгенних організмів. Проте в наший країні поки не обробляється жодна трансгенна рослина, хоча російськими ученими вже створені трансгенні рослини більш ніж у 20 видів, деякі з них зараз проходять ретельну перевірку.
Приведемо дві, до кінця ще не розв'язані проблеми, зв'язані з використанням трансгенних рослин. Перша - витік трансгенів до інших диких видів-родичів через спонтанну гібридизацію. Хоча цей процес маловірогідний, він не виключається. Можна представити наслідки, коли гени гербицидоустойчивости раптом опиняться біля бур'янів.
Оскільки трансгенні рослини стійкі до хвороб і шкідників, то не виключається підвищення стійкості самих збудників хвороб і тих же комах-шкідників, тобто їх коэволюция. Це друга проблема, наслідки якої необхідно передбачати. Можливо, що, створюючи стійкість у рослин, стимулюється процес відбору стійкіших збудників і шкідників. Природно, що трансгенез викликає вельми відчутні наслідки, які потрібно ретельно вивчати.
Генна терапія. Генну терапію на сучасному етапі можна визначити як лікування спадкових, мультифакториальных і неспадкових (інфекційних) захворювань шляхом введення генів в клітки пацієнтів з метою направленої зміни генних дефектів або додання кліткам нових функцій.
Принципи генної терапії. Залежно від способу введення екзогенної ДНК в геном пацієнта генна терапія може проводитися або в культурі кліток (ex vivo), або безпосередньо в організмі (in vivo). Клітинна генна терапія або терапія ex vivo припускає виділення і культивування специфічних типів кліток пацієнта, введення в них чужорідних генів, відбір трансфецированных кліток і реинфузию їх тому ж пацієнтові (рис.59). В даний час в більшості допущених до клінічних випробувань програм генної терапії використовується саме цей підхід.
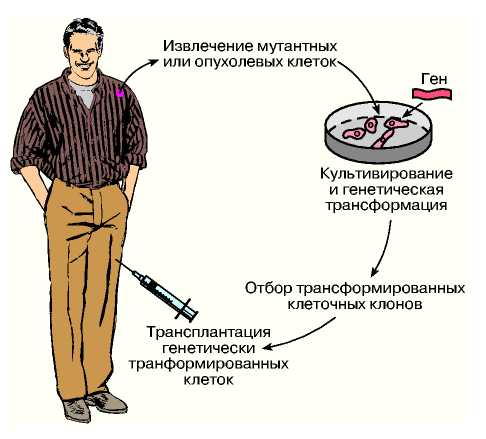
Ріс.59. Генотерапія способом ex vivo. Клітки отримують від пацієнта, культивують in vitro, проводять їх генетичну трансформацію, відбирають потрібні клони кліток і повертають в організм пацієнта. У разі пухлин клітки трансформують генами, що різко підсилюють імунну відповідь організму, опромінюють і трансплантують підшкірно тому ж пацієнтові.
Генна терапія in vivo заснована на прямому введенні клонованих і певним чином упакованих послідовностей ДНК в специфічні тканини хворого. Особливо перспективним для лікування генних хвороб in vivo представляється введення генів за допомогою аерозольних або таких, що ін'єктуються вакцин. Аерозольна генотерапия розробляється, як правило, для лікування пульмонологічних захворювань (муковісцидоз, рак легенів).
Розробці програми генної терапії передують ретельний аналіз тканеспецифической експресії відповідного гена, ідентифікація первинного біохімічного дефекту, дослідження структури, функції і внутріклітинного розподілу його білкового продукту, а також біохімічний аналіз патологічного процесу. Всі ці дані враховуються при складанні відповідного медичного протоколу. Апробацію процедури генокоррекции спадкового захворювання проводять на первинних культурах кліток хворого, в яких в нормі функціонально активний даний ген. На цих клітинних моделях оцінюють ефективність вибраної системи перенесення екзогенної ДНК, визначають експресію генетичної конструкції, що вводиться, аналізують її взаємодію з геномом клітки, відпрацьовують способи корекції на біохімічному рівні.
Використовуючи культури кліток, можна розробити систему адресної доставки рекомбинантных ДНК, проте перевірка надійності роботи цієї системи може бути здійснена тільки на рівні цілого організму. Тому така увага в програмах по генній терапії приділяється експериментам in vivo на природних або штучно отриманих моделях відповідних спадкових хвороб у тварин. Успішна корекція генетичних дефектів у таких тварин і відсутність небажаних побічних ефектів генної терапії є найважливішою передумовою для дозволу клінічних випробувань.
Таким чином, стандартна схема генокоррекции спадкового дефекту включає серію послідовних етапів. Вона починається створенням повноцінно працюючої (экспрессирующейся) генетичної конструкції, що містить смислову (що кодує білок) і регуляторну частини гена. На наступному етапі вирішується проблема вектора, що забезпечує ефективну, а по можливості і адресну доставку гена в клітки-мішені. Потім проводиться трансфекция (перенесення отриманої конструкції) в клітки-мішені, оцінюється ефективність трансфекции, ступінь коррегируемости первинного біохімічного дефекту в умовах клітинних культур (in vitro) і, що особливо важливе, in vivo на тваринах — біологічних моделях. Тільки після цього можна приступати до програми клінічних випробувань.
Генна терапія ex vivo і in vivo. Перші клінічні випробування методів генної терапії були зроблені 22 травня 1989 року з метою генетичної маркіровки опухоль-инфильтрующих лімфоцитів у разі прогресуючої меланоми. Першим моногенним спадковим захворюванням, відносно якого були застосовані методи генної терапії, виявився спадковий иммуннодефицит, обумовлений мутацією в гені аденозиндезаминазы (ADA). 14 вересня 1990 року в Бетесде (США) чотирилітній дівчинці, страждаючій цим достатньо рідкісним захворюванням (1: 100000), були пересаджені її власні лімфоцити, заздалегідь трансформовані поза організмом (ex vivo) геном ADA (ген ADA + ген neo + ретровірусний вектор). Лікувальний ефект спостерігався протягом декількох місяців, після чого процедура була повторена з інтервалом 3—5 місяців. За три роки терапії в цілому проведені 23 внутрішньовенні трансфузии ADA-трансформированных Т-лимфоцитов без видимих несприятливих ефектів. В результаті лікування стан пацієнтки настільки покращав, що вона змогла вести нормальний спосіб життя і не боятися випадкових інфекцій. Таким же успішним виявилося і лікування другої пацієнтки з цим захворюванням. В даний час клінічні випробування генної терапії цього захворювання проводяться в Італії, Франції, Великобританії і Японії.
У 1997 році число допущених до клінічних випробувань протоколів вже складало 175, більше 2000 пацієнтів взяли участь в їх реалізації. Більшість таких проектів (близько 80%) стосуються лікування онкологічних захворювань, а також Віл-інфекції (СНІДУ). Разом з тим і в сучасних дослідженнях по генній терапії необхідно враховувати, що наслідки маніпулювання генами або рекомбинантными ДНК in vivo вивчені недостатньо.
У країнах з найбільш просунутим рівнем досліджень в цій області, особливо в США, медичні протоколи з використанням смислових послідовностей ДНК піддаються обов'язковій експертизі у відповідних комітетах і комісіях.
Вірусні і невірусні вектори в генотерапии. Вирішальною умовою успішної генотерапии є забезпечення ефективної доставки, тобто трансфекции (у широкому сенсі) або трансдукции (при використанні вірусних векторів) чужорідного гена в клітки-мішені, забезпечення тривалого функціонування його в цих клітках і створення умов для повноцінної роботи гена (його експресії). Трансфекция може проводитися з використанням чистої («голою» — naked) ДНК, легованої (вбудованою) у відповідну плазмиду, або комплексированной ДНК (плазмидная ДНК, сполучена з солями, білками (трансферрин), органічними полімерами (DEAE-декстран, полилизин, ліпосомами або частинками золота), або ДНК у складі вірусних частинок, заздалегідь позбавлених здібності до реплікації.
Основні методи доставки чужорідних генів в клітки розділяються на хімічні, фізичні і біологічні. Тільки вірусні вектори або генетичні конструкції, що включають вірусні послідовності, здатні до активної трансдукции, а в деяких випадках і до тривалої експресії чужорідних генів. З більше 175 вже схвалених протоколів клінічних випробувань по генотерапии більше 120 припускають використовувати вірусну трансдукцию і близько 100 з них засновані на застосуванні ретровірусних векторів.
Огляд літературних даних дозволяє прийти до висновку, що, не дивлячись на зусилля багатьох лабораторій миру, все вже відомі і випробувані in vivo і in vitro векторні системи далекі від досконалості. Якщо проблема доставки чужорідній ДНК in vitro практично вирішена, а її доставка в клітки-мішені різних тканин in vivo успішно вирішується (головним чином шляхом створення конструкцій, що несуть ре-цепторные білки, у тому числі і антигени, специфічні для тих або інших тканин), то інші характеристики існуючих векторних систем — стабільність інтеграції, регульована експресія, безпека — все ще потребують серйозних доопрацювань.
Перш за все, це стосується стабільності інтеграції. До теперішнього часу інтеграція в геном досягалася тільки при використанні ретровірусних або аденоассоциированных векторів. Підвищити ефективність стабільної інтеграції можна шляхом вдосконалення генних конструкцій типу рецептор-опосредованных систем (рис.60) або шляхом створення достатньо стабільних эписомных векторів (тобто ДНК-структури, здібної до тривалої персистенції усередині ядер).
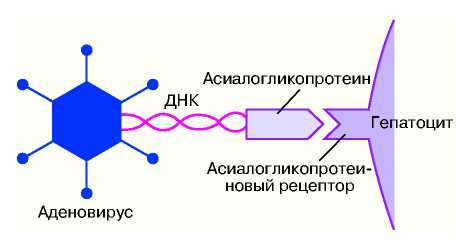
Ріс.60. Рецептор-опосредованний перенесення гена. ДНК-послідовність потрібного гена сполучають з певним мембранним рецептором (наприклад, сиалогликопротеином у разі кліток печінки), а також з аденовірусом, що забезпечує проникнення генної конструкції в ядро клітки. Такий комбінований вектор забезпечує ефективну адресну доставку гена в клітки печінки.
Останнім часом особлива увага приділяється створенню векторів на базі штучних хромосом ссавців. Завдяки наявності основних структурних елементів звичайних хромосом такі міні-хромосоми тривало утримуються в клітках і здатні нести повнорозмірні (геноми) гени і їх природні регуляторні елементи, які необхідні для правильної роботи гена, в потрібній тканині і в належний час.
Перспективи і обмеження генної терапії. Успіх перших клінічних випробувань з'явився могутнім стимулом для прискорення розвитку нових генотерапевтических методів стосовно інших спадкових хвороб
Поява принципово нових технологій, що дозволяють активно маніпулювати з генами і їх фрагментами і що забезпечують адресну доставку нових блоків генетичній інформації в задані ділянки генома, стала важливою подією в біології і медицині. Вже зараз на сучасному рівні знань про геном людини теоретично цілком можливі такі його модифікації з метою поліпшення деяких фізичних (наприклад, зростання), психічних і інтелектуальних параметрів. Таким чином, сучасна наука про людину на своєму новому витку розвитку повернулася до ідеї поліпшення людської породи, колись постулированной видатним англійським генетиком Ф. Гальтоном і розвиненою його учнями і послідовниками у Великобританії (До. Пірсон, Л. Пенроуз, Дж. Холдейн), в Росії (Н.К. Кольцов, Ф.П. Філіпченко), в США (Р. Меллер). Подальший хід історії, як відомо, повністю дискредитував саму ідею поліпшення людської породи. Проте прийдешнє всевладдя людини над власним геномом примушує знов і знов повертатися до цієї теми, робить її предметом постійних жвавих дискусій в широкому і науковому друці. Не викликає сумніву, що первинні побоювання, пов'язані з генною інженерією людини, були невиправдані. Вже визнано доцільним застосування генної терапії для лікування багатьох захворювань. Єдиним і неодмінним обмеженням, що зберігає свою силу і в сучасних умовах, є те, що всі генотерапевтические заходи повинні бути направлені тільки на конкретного хворого і стосуватися виключно його соматичних кліток.
Генна інженерія можлива на рівні зародкових кліток. Профілактика спадкових хвороб може бути якнайповнішою і ефективнішою, якщо в зиготу буде вбудований ген, по функції замінюючий ген мутанта. Усунення причини спадкової хвороби (а саме це і є найбільш глибокий підхід до профілактики) означає достатньо серйозне «маневрування» з генетичною інформацією в зиготе. Це можуть бути введення нормального аллеля в геном шляхом трансфекции, зворотна мутація патологічного аллеля, «включення» нормального гена в роботу, якщо він блокований, «виключення» гена мутанта. Складнощі цих завдань очевидні, не інтенсивні експериментальні розробки в області генної інженерії свідчать про принципову можливість їх рішення. Питання про генно-інженерну профілактику спадкових хвороб є вже не утопією, а перспективою, хоча і не близькою.
Передумови для корекції генів людини в зародкових клітках вже створені. Їх можна узагальнити у вигляді наступних положень.
Первинна розшифровка генома людини завершена, особливо на рівні секвенирования нормальних і патологічних аллелей. Можна сподіватися, що для більшості спадкових хвороб мутації будуть секвенированы найближчими роками. Інтенсивно розвивається функціональна геномика, завдяки якій будуть відомі міжгенні взаємодії.
Будь-які гени людини неважко отримувати в чистому вигляді на основі хімічного або біологічного синтезу. Цікаво відзначити, що ген глобіну людини був одним з перших штучно отриманих генів.
Розроблені методи включення генів в геном людини з різними векторами або в чистому вигляді шляхом трансфекции.
Методи направленого хімічного мутагенезу дозволяють індукувати специфічні мутації строго певному локусе (отримання зворотних мутацій — від патологічного аллеля до нормального).
Отримані докази в експериментах на разных тварин трансфекции окремих генів на стадії зигот (дрозофила, миша, коза, свиня і ін.). Введені гени функціонують в організмі-реципієнтові і передаються по спадку, хоча і не завжди по законах Менделя. Наприклад, ген гормону зростання щурів, введений в геном зигот мишей, функціонує у мишей, що народилися. Такі трансгенні миші значно більше по розмірах і масі в порівнянні з нормальними.
Генно-інженерна профілактика спадкових хвороб на рівні зигот розроблена поки слабо, хоча вибір способів синтезу генів і способів їх «доставки» в клітки вже достатньо широкий. Вирішення питань трансгеноза у людини сьогодні упирається не тільки в генно-інженерні труднощі, але і в етичні проблеми. Адже мова йде про «композиції» нових геномів, які створюються не еволюцією, а людиною. Ці геноми віллються в генофонд людства. Яка буде їх доля з генетичної і соціальної точки зору? Чи будуть вони функціонувати як нормальні геноми? Чи готове суспільство прийняти на себе наслідки невдалих результатів? Сьогодні відповісти на ці питання важко, а без відповіді на них не можна починати клінічні випробування. Адже мова йде про безповоротному втручанні в геном людини. Без об'єктивної оцінки еволюційних наслідків генної інженерії не можна застосовувати ці методи на людині (навіть і з медичними цілями на стадії зигот). Генетика людини ще далека від повного розуміння всіх особливостей функціонування генома. Неясно, як геном працюватиме після введення в нього додаткової генетичної інформації, як він поводитиметься після мейоза, редукції числа хромосом, у поєднанні з новою зародковою кліткою і тому подібне
Все сказане вище дало підставу фахівцям в області біомедичної етики на міжнародному рівні, включаючи ВІЗ, ЮНЕСЬКО, Раду Європи, тимчасово утриматися від проведення експериментів, а тим більше клінічних випробувань з трансгенозом зародкових кліток.
Сучасний рівень знань не дозволяє проводити корекцію генних дефектів на рівні статевих кліток і кліток ранніх доимплантационных зародків людини у зв'язку з реальною небезпекою засмічення генофонду небажаними штучними генними конструкціями або внесенням мутацій з непередбачуваними наслідками для майбутнього людства. Разом з тим в науковій літературі все частіше і наполегливіше лунають заклики до відновлення дискусії про доцільність генокоррекции зародкових і статевих кліток людини.
Ось деякі питання, які повинні бути вирішені в рамках пропонованої генетиками широкої дискусії по генній терапії.
Чи зможе в майбутньому генна терапія забезпечити таку повноцінну генокоррекцию, яка не представить загрози для потомства?
Якою мірою корисність і необхідність генотерапевтической процедури для одного подружжя переважать ризик такого втручання для всього людства?
Наскільки оправданны будуть ці процедури на тлі прийдешнього перенаселення планети?
Як співвідноситимуться генноинженерные заходи на людині з проблемами гомеостазу суспільства і біосфери?
Таким чином, генетична революція, апофеозом якої з'явилася генотерапия, не тільки пропонує реальні шляхи лікування важких спадкових і неспадкових недуг, але і в своєму стрімкому розвитку ставить перед суспільством нові проблеми, вирішення яких настійно необхідно вже в найближчому майбутньому.
Генні вакцини (ДНК-вакцина). Використовувані сьогодні вакцини можна розділити залежно від методів їх отримання на наступні типи:
живі аттенуированные вакцини;
інактивовані вакцини;
вакцини, що містять очищені компоненти мікроорганізмів;
рекомбинантные вакцини, що містять компоненти мікроорганізмів, отримані методом генної інженерії.
Технологію рекомбинантной ДНК застосовують також для створення живих ослаблених вакцин нового типу, досягаючи аттенуации шляхом направлених мутацій генів, що кодують вірулентні протеїни збудника захворювання. Цю ж технологію використовують і для отримання живих рекомбинантных вакцин, вбудовувавши гени, що кодують імуногенні протеїни, в живі непатогенні віруси або бактерії (вектори), які і вводять людині. У 1990г. у деяких дослідницьких лабораторіях приступили до розробки нових вакцин, які засновані на введенні «голої» молекули ДНК. Вже в 1992-1993 рр. декілька незалежних груп дослідників в результаті експерименту довели, що введення чужорідної ДНК в організм тварини сприяє формуванню імунітету. Принцип застосування ДНК-вакцини полягає в тому, що в організм пацієнта вводять молекулу ДНК, що містить гени, що кодують імуногенні білки патогенного мікроорганізму. ДНК-вакцина називає ще генною, генетичною, полинуклеотидными вакцинами, вакцинами з нуклеїнових кислот.
На нараді фахівців з генних вакцин, проведеній в 1994 р. під егідою ВІЗ, було вирішено віддати перевагу терміну «вакцини з нуклеїнових кислот» з їх підрозділом відповідно на ДНК - і РНК - вакцини. Таке рішення грунтувалося на тому, що використання терміну «ДНК - вакцина» не сформує помилкову думку про те, що нові вакцини вносять зміни в генетичні структури організму людини, що вакцинується. Проте, багато фахівців вважають точнішим термін «генні вакцини» (оскільки імунна реакція направлена не проти ДНК, а проти антигенного білка, що кодується геном), який також часто застосовують. Для отримання ДНК-вакцини ген, що кодує продукцію імуногенного протеїну якого-небудь мікроорганізму, вбудовують в бактерійну плазмиду. Окрім гена, що кодує вакцинуючий протеїн, в плазмиду вбудовують генетичні елементи, які необхідні для експресії («включення») цього гена в клітках эукариотов, зокрема людину, для забезпечення синтезу білка. Таку плазмиду вводять в культуру бактерійних кліток, щоб отримати велику кількість копій. Потім плазмидную ДНК виділяють з бактерій, очищають від інших молекул ДНК і домішок. Очищена молекула ДНК і служить вакциною.
Введення ДНК-вакцини забезпечує синтез чужорідних протеїнів клітками організму, що вакцинується, що приводить до подальшого вироблення імунітету проти відповідного збудника. При цьому плазмиды, що містять відповідний ген, не вбудовуються в ДНК хромосом людини. ДНК-вакцину можна вводити в сольовому розчині звичайним парентеральним способом (внутрішньом'язовий, внутрикожно). При цьому велика частина ДНК поступає в міжклітинний простір і лише після цього включається в клітки. Застосовують і інший метод введення, використовуючи так званий генний пістолет. Для цього ДНК фіксують на мікроскопічних золотих гранулах (близько 1-2 мкм), потім за допомогою пристрою, що приводиться в дію стислим гелієм, гранули «вистрілюють» безпосередньо всередину кліток. Слід зазначити, що аналогічний принцип введення ліків за допомогою струменя стислого гелію використовують і для розробки нових способів доставки лікарських засобів (з цією метою оптимізують розміри частинок лікарської речовини і їх щільність для досягнення необхідної глибини проникнення у відповідну тканину організму). Цей метод вимагає дуже невеликої кількості ДНК для імунізації. Якщо при імунізації класичними субодиничними вакцинами вводять микрограммы протеїну, то при використанні ДНК-вакцини — нанограми і навіть менше. Кажучи про мінімальну кількість ДНК, достатню для індукції імунної відповіді, С.А. Джонстон, директор Центру біомедичних винаходів Техаського університету, в журналі «The Scientist» (1998) відзначає, що за допомогою генного пістолета можна одноразово ввести миші «фактично 27 тис. різних плазмид і отримати імунну відповідь на індивідуальну плазмиду». Подальші експерименти підтвердили здатність ДНК-вакцини формувати імунітет відносно різноманітних збудників. ДНК-вакцина володіє поряд переваг в порівнянні з традиційними вакцинами.
Усвідомлення перспективності застосування генних вакцин сприяло значному збільшенню фінансування досліджень в цьому напрямі не тільки з боку державних організацій, але і приватних компаній. Характерним прикладом може служити невелика американська біотехнологічна фірма «Vical Inc.», яка однією з перших приступила до розробки ДНК-вакцини. Спонукальним фактом для роботи в цьому напрямі послужили результати одного експерименту, проведеного в лабораторії «Vical Inc.» у 1989г., коли дослідники випадково встановили, що введення «голої» вірусної ДНК мишам приводить до продукції великої кількості вірусних білків. Після цього фірма запатентувала метод прямого введення «голої» ДНК в клітки. Вже в 1991г. «Vical Inc.» приступила до розробки ДНК-вакцини для попередження інфекційних захворювань. Через 2 роки в журналі «Science» були опубліковані результати цих досліджень, підтверджуючі ефективність застосування ДНК-вакцини проти грипу у мишей. Незабаром компанія «Vical Inc.» почала розробки виробництва і продажу терапевтичної і профілактичної ДНК-вакцини проти ВІЧ/СНІДУ, туберкульозу, гепатиту В, гепатиту З, герпесу і захворювань, що викликаються вірусами папіломи людини. Інший найбільший виробник вакцин — компанія «Aventis Pasteur» — розробляє ДНК-вакцину, застережливу інфікування цитомегаловирусом, збудником малярії, Н. pylori, респираторно-синцитиальным вірусом, вірусом вітряної віспи і ін.
Компанія «Vical Inc.» проводить також клінічні дослідження (I або II фаза) терапевтичних вакцин і методів генної терапії (на основі технології «голої» ДНК) для лікування хворих з деякими злоякісними новоутвореннями. ДНК-вакцина володіє великим потенціалом і може викликати революцію у вакцинологии. Проте багато фахівців не поспішають робити остаточні виводи до тих пір, поки не отримають достатню кількість даних клінічних досліджень, що переконливо свідчать про ефективність і безпеку ДНК-вакцини. У найближчі декілька років не слід чекати їх впровадження в медичну практику, оскільки більшість з вакцин, що розробляються, знаходиться на етапі доклінічних або проходять I—II фазу клінічних досліджень.
Генотерапія в онкології. Одночасно з розвитком досліджень в області генокоррекции спадкових дефектів успішними також опинилися пошуки методів терапевтичного використання смислових послідовностей ДНК для лікування неспадкових захворювань і, головним чином, злоякісних пухлин і вірусних інфекцій. Істотно, що саме в цих розділах патології пошуки шляхів генокоррекции проводяться особливо інтенсивно, а число вже схвалених протоколів клінічних випробувань у багато разів перевищує число таких для лікування моногенних хвороб.
Основні методологічні підходи до генотерапии різних пухлин, цілком прикладені і для боротьби з найбільш серйозними інфекційними захворюваннями, наприклад з Віл-інфекцією (СНІДОМ).
Результати перших клінічних випробувань цих підходів виявилися надзвичайно обнадійливими, особливо при лікуванні нейродегенеративных і онкологічних захворювань нервової системи.
Генна терапія злоякісних новоутворень вже почата, хоча на її шляху багато труднощів, обумовлених необхідністю забезпечення селективності, специфічності, чутливості і безпеки перенесення генів. В даний час застосовується наступна стратегія генної терапії раки.
Підвищення імуногенності пухлини шляхом вставки цитокиновых генів, а також генів, що кодують головний комплекс гистосовместимости, лимфоцитарных лигандов.
Направлена доставка (векторирование) генів цитокинов в клітки, які в межах пухлини локально можуть реалізувати токсичні ефекти (наприклад, в лімфоцити, инфильтрующие пухлини).
Використання опухолеспецифических пролікарських активаторів, тобто вставка ферментативно пролекарственно- активуючих генів, що зливаються з промоторними системами, які реалізуються через диференціально контрольовану (ідеально опухолеспецифическую) транскрипцію.
Введення маркіруючих генів, які можуть забезпечувати виявлення мінімально залишених після операції або пухлин, що розростаються.
Штучна репресія функцій генів шляхом вставки генів, що кодують комплементарну (антисмислову) мРНК гена, що репресується (онкогены, гени лікарської резистентності).
Невелике число спроб генної терапії злоякісних пухлин пов'язане з введенням в клітки резецированной пухлини генів інтерлейкіна-2 або чинника некрозу пухлини. Потім ці клітки вводять підшкірно в область стегна. Через 3 тижні видаляють регіонарний лімфатичний вузол (відповідно місцю введення суміші трансгенних пухлинних кліток). Культивують Т-лимфоциты, виділені з цього вузла. Крім того, розмножують лімфоцити з пухлини (опухоль-инфильтрирующие). Пацієнтові вводять загальну масу лімфоцитів, що забезпечує імунну реакцію на пухлинні клітки. Так лікували хворих злоякісною меланомою, раком нирки, запущеним раком різних органів.
Як видно з приведених вище прикладів, ера генної терапії людини вже почалася. Визначені принципи і методичні підходи до генної терапії, відібрані потенційні хвороби для цього лікування. Робота продовжується одночасно в різних країнах і в різних напрямах. Вже очевидно, що генна терапія застосовуватиметься для лікування не тільки спадкових хвороб, але і злоякісних пухлин і хронічних вірусних інфекцій.
Практичні і теоретичні результати генної інженерії. В результаті інтенсивного розвитку методів генетичної інженерії отримані клони безлічі генів рибосомальной, транспортною і 5S РНК, гистонов, глобіну миші, кролика, людини, колагену, овальбуміну, інсуліну людини і ін. пептидних гормонів, інтерферону людини і інше. Це дозволило створювати штами бактерій, що проводять багато біологічно активних речовин, використовуваних в медицині, сільському господарстві і мікробіологічній промисловості.
Крім того, на основі численних мутантів по окремих генах, що отримуються при їх вивченні, створені високоефективні тест-системи для виявлення генетичної активності чинників середовища, зокрема для виявлення канцерогенних з'єднань.
За короткий строк генна інженерія зробила величезний вплив на розвиток молекулярно-генетичних методів і дозволила істотно просунутися по шляху пізнання будови і функціонування генетичного апарату.
