
- •Передмова
- •Частина 1. Молекулярні основи спадковості
- •Введення в молекулярну біологію.
- •1.2. Макромолекули як обьекты вивчення молекулярної біології
- •1.2.2. Будова, функції і властивості днк.
- •Молекулярна організація генів.
- •Рнк і її роль в збереженні і реалізації спадкової інформації.
- •Лікарські засоби, що впливають на синтез нуклеїнових кислот і білків.
- •1.3. Експресія генів і її регуляція
- •1.4. Організація геномів неклітинних і клітинних організмів
- •Геном бактерій
- •Організація генома эукариот.
- •Частина 2. Молекулярні основи спадкових захворювань
- •2.1. Молекулярні механізми генних, хромосомних і геномів мутацій
- •2.2. Регуляція клітинного циклу. Апоптоз. Онкогенетика.
- •Частина 3. Сучасні питання генних технологій
- •3.1 Дослідження нуклеїнових кислот. Методи днк-діагностики
- •3.2 Методи генної інженерії
- •3.3 Клонування організмів і кліток.
- •Додатки контрольно-повчальні питання
- •Відповіді на контрольному – повчальні питання
- •Термінологічний словник
- •Література
1.2.2. Будова, функції і властивості днк.
Хімічний склад ДНК і її макромолекулярна організація. Типи спіралей ДНК. Молекулярні механізми рекомбінації, реплікації і репарації ДНК. Поняття про нуклеазах і полимеразах. Реплікація ДНК як умова передачі генетичній інформації нащадкам. Загальна характеристика процесу реплікації. Дії, що відбуваються у вилці реплікації. Реплікація теломеров, теломераза. Значення недорепликации кінцевих фрагментів хромосом в механізмі старіння. Системи виправлення помилок реплікації. Коректорські властивості ДНК-полимераз. Механізми репарації пошкодженої ДНК. Поняття про захворювання репарації ДНК. Молекулярні механізми загальної генетичної рекомбінації. Сайт-специфічеськая рекомбінація. Генна конверсія.
У 1865г. Грегор Мендель відкрив гени, а його сучасник Фрідріх Мішер в 1869г. відкрив нуклеїнові кислоти (у ядрах кліток гноїть і сперматозоїдів лосося). Проте довго ще ці відкриття не зв'язували один з одним, довго ще структуру і природу речовини спадковості не знали. Генетична роль НК була встановлена після відкриття і пояснення явищ трансформації (1928, Ф.Гріффітс; 1944, О. Евері), трансдукции (1951, Ледерберг, Циндер) і розмноження бактеріофагів (1951, А. Херши, М. Чейз).
Трансформація, трансдукция і розмноження бактеріофагів переконливо довели генетичну роль ДНК. У РНК - вірусів (СНІДУ, гепатиту В, грипу, ВТМ, лейкозу мишей і ін.), що містять, цю роль виконує РНК.
Будова нуклеїнових кислот. НК — біополімери, що беруть участь в зберіганні і передачі генетичній інформації. Мономери НК — нуклеотиды, що складаються з азотистої підстави, моносахариду і однієї або декількох фосфатних груп. У складі НК всі нуклеотиды є монофосфатами. Нуклеотід без фосфатної групи називається нуклеозидом. Цукор, що входить до складу НК, є D-изомер і в-аномер рибозы або 2-дезоксирибозы. Нуклеотіди, що містять рибозу, називаються рибонуклеотидами і є мономерами РНК, а нуклеотиды — похідні дезоксирибозы, є дезоксирибонуклеотидами, і з них складається ДНК. Азотисті підстави бувають двох типів: пурини — аденин, гуанин і пиримидины — цитозин, тимин, урацил. До складу РНК і ДНК входять аденин, гуанин, цитозин; урацил зустрічається тільки в РНК, а тимин тільки в ДНК.
У ряді випадків в НК присутні ті, що рідко зустрічаються мінорні нуклеотиды, такі як дигидроуридин, 4-тиоуридин, інозин і ін. Різноманітність їх особливо велике у тРНК. Мінорні нуклеотиды утворюються в результаті хімічних перетворень підстав НК, що відбуваються вже після утворення полімерного ланцюга. Надзвичайно поширені в РНК і ДНК різні метилированные похідні: 5-метилуридин, 5-метилцитидин, l-N-метиладенозин, 2-И-метилгуанозин. У РНК об'єктом метилирования можуть бути і 2'-гидроксигруппы залишків рибозы, що приводить до утворення 2'-О-метилцитидина або 2'-О-метилгуанозина.
Рібонуклеотідниє і дезоксирибонуклеотидные ланки з'єднуються між собою за допомогою фосфодиэфирных містків, що зв'язують 5'-гидроксильную групу одного нуклеотида з 3'-гидроксильной групою наступного. Таким чином, регулярний основний ланцюг утворений фосфатними і рибозными залишками, а підстави приєднані до сахарам подібно до того, як приєднані бічні групи в білках. Порядок проходження підстав уздовж ланцюга називається первинною структурою НК. Послідовність підстав прийнято читати в напрямі від 5'- до 3'- вуглецевому атому пентозы.
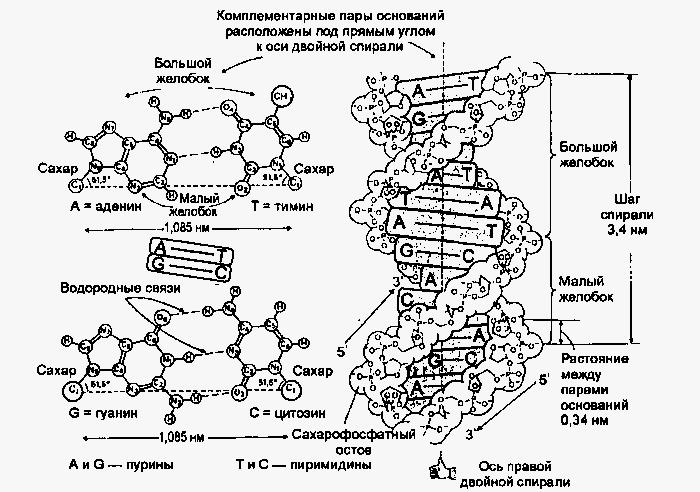
Структура ДНК. Модель структури ДНК у вигляді подвійної спіралі була запропонована Уотсоном і Криком в 1953 г (рис.7).
Згідно цієї тривимірної моделі, молекула ДНК складається з двох протилежно направлених полинуклеотидных ланцюгів, які щодо однієї і тієї ж осі утворюють праву спіраль. Азотисті підстави знаходяться усередині подвійної спіралі, і їх площини перпендикулярні основній осі, а сахарофосфатные залишки експоновані назовні. Між підставами утворюються специфічні Н-связи: аденин — тимин (або урацил), гуанин — цитозин, що отримали назву уотсон-криковского спаровування. В результаті об'ємніші пурини завжди взаємодіють з пиримидинами, що мають менші розміри, що забезпечує оптимальну геометрію остову. Антипаралельні ланцюги подвійної спіралі не є ідентичними ні по послідовності підстав, ні по нуклеотидному складу, але вони комплементарны один одному саме завдяки наявності специфічного водневого скріплення між вказаними вище підставами.
Комплементарність дуже важлива для копіювання (реплікації) ДНК. Співвідношення між числом різних підстав в ДНК, виявлену
Ріс.7. У - форма ДНК
Чарграффом з соавт. у 50-х рр., мали велике значення для встановлення структури ДНК: було показано, що число адениновых залишків в підставах ланцюга ДНК, незалежно від організму, рівне числу тиминовых, а число гуаниновых — числу цитозиновых. Ця рівність є наслідком виборчого спаровування підстав (рис.8).
Геометрія подвійної спіралі така, що сусідні пари підстав знаходяться один від одного на відстані 0.34 нм і повернені на 36° навколо осі спіралі. Отже, на один виток спіралі доводиться 10 пар підстав, і крок спіралі рівний 3.4 нм. Діаметр подвійної спіралі рівний 20 нм і в ній утворюються два жолобки — великий і малий. Це пов'язано з тим, що сахарофосфатный остов розташований далі від осі спіралі, чим азотисті підстави.
Стабільність структури ДНК обумовлена різними типами взаємодії, серед яких основними є Н-связи між підставами і міжплощинна взаємодія (стэкинг). Завдяки останньому забезпечуються не тільки вигідні ван-дер-ваальсовы контакти між атомами, але і виникає

Ріс.8. Принцип комплементарності і антипаралельності ланцюгів ДНК
додаткова стабілізація унаслідок перекриття р-орбиталей атомів паралельно розташованих підстав. Стабілізації сприяє також сприятливий гидрофобный ефект, що виявляється в захищеності малополярних підстав від безпосереднього контакту з водним середовищем. Навпаки, сахарофосфатный остов з його полярними і іонізованими групами експонований, що також стабілізує структуру.
Для ДНК відомо чотири поліморфні форми: А, В, З і Z. Звичайною структурою є В-ДНК, в якій площині пар підстав перпендикулярні осі подвійної спіралі (рис.7.). У А-ДНК площини пар підстав повернені приблизно на 20° від нормалі до осі правої подвійної спіралі; на виток спіралі тут доводиться 11 пар підстав. У С-ДНК на витку спіралі 9 пар підстав. Z-ДНК — це ліва спіраль з 12 парами підстав на виток; площини підстав приблизно перпендикулярні осі спіралі. ДНК в клітці зазвичай знаходиться у В-форме, але окремі її ділянки можуть знаходитися в A, Z або навіть в іншій конформації.
Подвійна спіраль ДНК не застигла освіта, вона знаходиться в постійному русі:
деформуються зв'язки в ланцюгах;
розкриваються і закриваються комплементарні пари підстав;
ДНК взаємодіє з білками;
якщо напруга в молекулі велика, то вона локально розплітається;
права спіраль переходить в ліву.
Розрізняють 3 фракції ДНК:
1.Частоповторяемая (сателіт) – до 106 копій генів (у миші 10%). Вона не бере участь в синтезі білка; розділяє гени; забезпечує кросинговер; містить транспозоны.
2.Слабоповторяемая – до 102 - 103 копій генів (у миші 15%). Містить гени синтезу т-РНК, гени синтезу білків рибосом і білків хроматина.
3.Унікальна (неповторювана) – у миші 75% (у людини 56%). Складається із структурних генів.
Локалізація ДНК: 95 % ДНК локалізується в ядрі в хромосомах (лінійна ДНК) і 5 % - в мітохондріях, пластидах і клітинному центрі у вигляді кільцевої ДНК.
Функції ДНК: зберігання і передача інформації; репарація; реплікація.
Два ланцюги ДНК в області гена принципово розрізняються по своїй функціональній ролі: одна з них є такою, що кодує, або смисловий, друга — матричною.
Це означає, що в процесі «прочитування» гена (транскрипції або синтезу пре-мРНК) як матриця виступає матричний ланцюг ДНК. Продукт же цього процесса-пре-мРНК — по послідовності нуклеотидов співпадає з кодуючим ланцюгом ДНК (із заміною тиминовых підстав на урациловые).
Таким чином, виходить, що за допомогою матричного ланцюга ДНК при транскрипції відтворюється в структурі РНК генетична інформація кодуючого ланцюга ДНК.
Головними матричними процесами, властивими всім живим організмам, є реплікація ДНК, транскрипція і трансляція.
Реплікація — процес, при якому інформація, закодована в послідовності підстав молекули батьківської ДНК, передається з максимальною точністю дочірньої ДНК. При напівконсервативній реплікації дочірні клітки першого покоління отримують один ланцюг ДНК від батьків, а другий ланцюг є знов синтезованим. Процес здійснюється за участю ДНК-полимераз, яка відноситься до класу трансфераз. Роль матриці грають розділені ланцюги двунитевой материнської ДНК, а субстратами є дезоксирибонуклеозид-5'-трифосфаты.
Транскрипція — процес перенесення генетичної інформації від ДНК до РНК. Всі види РНК - мРНК, рРНК і тРНК - синтезуються відповідно до послідовності підстав в ДНК, матрицею, що служить. Транськрібіруєтся тільки одна, так звана «+»-цепь ДНК. Процес протікає за участю РНК-полімераз. Субстратами є рибонуклеозид-5'-трифосфаты.
Процеси реплікації і транскрипції у прокариот і эукариот істотно розрізняються за швидкістю протікання і по окремих механізмах.
Трансляція — процес декодування мРНК, в результаті якого інформація з мови послідовності підстав мРНК перекладається мовою амінокислотної послідовності білка. Здійснюється трансляція на рибосомах, субстратами є аминоацил-тРНК.
Матричний синтез ДНК, що каталізує ДНК-полимеразами, виконує дві основні функції: реплікацію ДНК — синтез нових дочірніх ланцюгів і репарацію двунитевых ДНК, що має розриви в одному з ланцюгів, що утворилися в результаті вирізування нуклеазами пошкоджених ділянок цього ланцюга. У прокариот і эукариот існує три різновиди ДНК-полимераз. У прокариот виділені полимеразы I, II і III типів, що позначаються як pol l, pol ll і pol III. Остання каталізує синтез ланцюга, що росте, pol грає важливу роль в процесі дозрівання ДНК, функції pol ll вивчені не повністю. У эукариотических клітках в реплікації хромосом бере участь ДНК-полимераза Ь, в репарації — ДНК-полимераза в, а г різновид є ферментом, що здійснює реплікацію ДНК мітохондрій. Ці Ферменти, незалежно від типу кліток, в яких відбувається реплікація, приєднують нуклеотид до ОН-ГРУППЕ на З'-конце одного з ланцюгів ДНК, яка росте у напрямі 5'>3. Тому говорять, що дані Ф володіють 5'>3'-полимеразной активністю. Крім цього всі вони проявляють здатність деградувати ДНК, відщеплюючи, нуклеотиды у напрямі 3'>5, тобто є 3'>5'-экзонуклеазами.
У 1957 р. Мезельсон і Сталь, вивчаючи E. coli встановили, що на кожному вільному ланцюзі фермент ДНК-полимераза будує новий, комплементарний ланцюг. Це напівконсервативний спосіб реплікації: один ланцюг старий – інша нова!
Зазвичай реплікація починається в строго певних ділянках, що отримали назву ділянок ori (від origin of replication), і від цих ділянок розповсюджується в обидві сторони. Ділянкам ori передують точки розгалуження материнських ланцюгів ДНК. Ділянка, що примикає до точки розгалуження, отримала назву репликативной вилки (рис.9). В ході синтезу репликативная вилка переміщається уздовж молекули, при цьому розплітаються все нові ділянки батьківської ДНК до тих пір, поки вилка не дійде до точки терминации. Розділення ланцюгів досягається за допомогою спеціальних Ф — геликаз (топоизомераз). Енергія, необхідна для цього, вивільняється за рахунок гідролізу АТФ. Гелікази переміщаються уподовж полинуклеотидных ланцюгів в двох напрямах.
Для початку синтезу ДНК необхідна приманка — праймер. Роль праймера виконує коротка РНК (10—60 нуклеотидов). Вона синтезується комплементарно певній ділянці ДНК за участю праймазы. Після утворення праймера в роботу включається ДНК-полимераза. На відміну від геликаз ДНК-полимеразы можуть переміщатися тільки від 3' до 5' кінця матриці. Тому элонгация ланцюга, що росте, у міру розкручування двунитевой материнської ДНК може йти тільки уздовж одного ланцюга матриці, тій, щодо якої вилка реплікації рухається від 3' до 5' кінця. Ланцюг, що безперервно синтезується, отримав назву тієї, що лідирує. Синтез на ланцюзі, що запізнюється, також починається з утворення праймера і йде в напрямі, протилежному провідному ланцюгу, — від вилки реплікації. Ланцюг, що запізнюється, синтезується фрагментарно (у вигляді фрагментів Оказаки), оскільки праймер утворюється тільки тоді, коли вилка реплікації звільнить ту ділянку матриці, яка має спорідненість до праймазе. Лігированіє (зшивання) фрагментів Оказаки з утворенням єдиного ланцюга носить назву процесу дозрівання.
При дозріванні ланцюга РНК-затравка віддаляється як з 5' кінця провідного ланцюга, так і з 5' кінців фрагментів Оказаки, а ці фрагменти зшиваються один з одним. Видалення приманки здійснюється за участю 3'>5' экзонуклеазы. Цей же Ф замість видаленої РНК приєднує дезоксинуклеотиды, використовуючи свою 5'>3' полимеразную активність. При цьому у разі приєднання «неправильного» нуклеотида здійснюється «коректорська правка» — видалення підстав, створюючих некомплементарні пари. Цей процес забезпечує надзвичайно високу точність реплікації, що відповідає одній помилці на 109 пар підстав.
Ріс.9. Реплікація ДНК:
1 — репликативная вилка, 2 — ДНК-полимераза (pol I — дозрівання);
3 — ДНК-полимераза (pol III — «коректорська правка»); 4—геликаза;
 5—гираза
(топоизомераза); 6—белки, дестабилизирующие
двойную спираль.
5—гираза
(топоизомераза); 6—белки, дестабилизирующие
двойную спираль.
Корекція здійснюється в тих випадках, коли до З'-концу ланцюга, що росте, приєднується «неправильний» нуклеотид, нездібний утворити потрібні водневі зв'язки з матрицею. Коли pol III помилково приєднує неправильну підставу, «включається» її 3' -» 5'-экзонуклеазная активність, і ця підстава негайно віддаляється, після чого відновлюється полимеразная активність. Такий простий механізм діє завдяки тому, що pol III здатна працювати як полимераза лише на досконалій подвійній спіралі ДНК з абсолютно правильним спаровуванням підстав.
Ще один механізм видалення РНК-фрагментов заснований на присутності в клітках персоною рибонуклеазы, що отримала назву Рнкази Н. Етот Ф специфічний до двунитевым структур, побудованих з однієї рибонуклеотидной і одного дезоксирибонуклеотидной ланцюга, причому він гідролізує першу з них.
 Рнказа
Н також здатна видаляти Рнк-праймер з
подальшою забудовою розриву за допомогою
ДНК-полимеразы.
На завершальних етапах збірки фрагментів
в потрібному порядку діє ДНК-ЛІГАЗА, що
каталізує утворення фосфодиэфирной
зв'язку.
Рнказа
Н також здатна видаляти Рнк-праймер з
подальшою забудовою розриву за допомогою
ДНК-полимеразы.
На завершальних етапах збірки фрагментів
в потрібному порядку діє ДНК-ЛІГАЗА, що
каталізує утворення фосфодиэфирной
зв'язку.
Розкручування геликазами частини подвійної спіралі ДНК в хромосомах эукариот приводить до тієї, що надспіралізує решти частини структури, що неминуче позначається на швидкості процесу реплікації. Ті, що надспіралізують перешкоджають ДНК-ТОПОЇЗОМЕРАЗИ.
Таким чином, в реплікації ДНК, крім ДНК-полимеразы, бере участь великий набір Ф: геликаза, праймаза, Рнказа Н, ДНК-ЛІГАЗА і топоизомераза. Цим перелік Ф і білків, що беруть участь в матричному біосинтезі ДНК, далеко не вичерпується. Проте багато з учасників цього процесу до теперішнього часу залишаються мало вивченими.
В процесі реплікації відбувається «коректорська правка» - видалення неправильних (створюючих некомплементарні пари) підстав, включених в знов синтезовану ДНК. Цей процес забезпечує надзвичайно високу точність реплікації, що відповідає одній помилці на 109 пар підстав.
Теломери. У 1938г. класики генетики Б.Мак-клінтон и Г. Меллер довели, що на кінцях хромосом є спеціальні структури, які назвали теломерами (телос-конец, мерос-часть).
Учені виявили, що при дії рентгенівським опромінюванням стійкість проявляють лише теломеры. Навпаки, позбавлені кінцевих ділянок, хромосоми починають зливатися, що веде до важких генетичних аномалій. Т.ч., теломеры забезпечують індивідуальність хромосом. Теломери щільно упаковані (гетерохроматин) і малодоступні для ферментів (теломеразы, метилазы, эндонуклеаз і ін.)
Функції теломер.
1.Механические: а) з'єднання кінців сестринських хроматид після S-фазы; би) фіксація хромосом до ядерної мембрани, що забезпечує кон'югацію гомологов.
2.Стабилизационные: а) оберігання від недорепликации генетично значущих відділів ДНК (теломеры не транскрибируются); б) стабілізація кінців розірваних хромосом. У хворих би - таласемією в генах би - глобіну відбуваються розриви хромосоми 16д і до пошкодженого кінця додаються теломерные повтори (ТТАГГГ).
3.Вплив на експресію генів. Активність генів, розташованих поряд з теломерами, понижена. Це прояв сайленсинга – мовчання транскрипції.
4.«Счетная функція». Теломери виступають як годинний пристрій, який відлічує кількість ділень клітки. Кожне ділення укорочує теломеры на 50-65 н.п. А всього їх довжина в клітках ембріона людини складає 10-15 тисяч н.п.
Теломерная ДНК потрапила у поле зору біологів зовсім недавно. Перші об'єкти дослідження – одноклітинні прості – війкова інфузорія (тетрахимена), яка містить декілька десятків тисяч дуже дрібних хромосом і, значить, безліч теломер в одній клітці (у вищих эукариот менше 100 теломер на клітку).
У теломерной ДНК інфузорії багато разів повторюються блоки з 6-ти нуклеотидных залишків. Один ланцюг ДНК містить блок 2 тимин – 4 гуанин (ТТГГГГ - Г-ланцюг), а комплементарний ланцюг - 2 аденин – 4 цитозин (ААЦЦЦЦ - Ц-цепь).
Як же було здивування учених, коли виявили, що теломерная ДНК людини відрізняється від такої у інфузорії всього лише однією буквою і утворює блоки 2 тимин – аденин – 3 гуанин (ТТАГГГ). Більш того, виявилось, що з ТТАГГГ - блоків побудовані теломеры (Г – ланцюг) всіх ссавців, рептилій, амфібій, птахів і риб.
Втім, дивуватися тут нічому, оскільки в теломерной ДНК не закодовано ніяких білків (вона не містить гени). У всіх організмів теломеры виконують універсальні функції, мова про яких йшла вище. Дуже важлива характеристика теломерных ДНК – їх довжина. У людини вона коливається від 2 до 20 тисяч пар підстав, а у деяких видів мишей може досягати сотень тисяч н.п. Відомо, що біля теломер є спеціальні білки, що забезпечують їх роботу і що беруть участь в побудові теломер.
Доведено, що для нормального функціонування кожна лінійна ДНК повинна мати два теломеры: по одній теломере на кожен кінець.
У прокариот теломеров немає – їх ДНК замкнута в кільце.
Реплікація теломерных відділів ДНК.
1) Проблему сформулював А.М.Оловников в 1971 році тільки для лінійної ДНК – нові ланцюги виявляються укороченими з 5' кінців.
2) Недореплікация ДНК веде до старіння клітки.
ДНК – полимераза тільки подовжує 3' кінець вже наявного полінуклеотиду, а тут такого кінця просто немає – значить, новий ланцюг повинен бути декілька коротше старою. Утворюються гострі (50-65 н.п.) кінці ДНК, яка обрізається эндонуклеазами.
3) В середньому в 1 молекулі ОТРУТА-ДНК 120 млн. н.п., значить, укорочення ДНК за одне клітинне ділення складе ~ 0,00005%. Таким чином, якби кінці не відновлювалися, то через певну кількість ділень хромосоми взагалі зникли б!
Вирішення проблеми кінцевої недорепликации:
1) На кінцях хромосомної ДНК є гексануклеотидная послідовність без інформації:
5' ЦЦЦТАА > ТТАГГГ 3'
3' ГГГАТТ < < ААТЦЦЦ 5'
У 3' кінця ланцюга 5' ТТАГГГ 3' ці повтори у ембріона людини складають 10-15 тисяч н.п. (0,02%). Якщо втрачаються ці буферні ділянки, то це не відбивається на функції генома.
2) Подовження теломер за допомогою теломеразы (1984 р., Блекберн, Грайдер).
Подовжується старий ланцюг, довший (до обрізання гострого кінця!). До 3'-концу старого ланцюга пристроюються декілька сотень ТТАГГГ - повторів, які є матрицею для утворення ще одного фрагмента Оказаки.
3) Механізм ALT (альтернативний механізм) – без теломеразы у дрозофилы і деяких ракових кліток – рекомбінація між теломерными ділянками різних хромосом і подовження ДНК шляхом рекомбінації! Але роль ALT невелика!
Кінцева недорепликация ДНК.
Відомо, що ДНК-полимеразы, синтезуючи дочірній ланцюг ДНК, прочитує батьківський ланцюг в напрямі від її 3 – конца до 5 -концу. Відповідно дочірній ланцюг синтезується у напрямі 5' > 3'.
У протилежному напрямі синтез ланцюга ДНК фермент каталізувати не може. Крім того, ДНК-полимераза починає синтез тільки із спеціального Рнк-праймера — короткої РНК-затравки, комплементарної ДНК. Після закінчення синтезу ДНК Рнк-праймери віддаляються, а пропуски в одному з дочірніх ланцюгів ДНК заповнюються ДНК-полимеразой. Проте на 3'-конце ДНК такий пропуск заповнений бути не може, і тому 3'-концевые ділянки ДНК залишаються однотяжевыми, а їх 5'-концевые ділянки — недореплицированными. Звідси ясно, що кожен раунд реплікації хромосом приводитиме до їх укорочення. Зрозуміло, що, перш за все, повинна скорочуватися довжина теломерной ДНК.
Цим-то і пояснюється «ліміт Хейфліка», оскільки після того, як довжина теломерной ДНК стає загрозливо низькою, наступає період кризиса—неспособности клітки до подальшого ділення, а потім і її смерть. Хоча в культурах кліток in vitro клітки і гинуть від укорочення теломер, але для кліток in vivо нормального організму це практично неможливо. Так, згідно недавнім спостереженням Озави (1997) 89% мітохондріальній ДНК в мітохондріях серця 97- літнього старого містили обширні делеции, критичні для реплікації і транскрипції. Проте, ця людина померла не від серцевої недостатності, а від раки шлунку. Неважко уявити собі, що подальше наростання дисфункції мітохондріальної ДНК все ж таки привело б старого в недалекому майбутньому до смерті і це навряд чи мало відношення до укорочення ядерної ДНК.
Як наголошувалося, першим на проблему «кінцевої недорепликации ДНК» звернув увагу А.М. Оловников в 1971 році. Він висловив гіпотезу про те, що втрата кінцевих послідовностей ДНК унаслідок їх недорепликации веде до старіння клітки. Передбачалося, що процес укорочення теломер і є той годинниковий механізм, який визначає репликативный потенціал «смертної» клітки, і коли довжина теломер стає загрозливо короткою, цьому механізму запобігає подальше ділення клітки. А.М.Оловников припустив також, що в нестаріючих клітках (а до них окрім ракових відносяться зародкові, стволові і інші генеративные клітки) повинна існувати спеціалізована ферментативная система, яка контролює і підтримує довжину теломерной ДНК.
Гипотеза а.М. Оловникова знайшла переконливе підтвердження в подальші роки. По-перше, було встановлено, що теломеры нормальних (тобто приречених на старіння) кліток дійсно коротшають на 50-60 нуклеотидных ланок при кожному клітинному діленні. По-друге, в 1984 році Е. Блекберн і Е. Грайдер виділили фермент, який за допомогою механізму, відмінного від механізму реакцій, лежачих в основі реплікації ДНК, синтезує теломерную ДНК. Цей фермент був названий теломеразой. Отже, основне призначення теломеразы — синтезувати сегменти ДНК, з якої складається Г-ланцюг теломерной ДНК, що повторюються. Таким чином, вона відноситься до класу ДНК-полимераз, причому виявилось, що теломераза — це РНК-зависимая ДНК-полимераза або зворотна транскриптаза. Ферменти цього класу, що синтезують ДНК на РНК-матрицах, дуже добре відомі молекулярним біологам. Вони закодовані і містяться в ретровірусах (наприклад, у вірусі імунодефіциту людини, що викликає захворювання СНІДОМ) і служать для синтезу ДНК-копії їх геномів, який в ретровірусі представлений РНК. У клітинному геномі зворотні транскриптазы закодовані в ретротранспозонах.
РНК, використовувана теломеразой для синтезу теломерной ДНК як матриця, входить до складу цього ферменту. У цьому унікальність теломеразы: на сьогодні це єдина відома зворотна транскриптаза, що РНК-содержащая. Теломеразниє РНК у різних організмів сильно розрізняються по довжині і структурі.
Теломерази простих містять РНК завдовжки в 150—200 нуклеотидных залишків (н.о.), довжина теломеразной РНК людини — 450 н.о., тоді як теломераза дріжджів містить аномально довгу РНК (близько 1300 н.о.).
Матрична ділянка представлена в теломеразной РНК тільки один раз. Його довжина не перевищує довжину двох повторів в теломерной ДНК, яку він кодує і яким він комплементарен.
Оскільки теломераза синтезує сегменти ДНК, що повторюється багато раз, використовуючи тільки один сегмент своєї РНК, вона повинна володіти здатністю періодично (після завершення синтезу кожного повтору) переміщати (транслоцировать) матричну ділянку в район 3'-конца теломерной ДНК, що синтезується. Джерелом енергії для такого переміщення, мабуть, служить сама реакція синтезу ланцюга теломерной ДНК, оскільки дезоксинуклеозидтрифосфаты — субстрати цієї реакції — високоенергетичні речовини.
На першій стадії теломераза знаходить З'-конец теломерной ДНК, з яким частину матричної ділянки теломеразной РНК утворює комплементарний комплекс. При цьому теломераза використовує З'-конец хромосомної ДНК як праймера. Далі наступає черга РНК-зависимой ДНК-ПОЛІМЕРАЗНОЙ активності теломеразы.

Ріс.10. Механізм дії теломеразы
Вона забезпечується спеціальною субъединицей теломериразы, яка по пристрою свого каталітичного центру багато в чому схожа із зворотними транскриптазами ретровірусів і ретротранспозонов. Коли синтез ДНК-повтору закінчується, відбувається транслокация, тобто переміщення матриці і білкових субъединиц ферменту на наново синтезований кінець теломерной ДНК, і весь цикл повторюється знов (рис.10).
Це схемне уявлення є вельми умовним, оскільки для побудови теломер потрібний ще багато субъединиц, наприклад, ДНК, що відповідає за знаходження 3'-конца, або субъединицы, що відповідають за транслокацию, і так далі
Теломераза, рак і старіння. Розглянемо дані про довжину теломерной ДНК і активності теломеразы в різних клітках людини.
Висока теломеразная активність спостерігається в статевих клітках людини протягом всього його життя (табл.1). Відповідно їх теломеры складаються з найбільшого числа ДНК-повтору і містять всі необхідні білки для нормальної реплікації кліток.
Табл.1. Теломеразная активність різних кліток
-
Тип кліток
Теломери, т.п.н.
Теломеразная активність
Статеві
Соматичні
Ракові
15-20
10-12 при народженні
зменшуються з віком
4-6, 10-15
Висока
Відсутній
Присутній в 80% випадків
Аналогічна ситуація спостерігається і для стволових клітин, які діляться необмежено довго. Проте у стволової клітини завжди є можливість дати дві дочірні клітки, одна з яких залишиться стволовою («безсмертною»), а інша вступить в процес диференціювання. Завдяки цьому стволові клітини служать постійним джерелом різноманітних кліток організму. Наприклад, стволові клітини кісткового мозку дають початок гемопоэзу — процесу утворення кліток крові, а з базальних кліток епідермісу походять різноманітні клітки шкірного покриву. Як тільки нащадки статевих або стволових кліток починають диференціюватися, активність теломеразы падає і їх теломеры починають коротшати. У клітках, диференціювання яких завершене, активність теломеразы падає до нуля, і з кожним клітинним діленням вони з неминучістю наближаються до стану сенесенса (перестають ділитися). Услід за цим наступає криза, і більшість кліток гинуть. Ця картина характерна для переважної більшості відомих культур кліток эукариот. Проте і тут є рідкісні, але важливі виключення: теломеразная активність виявляється в таких «смертних» клітках, як макрофаги і лейкоцити.
Недавно було встановлено, що нормальні соматичні клітки тому позбавлені теломеразной активності, що в них повністю пригнічена експресія гена її каталітичною субъединицы (зворотної транскриптазы). Інші ж складові теломеразы, включаючи теломеразную РНК, утворюються в цих клітках, хоча і в менших кількостях, чим в їх «безсмертних» прародителях, але постійно. Відкриття цього важливого факту Дж. Шєєм, В. Райтом і їх співробітниками і стало основою для сенсаційної роботи по подоланню «ліміту Хейфліка».
Порівняно невелика довжина теломер у більшості ракових кліток наводить на думку про те, що вони походять з нормальних кліток, достигнувших передкризового стану. Цей стан характеризується порушенням регуляції багатьох біохімічних реакцій. У таких клітках відбуваються численні хромосомні перебудови, які зокрема ведуть і до злоякісної трансформації. Більшість цих кліток гинуть, але в частині з них в результаті випадкових мутацій може активуватися постійна експресія генів теломеразы, яка підтримуватиме довжину теломер на рівні, необхідному і достатньому для їх функціонування.
Якийсь час викликав подив той факт, що приблизно п'ята частина проаналізованих ракових пухлин і кліток взагалі не містила активною теломеразы. Виявилось, проте, що довжина теломер в них підтримується на належному рівні. Таким чином, в цих клітках діє інший (не теломеразный, а швидше рекомбінаційний) механізм утворення теломерной ДНК. Іншими словами, такі клітки знаходяться в тому ж ряду виключень з правила, що і дрозофила.
Останнім часом проводиться багато робіт, аналогічних роботі Дж. Шия, Ст. Райта. Були повідомлення про те, що клітки з штучно активованими теломеразой подолали 220 циклів ділення. Останні повідомлення прийшло з Південно-західного Медичного Центру в Далласі; у нім мовиться, що вже 220 поколінь кліток подолали 70-75 циклів ділення.
Репарація і захворювання людини як результат порушення репарації. Для збереження основних характеристик кліток і організмів даної популяції необхідне точне збереження структури і стабільності функції генетичного матеріалу впродовж тисяч і мільйонів років, не дивлячись на дію різних мутагенних чинників. Існує декілька причин високої стабільності структури і функцій ДНК. По-перше, це висока хімічна стабільність самої молекули ДНК, а по-друге, це наявність спеціальних механізмів репарації виникаючих змін. Широкий набір різних ферментів реплікацій здійснює безперервний «огляд» ДНК і видалення з неї пошкоджених нуклеотидов. Здібність кліток до виправлення пошкоджень в молекулах ДНК отримала назву репарації (лат.: reparatio — відновлення). Спадкова інформація представлена в ДНК у вигляді ланцюгів подвійної спіралі ДНК. Завдяки цьому випадкове пошкодження в одному з ланцюгів може бути виправлене ферментом реплікації, і дана ділянка ланцюга відновлена в своєму нормальному вигляді за рахунок інформації, що міститься в непошкодженому ланцюзі.
Класифікація репарацій. За часом здійснення в клітинному циклі розрізняють дорепликативную, репликативную і пострепликативную репарацію.
Дореплікатівная репарація. Це процес відновлення пошкодженої нитки ДНК до її подвоєння. У простих випадках розриви можуть возз'єднувати ферментом лигазой. У інших випадках використовується повна ферментативная система эксцизионной або неэксцизионной репарації.
Реплікатівная репарація. Це сукупність процесів відновлення ДНК в ході реплікації. При цьому пошкоджена ділянка віддаляється в ході реплікації в зоні зростання ланцюга. У забезпеченні високої точності реплікації велика роль належить механізму самокоррекции, здійснюваному ДНК-полимеразой або тісно пов'язаною з нею ферментом эндонуклеазой. Цей процес пов'язаний з визначенням помилково включеного в ланцюг нуклеотида, відщеплюванням його і заміною на відповідний. В результаті цього частота помилок знижується в10 разів (з 10-5до 10-6 ).
Постреплікатівная репарація. Її механізм точно не вивчений. При пострепликативной репарації відбувається вирізування пошкодженої ділянки, що змінює ген. При цьому клітка може зберігати життєздатність і передавати дефектну ДНК дочерним кліткам. Припускають можливість наявності різних варіантів синтезу ДНК на пошкодженій матриці.
По механізмах здійснення репарація підрозділяється на: неэксцизионную репарацію і эксцизионную (що вирізує) репарацію.
Неексцизіонная репарація. Фоторепарація. В результаті ультрафіолетового опромінювання цілісність молекул ДНК порушується, оскільки в них виникають димеры, тобто зчеплені між собою сусідні пиримидиновые підстави. Дімери можуть формуватися між двома тиминами, тимином і цитозином, двома цитозинами, тимином і урацилом, двома урацилами. Проте, опромінені клітки, на світлу виживають набагато краще, ніж в темноті. Після ретельного аналізу причин цього явища, встановлено, що в пошкоджених клітках на світлу відбувається репарація ДНК (фоторепарація). Вона здійснюється спеціальним ферментом ДНК-ФОТОЛІГАЗОЙ, що активується квантами видимого світла. Фермент з'єднується з пошкодженою ДНК, роз'єднує виниклі в димерах зв'язки і відновлює цілісність нитки ДНК. Фермент ДНК-ФОТОЛІГАЗА, що фотоактивується, немає видоспецифичным, тобто діє на різні види ДНК. Як кофермента в нім є цианокобаламин (витий. В|2), що поглинає кванти видимого світла і що передає енергію молекулі ферменту. При неэксцизионной світлової репарації виправляються пошкодження, що виникли тільки під впливом ультрафіолетових променів. На ранніх стадіях еволюції живих організмів, коли був відсутній озоновий екран, що затримує велику частину потоку згубних для організмів сонячних ультрафіолетових променів, фоторепарація грала особливо важливу роль.
Деалкилірованіє гуанинов. Якщо структура ДНК змінена в результаті приєднання до гуанину метилових або етилових груп, то репарацію здійснює фермент гуанин-алкилтрансфераза. Цей фермент відокремлює вказані групи і приєднує їх до себе, після чого структура пошкодженої ділянки ДНК відновлюється.
При эксцизионной (що вирізує) репарації усуваються пошкодження, що з'явилися під впливом іонізуючої радіації, хімічних речовин і інших чинників. Це основний тип репарації, який виявлений як у прокариот, так і в клітках эукариот (рис.11). Механізм эксцизионной репарації ДНК відрізняється тим, що не тільки розрізають димеры (як при світловій), але і вирізуються великі ділянки молекули ДНК (до декількох сотень нуклеотидов). Мабуть можуть віддалятися цілі гени, після чого відбувається репаративный комплементарний матричний синтез за допомогою ферменту ДНК-полимеразы.
Следствія порушення процесу репарації. До теперішнього часу виявлено декілька важких природжених захворювань із-за порушення процесу репарації.
Захворювання у людини, які викликаються генетичними порушеннями системи эксцизионной репарації: 1) пігментна ксеродерма, 2) синдром Кокейна, 3)трихотиодистрофия і 4) синдром передчасного старіння.
Пігментна ксеродерма, захворювання, причиною якого є рецесивна аутосомная мутація, що рідко зустрічається, унаслідок чого у таких дітей

Ріс.11. Схема эксцизионной репарації ДНК по видаленню Т-Т димера: А. Под дією УФ-ОБЛУЧЕНІЯ в ланцюзі ДНК може виникнути мутація (димер Т-Т). В. Соответствуюшая эндонуклеаза дізнається порушення і вирізує ділянку пошкодженого ланцюга ДНК. С. Удаленіє з пошкодженого ланцюга обширної ділянки (що включає димер) ДНК-полимеразой, экзонуклеазной активністю, що володіє. D. Матричний синтез вирізаної ділянки ланцюга за допомогою ДНК-полимеразы і з'єднання його з непошкодженою ділянкою. 1 - эндонуклеаза; 2 - ДНК-полимераза.
відсутній один з ферментів репарації ДНК. Шкіра хворих пігментної ксеродермой володіє підвищеною чутливістю до денного світла, що виявляється у вигляді фотодерматозів, включаючи рак шкіри. У ряді випадків відмічені аномалії нервової системи, причиною яких є мутації в одному з семи генів. Проте описані хворі з класичними симптомами пігментної ксеродермы, але з непорушеною системою NER. Для кліток цих хворих характерні зміни в так званій пострепликативной репарації.
Хворим з синдромом Кокейна властиві порушення зростання, розумова відсталість, катаракти, підвищена чутливість до світла з супутніми дерматозами. Виявлені мутації в двох групах генів, що приводять до цього захворювання.
У хворих трихотиодистрофией виявляються змішані симптоми двох перших захворювань.
Синдром передчасного старіння виникає, як і пігментна ксеродермия, при порушенні репараційної системи, яка усуває димеры тимина, що утворюються при УФ-ОБЛУЧЕНІЇ.
Даний синдром підтверджує припущення про те, що і нормальне старіння пов'язане з ослабленням діяльності систем репарації ДНК, так само як і інших захисних систем.
На внутріклітинному рівні існують такі захисні системи: репарація ДНК; теломеры і теломераза; антиоксидантная система (що знешкоджує вільних радикалів); система шаперонов (білків теплового шоку), поновлююча третинну структуру білків при її порушенні унаслідок, наприклад, локального сплеску температури; метилирование ДНК.
Генетична рекомбінація. У эукариот рекомбінацію у вузькому сенсі слова називають кросинговером, тобто рекомбінацією генів, локалізованих в гомологичных хромосомах.
У профазе I мейоза на стадії диплотены у багатьох організмів добре помітні характерні фігури, що утворюються гомологичными хромосомами, - хиазмы. Ще в 1909 р. Ф. Янсенс припустив, що утворення хиазм пов'язане з обмінами гомологичными ділянками гомологичных хромосом. Пізніше Т. Морган пов'язував хиазмы з кросинговером. У 1931г. Харріст Крейтон і Барбара Мак-клінток вирішили цю проблему для кукурудзи, а Курт Штерн - для дрозофилы. Вони показали, що в основі кросинговера лежить реальний обмін ділянками гомологичных хромосом за типом розрив-злиття. Поряд учених (До. Бріджес, І. Андерсон, 1925г. - на дрозофиле; Дж. Тейлор, 1967г. - на конику і ін.) було доведено, що кросинговер відбувається в профазе мейоза на стадії 4 ниток. В результаті цього утворюються хиазмы, які найзручніше спостерігати на стадіях диплотены і диакинеза.
Тип кросинговера в эукариот:
1. Рівний – «звичайний», на якому базується хромосомна теорія Моргана.
2. Нерівний - відбувається рідко, при нерівній кон'югації. При цьому в одній хромосомі опиняються два однакові гени (дупликация), а в іншій – жодного з пари (делеция).
Мітотічеський кросинговер був виявлений в 1936г. К. Штерном у дрозофилы при дослідженні забарвлення тіла і щетин. Його частота на 2-3 порядки менше мейотического.
Чинники, що впливають на кросинговер:
I) випромінювання (УФЛ, рентген-лучи, г-промені);
2) багато хімічних агентів;
3) збільшення і зменшення температури;
4) вік і ін.
Частота кросинговера знаходиться під строгим генетичним контролем. Було показано, що кросинговер не відбувається у самців D.melanogaster, а також у самок тутового шовкопряда.
Кросинговер — це процес обміну відповідними ділянками ДНК між несестринськими хроматидами гомологичных хромосом. При цьому відбувається обмін аллельными генами, що утворює їх нові комбінації в гомологичных хромосомах. Цей процес забезпечує перекомбинацию батьківських і материнських аллелей в групах зчеплення. Розбіжність гомологичных хромосом в різні клітки приводить до утворення різних по аллельному складу гамет. Випадкове розташування хромосом в площині клітки і подальше їх розбіжність в анафазе 1 забезпечує рекомбінацію батьківських груп зчеплення в гаплоидном наборі гамет. Кожна гамета є унікальною відносно аллельного складу. Разним аллельным складом гамет пояснюється те, що нащадки ніколи повністю не схожі один на одного або батьків. Хромосоми, що утворилися в результаті взаємообміну сегментами, відомі як рекомбинантные хромосоми, а хромосоми, интактными, що залишилися, називаються нерекомбинантными.
Молекулярний механізм кросинговера. У цьому процесі беруть участь дві молекули ДНК несестринських хроматид.
Ріс.12. Схема обміну одноцепочного між ДНК несестринських хроматид
Суть молекулярного процесу зводиться: а) до розриву двох довгих лінійних молекул ДНК в одній або декількох частинах; би) з'єднанню розірваних ланцюгів молекул ДНК сусідніх хроматид в іншому порядку; у) обміну нуклеотидными послідовностями; г) подальшому розриву і відновленню цілісності ланцюгів молекул ДНК. Процес завершується розбіжністю хромосом. В результаті — ланцюги контактуючих молекул ДНК мають змінений склад нуклеотидов.
У процесі беруть участь десятки різноманітних ферментів. Кросинговер як механізм рекомбінації ефективний тільки у тому випадку, коли відповідні гени гомологичных хромосом представлені різними аллелями. Однакові групи зчеплення не дають нових поєднань.
Типи кросинговера. Залежно від кількості хиазм, що з'явилися, можуть бути розглянуті наступні типи кросинговера:
одиночний кросинговер. В цьому випадку утворюється тільки одна хиазма, що веде до обміну тільки одним ділянкою ДНК гомологичных хромосом. Це найбільш поширений тип кросинговера (рис.12);
подвійний кросинговер. В цьому випадку утворюються дві хиазмы. Вони можуть з'являтися як між одними і тими ж несестринськими хроматидами, так і між разными несестринськими хроматидами. Цей тип кросинговера приводить до обміну двома ділянками ДНК гомологичных хромосом;
множинний кросинговер. В цьому випадку утворюється більше двох хиазм (перекрестов) між несестринськими хроматидами гомологичных хромосом. Далі вони можуть бути класифіковані як потрійні (3 хиазмы), четвертні (4 хиазмы) і так далі
Значення кросинговера. Кросинговер — широко поширене явище. Він відбувається практично у всіх організмів, що розмножуються статевим шляхом. Цей процес є молекулярною основою комбинативной мінливості. В результаті рекомбінації генів можуть з'являтися нові корисні ознаки і їх поєднання. Тому кросинговер має велике значення для виживання і розмноження. Цей процес також збільшує генетичну різноманітність потомства, що дуже важливе для пристосування і еволюції. Визначення частоти кросинговера лежить в основі картирования генів хромосом, тобто визначення місця розташування різних генів в хромосомі.
Форми обміну генетичним матеріалом у бактерій. Прокаріоти (бактерії, ціанобактерії) - гаплоидные організми. Для них немає поняття доминантность- рецесивність, вони не мають ні митоза, ні мейоза. З 1944г. по 1952г. у бактерій були розшифровані процеси, що приводять до об'єднання і рекомбінації генетичного матеріалу.
Крім основного механізму передачі генів — по спадку (по вертикалі), у бактерій існують наступні форми обміну генетичним матеріалом по горизонталі, тобто між окремими особинами в популяції кліток: трансформація, трансфекция, трансдукция, кон'югація і сексдукция.
Трансформація — перенесення генетичного матеріалу, що полягає в тому, що бактерія-реципієнт захоплює (поглинає) із зовнішнього середовища фрагменти чужорідної ДНК. Трансформація може бути спонтанною або індукованою. Індукована (штучно отримувана) трансформація відбувається при додаванні до культури бактерій очищеної ДНК, отриманої з культур тих бактерій, генетичні ознаки яких прагнуть передати досліджуваній культурі. Спонтанна трансформація відбувається в природних умовах і виявляється у виникненні рекомбинантов при змішуванні кліток, що генетично розрізняються. Вона протікає за рахунок ДНК, що виділяється клітками в навколишнє середовище унаслідок їх лізису або в результаті активного виділення ДНК життєздатними клітками-донорами. Як спонтанна, так і індукована трансформація зводиться, по суті, до поглинання трансформуючої ДНК і утворення рекомбинантов, причому спонтанна трансформація може відбуватися в результаті взаємного обміну ДНК. Ефективність індукованої трансформації багато в чому залежить від фізіологічного стану кліток-реципієнтів. Вони повинні знаходитися в стані своєрідної компетентності для цього процесу. Передбачається, що у фазі компетентності відбуваються значні зміни поверхневих шарів клітки, які сприяють поглинанню ДНК. Зокрема, аутолитические ферменти клітки розчиняють клітинну стінку в тих ділянках, де відбувається її синтез. При цьому мезосомы через отвори, що утворилися, стикаються із зовнішнім середовищем, адсорбують і втягують всередину клітки трансформуючу ДНК, де вона і вступає в рекомбінацію з ДНК реципієнта. В результаті цього утворюється мерозигота, клітина ділиться, і її нащадки успадковують ознаки, отримані від донора і реципієнта.
Проте в інших випадках поглинені фрагменти ДНК руйнуються нуклеазами клітки-реципієнта, і трансформації не відбувається. Її ефективність залежить також від розмірів трансформуючої ДНК: високомолекулярна ДНК поглинається важче, ніж менш крупні її фрагменти. Здібність до трансформації виявлена у ряду пологів бактерій, але, мабуть, роль її в обміні генетичним матеріалом серед бактерій в природних умовах менш істотна, чим роль інших механізмів. Річ у тому, що у багатьох бактерій є особливі системи рестрикції і модифікації. Ці системи модифікують свою ДНК (найчастіше шляхом її метилирования) і руйнують чужорідну ДНК, якщо вона так само не модифікована, за допомогою особливих ферментів — рестрикционных эндонуклеаз.
Ефективність методу генетичної трансформації у багато разів підвищується в тому випадку, якщо суміш ДНК і трансформованих кліток за допомогою спеціального приладу піддати обробці електричним імпульсом. Метод електротрансформації є універсальним, він застосовний до будь-яких видів бактерій. За допомогою цього методу здійснена трансформація більше 100 видів бактерій, і він може стати важливим інструментом отримання цінних рекомбинантных штамів бактерій.
Трансфекция — варіант трансформації бактерійних кліток, позбавлених клітинної стінки, здійснюваний вірусною (фаговой) нуклеїновою кислотою. За допомогою трансфекции вдається викликати у таких бактерій (без клітинної стінки) вірусну інфекцію. Трансфекцию можна здійснити і з іншими (не бактерійними) клітками, якщо ввести в них чужорідну ДНК, здатну рекомбинировать з ДНК цих кліток, або здатну відтворювати віріони, або самостійно реплицироваться.
Трансдукция — перенесення генетичного матеріалу від клітки-донора клітці-реципієнтові за допомогою бактеріофагів. Розрізняють трансдукцию неспецифічну і специфічну. Неспецифічна трансдукция — випадкове перенесення фрагментів ДНК від однієї бактерійної клітки до іншої.
Специфічна трансдукция здійснюється тільки помірними фагами, що володіють здатністю включатися в строго певні ділянки хромосоми бактерійної клітки і трансдуцировать певні гени.
Кон'югація - процес обміну генетичним матеріалом (хромосомним і плазмидным), здійснюваний при безпосередньому контакті кліток донора і реципієнта. Цей процес контролюється тільки конъюгативными плазмидами, що мають сукупність генів, звану tra-опероном (tra — від англ. transfer — перенесення). Цей оперон контролює синтез апарату перенесення, конъюгативную реплікацію і явище поверхневого виключення. Апаратом перенесення є спеціальні донорные ворсинки, за допомогою яких встановлюється контакт між конъюгирующими клітками. Донорниє ворсинками є довгі (1-20мкм) тонкі трубчасті структури білкової природи з діаметром внутрішнього отвору близько 3 нм. Число донорных пилей у кожної F+-клетки невелике і, очевидно, відповідає числу копій конъюгативной плазмиды в клітці. Донорниє ворсинки виявляють за допомогою донорспецифических фагов, які, адсорбуючись на них, проникають в клітку і викликають її лізис. Для кожної групи конъюгативных плазмид існують свої донор специфічні фаги. Ворсинки виконують наступні функції: 1) з їх допомогою встановлюється контакт між донорной і реципиентной клітками; 2) вони полегшують перенесення нитки ДНК (вона, ймовірно, протягається через ворсинку); 3) стягують клітки, що злучаються, що підвищує ефективність кон'югації.
Процес кон'югації протікає через наступні стадії: встановлення контакту між донором і реципієнтом, протягання нитки ДНК від донора до реципієнта, добудова перенесеної нитки ДНК комплементарною нею ниткою в реципиентной клітці і рекомбінація між переданою хромосомою (її фрагментами) і хромосомою клітки-реципієнта (рис.13), розмноження мерозиготы і утворення кліток, що несуть ознаки донора і реципієнта.

Ріс.13. Схема рекомбінації у бактерій
Суть поверхневого виключення полягає в тому, що під контролем tra-генов синтезуються білки зовнішньої мембрани, що перешкоджають (що виключають можливість) проникненню в клітку, що несе плазмиду, інший, але близькоспорідненої нею плазмиды, або що пригнічують конъюгативную реплікацію її ДНК.
Кон'югатівная реплікація переносимої нитки хромосомної або плазмидной ДНК здійснюється також під контролем плазмидных генів. Класичним прикладом конъюгативной плазмиды є статевий чинник, або F-плазмида (F — від англ. fertility — плодючість). Ця плазмида є двунитевую кільцеподібну молекулу ДНК, що складається з 94,5 тисяч п. н. Головна функція цієї плазмиды — контроль кон'югації у бактерій кишкової групи. Її tra-оперон містить більше тридцяти генів, які контролюють процес кон'югації. Ця плазмида може знаходитися як в автономному стані, так і інтегруватися в хромосому клітки. Знаходячись в автономному стані, вона контролює тільки власне перенесення, при якому FЕ-клетка (клітка, позбавлена F-плазмиды) перетворюється на F+-клетку (клітку, що містить F-плазмиду), F-плазмида може інтегруватися в певні ділянки бактерійної хромосоми, в цьому випадку вона почне контролювати конъюгативный перенесення хромосоми клітки. При цьому одна з ниток ДНК хромосоми в місці інтеграції F-плазмиды розрізає, і її 5'-конец через донорный місток починає протягуватися в клітку-реципієнта. Реплікація ДНК в цьому випадку протікає за принципом кільця, що «крутиться». Таким чином, кон'югація починається зі встановлення контакту між донором і реципієнтом за допомогою донорной ворсинки. Остання змикається з рецептором клітинної мембрани клітки-реципієнта.
Нерідко такий контакт встановлюється не тільки між двома клітками, а між багатьма клітками, утворюючи агрегати спаровування. Припускають, що нитка ДНК в процесі кон'югації протягається через канал донорной ворсинки. Оскільки донорный місток є неміцним, процес кон'югації може у будь-який момент урватися. Тому при кон'югації може переноситися або частина хромосоми, або рідше, повна хромосома. За допомогою F-плазмид частота перенесення генів між бактеріями істотно зростає. Тому клітки, у яких F-плазмида итегрирована в хромосому, позначають як клітки Нfг (Нfг — від англ. high frequency recombination — клітки, що забезпечують високу частоту рекомбінацій).
В деяких випадках інтегрована в хромосому F-плазмида може з неї виключатися і, подібно до помірного фагу, «вихоплювати» з хромосоми її ген або навіть цілу групу генів. Така плазмида, що містить в своїй ДНК частину генів хромосоми клітки, називається FЕ-плазмидой.
Сексдукция — перенесення генетичного матеріалу між бактерійними клітками, здійснюване FЕ-плазмидой за допомогою механізму, аналогічного специфічною трансдукции.
Завершальним етапом при будь-якій формі обміну генетичним матеріалом є рекомбінація між привнесеною ДНК і хромосомою клітки-реципієнта. Якщо переноситься одна нитка ДНК, то вона спочатку добудовується комплементарною нею ниткою; рекомбинируют між собою тільки двунитевые ДНК. Розрізняють загальну рекомбінацію, сайт-специфическую рекомбінацію і рекомбінацію, контрольовану елементами, що транспонуються. Загальна рекомбінація відбувається між гомологичными ДНК. Сайт-специфічеськая рекомбінація відбувається за рахунок наявності специфічних ділянок у рекомбинируемых молекул ДНК. Її прикладом є специфічна рекомбінація між помірним фагом л і хромосомою Е.соli. Як у бактерійній хромосомі, так і в ДНК фага л є специфічні ділянки (аttВ і аttP відповідно), між якими і відбувається сайт-специфическая рекомбінація. Загальна і сайт-специфическая рекомбінації контролюються геном rесА.
Рекомбінації, здійснювані елементами, що транспонуються, теж є сайт-специфическими, але специфічність цих сайтів пов'язана з особливими нуклеотидными послідовностями, і ця форма рекомбінації не залежить від rесА-гена.
Головним генетичним детермінантом всіх шляхів рекомбінації є ген rесА. Його пошкодження повністю виключає можливість утворення рекомбинантов. Основний шлях rесА-рекомбинации здійснюється за участю продуктів генів rесВ і rесС (вони кодують синтез эндонуклеазы V).
У разі мутації по rесВ і rесС виходу рекомбинантов складає близько 20% від rеc+. Проте ці мутації можуть бути виправлені шляхом механізмів супрессии в двох генах: sbсАЕ і sbсВЕ. Супрессиі sbсАЕ відкривають додатковий шлях рекомбінації через ген rесЕ (його продукт — экзонуклеаза VIII). Супрессиі sbсВЕ реалізують рекомбінації через ген rесЕ (структурний ген экзонуклеазы I). Таким чином, генетичний контроль рекомбінацій носить складний характер.
Вивчення його механізму — одне з центральних завдань молекулярної генетики. Особливий інтерес представляє вивчення механізму гомологической рекомбінації. Це визначається перспективами розвитку молекулярної медицини. Одному з найважливіших стратегічних завдань, поставлених перед програмою «Геном людини», є виявлення змін первинної структури ДНК, яка приводить до порушення функції генів і, як наслідок цього, до розвитку спадкових захворювань людини. Ідеальним методом лікування їх є генотерапия, заснована на заміні пошкодженого («хворого») гена здоровим в місці його локалізації на хромосомі. Така заміна може бути здійснена тільки за допомогою гомологической рекомбінації, механізми якої у бактерій і эукариот, очевидно, багато в чому схожі. У бактерій виявлено два способи такої рекомбінації, здійснюваних двома типами рекомбиназ: АТФ-зависимым білком RесА і не-залежною ренатуразой. Відповідно, і у эукариот виявлена АТФ-зависимые і не-залежна ДНК-трансферазы, серед якої знайдені білки, функціонально схожі з RесА-белком бактерій.
Вирішальна роль в гомологической рекомбінації у бактерій, як вказано вище, належить гену rесА. Його продукт — білок RесА з м.м. 38 кД — володіє поряд унікальних функцій: 1) він міцно зв'язується з одиночними нитками ДНК; 2) сприяє вивільненню розірваної нитки з подвійної спіралі ДНК; 3) він одночасно може приєднуватися і до подвійної спіралі ДНК, і до одиночної нитки і утримувати їх разом; 4) він володіє властивістю ДНК-ЗАВІСИМОЙ АТФ-азы. Завдяки цій властивості забезпечується серія конформаційних перетворень, які обумовлюють перетворення трехнитевого комплексу з неспареними підставами в трехнитевый комплекс із спареними підставами. За допомогою цієї реакції відбувається пряма комплементарна взаємодія між одиночною ниткою ДНК і подвійною спіраллю — головна подія в процесі рекомбінації. Енергія гідролізу АТФ RесА-белком використовується останнім для просування одиночної нитки уздовж подвійної спіралі ДНК з метою знаходження того її ділянки, яка має гомологичную послідовність нуклеотидов, необхідну для замикання водневих зв'язків, тобто для спаровування. Для пояснення механізму гомологической рекомбінації запропоновані різні моделі. Відповідно до найбільш популярної моделі, рекомбінація ініціюється за допомогою однонитевого розриву в одній з двох гомологичных молекул ДНК, що викликається эндонуклеазой, яка кодується генами rесВ і rесС, кінець (3'- або 5'-конец) однонитевой ДНК (онДНК), що Утворюється при цьому, атакує подвійну спіраль іншої молекули ДНК, відшукуючи в ній гомологичный ділянку, і утворює тимчасову трехнитевую структуру. В результаті спаровування атакуючої молекули онДНК з комплементарною ниткою іншої молекули ДНК відбувається виштовхування її нитки, що звільняється, яка у свою чергу злучається з комплементарною ниткою іншої молекули ДНК. Під час цих подій часто спостерігається видалення деякої кількості нуклеотидов, репарація пролому, що утворюється, і лигирование ДНК, але, кінець кінцем, утворюється передбачена Р. Холідєєм полухиазма [від греч. chiasmos — розташування у вигляді грецької букви Х (хи)]. У разі обміну з перехрещенням ниток обидві гомологичные спіралі ДНК після початкового етапу спаровування утримуються разом завдяки перехресному обміну нитками з тих, що є чотири — по одній нитці від кожної спіралі. Структура, що утворюється при цьому, володіє двома важливими властивостями:
1. Точка обміну між двома гомологичными спіралями, тобто місце, де схрещуються дві їх нитки, може швидко мігрувати по спіралі. Цей процес отримав назву міграції гілок. Міграція може значно збільшувати області спаровування між двома взаємодіючими нитками, що спочатку належали різним молекулам ДНК.
2. Ця структура, завдяки обертанню складових її елементів щодо один одного, може знаходитися в різних ізомерних формах. Ізомеризація змінює положення двох пар ниток: дві нитки, що раніше перехрещуються, стають такими, що не перехрещуються, і навпаки. Для припинення процесу спаровування в кожній з двох ниток повинен відбутися розрив. Якщо він відбудеться до ізомеризації, у кожної спіралі буде замінена тільки одна з ниток і лише на короткому відрізку. Якщо ж розрив відбудеться після ізомеризації, наступить повний кросинговер.
Фермент ренатураза кодується у E.соli геном rесЕ. Він відноситься до класу «гомологических ДНК-СИНАПТАЗ», які, на відміну від RесА-белка, не володіють ДНК-ТРАНСФЕРАЗНОЙ активністю і не залежать від АТФ. Ці білки беруть участь в реакціях гомологической рекомбінації, що індукуються двунитевыми розривами ДНК.
Ген rесА бере участь не тільки в процесі рекомбінації, його продукт необхідний для пострепликативной репарації, індукції профага, клітинного ділення і ряду інших життєво важливих для бактерій функцій. Рецесивні мутації в цьому гені неминуче відбиваються на всіх цих функціях, тому вони отримали назву SOS-функций, а їх сукупність об'єднана в єдину SOS-систему (від англ. SOS — сигнал лиха — save our souls — врятуйте наші душі або save our ship — спасите наш корабель).
Вираз будь-якій SOS-функции залежить від активності продукту rесА-гена. SOS-система спрацьовує після будь-яких дій на ДНК агентами, які ушкоджують її структуру, або порушують нормальний процес її реплікації, або порушують інші функції. Тому rесА-гену належить провідна роль в забезпеченні самозахисту генетичної системи бактерійної клітки.
Генна конверсія. Ще один тип мінливості пов'язаний з внутрішніми змінами в повторах - це генна конверсія. Ми проілюструємо її наступним прикладом. Уявимо собі два варіанти одного і того ж тексту (А і Б), що відрізняються декількома замінами слів або фраз. Можна створити третій варіант, скроївши з А і Б, як при реципрокной рекомбінації, тексти-гібриди А-Б і Б-А. Але при цьому початкові варіанти відновити по ним не вдасться. Можна скопіювати з Би окремий фрагмент і, зберігши варіант Би, вставити цей фрагмент на місце відповідної ділянки в А, створивши гібрид А - Б - А. Отже, при обміні між двома гомологичными послідовностями А і Б (які ми вважатимемо ідентичними, окрім декількох замін нуклеотидов, що дозволяють їх розрізняти) Б передає в А всю або частина своєї послідовності, але сам при цьому залишається в колишньому стані. Результат конверсії, отже, полягає в тому, що пара (А, Би) «конвертується» в (А-Б-А, Би) (рис.14). Існування подібного механізму було продемонстроване в 1970-1980 рр. в генетичному плані на грибах Ascobolus, а в 1982 р. в молекулярному плані - на дріжджах Saccharomyces cerevisiae.
Отже, генна конверсія характеризується однонаправленим перенесенням надмірного і декілька відмінного генетичного матеріалу (якби він був ідентичним, його не можна було б відрізнити). Одна послідовність грає роль донора, другая- реципієнта, причому последовательность- донор в ході конверсії не змінюється. Продемонструвати генну конверсію вищих організмів досить важко, оскільки їх генетичний аналіз дуже не простий. Проте, мабуть, саме генною конверсією пояснюється та мінливість, яку спостерігали в генах імуноглобулінів і в генах гистосовместимости. Механізм генної конверсії представляється загальним і працює як між двома аллелями, тобто в рамках фундаментальної надмірності будь-якої диплоидной клітки, так і на рівні сімейств повторів, що як кодують, так і не кодують, тобто між неаллельными ділянками. Цей механізм приводить одночасно до двох наслідків: до більшої мінливості (впровадження в ген А гомологичной послідовності, запозиченій з гена Б) і до гомогенізації послідовностей, що дозволяє членам мультигенных сімейств залишатися в сусідстві один з одним.
Роль цих генетичних феноменів, пов'язаних з надмірністю ДНК в клітках, вельми істотна. Якщо при цьому відмітити, що ряд послідовностей володіє здатністю «транспонуватися» з однієї ділянки хромосоми в іншій, то ми приходимо до можливостей, досі не підозрюваних: делеции, стиснення або розширення сімейств послідовностей, утворення гібридних генів шляхом рекомбінації або конверсії, зміна локалізації деяких послідовностей і ще багато що інше. Звичайно, події такого роду відносно рідкісні. Але все-таки вони існують, виявляючись раптовими скачками в «мутаційній» еволюції генома. А структура останнього у результаті втрачає стабільність, що дозволила свого часу Менделеві відкрити свої знамениті закони. У якій же мірі еволюція генома порушує ці закони?

Ріс.14. Нерівний кросинговер і генна конверсія
При кон'югації хромосом в процесі мейоза між неаллелъными генами з мулътигенного сімейства може походити рекомбінація по одному з двох механізмів: в результаті нерівного кросинговера або в результаті генної конверсії. При нерівному кросинговері (вгорі) утворюються гібридні гени (АВ і В А) із загальним нерівним розподілом генів по гомологичным хромосомах. При такій рекомбінації одна з парних хромосом навіть втрачає ділянку ДНК. Послідовність подібних кросинговерів приводить до збільшення і зменшення числа генів. У разі генної конверсії (внизу) відбувається передача частині гена (наприклад, В) в інший гомологичный ген з утворенням химери ABA. Оскільки в другій хромосомі ген В залишається незмінним, припускають, що така передача відбувається при мейозе під час синтезу ДНК. Підсумок генною конверсии- збереження початкових генів в одній з хромосом (А і В) і «конверсія» гена в другій хромосомі (ABA і В). Обидва цих механізму, достатньо часті і поширені, лежать в основі перебудов послідовності ДНК, по праву вважаючись сьогодні двигуном еволюції.
