
- •Передмова
- •Частина 1. Молекулярні основи спадковості
- •Введення в молекулярну біологію.
- •1.2. Макромолекули як обьекты вивчення молекулярної біології
- •1.2.2. Будова, функції і властивості днк.
- •Молекулярна організація генів.
- •Рнк і її роль в збереженні і реалізації спадкової інформації.
- •Лікарські засоби, що впливають на синтез нуклеїнових кислот і білків.
- •1.3. Експресія генів і її регуляція
- •1.4. Організація геномів неклітинних і клітинних організмів
- •Геном бактерій
- •Організація генома эукариот.
- •Частина 2. Молекулярні основи спадкових захворювань
- •2.1. Молекулярні механізми генних, хромосомних і геномів мутацій
- •2.2. Регуляція клітинного циклу. Апоптоз. Онкогенетика.
- •Частина 3. Сучасні питання генних технологій
- •3.1 Дослідження нуклеїнових кислот. Методи днк-діагностики
- •3.2 Методи генної інженерії
- •3.3 Клонування організмів і кліток.
- •Додатки контрольно-повчальні питання
- •Відповіді на контрольному – повчальні питання
- •Термінологічний словник
- •Література
1.3. Експресія генів і її регуляція
Механізми генної експресії. Поняття про експресію генів. Сучасний стан центральної догми молекулярної генетики. Властивості генетичного коду. Етапи біосинтезу білка. Ферментатівниє механізми і етапи транскрипції. Процесинг первинних транскриптов. Альтернативний процесинг, РНК-редактирование. Активація амінокислот. Молекулярна організація рибосом. Ініціація, элонгация і терминация синтезу полипептидной ланцюжка. Трансляція поста модифікація білків.
Регуляція експресії генів. Регуляція експресії генів у прокариотов. Катаболічні і анаболізм оперони бактерій. Контроль експресії генів у эукариотов. Регуляція на рівні процесів транскрипцій. Білки – чинники транскрипції. Поняття про эпигенетической регуляцію експресії генів. Метілірованіє ДНК, імпринтінг генома. Гормональна регуляція експресії генів. Контроль на рівні трансляції і процесів трансляцій поста.
Механізми генної експресії. Хоча не всі клітки ссавця виглядають і поводяться однаково, вони мають ідентичний генетичний матеріал. Сьогодні ми знаємо, що близько 200 різних клітинних фенотипов в організмі людини відрізняються тим, які гени в них экспрессируются, а також сигналами, що визначають час експресії певного гена або набору генів.
Генна експресія – це сукупність молекулярних механізмів реалізації спадкової інформації, завдяки яким ген проявляє свій потенціал в конкретній фенотипічній ознаці організму.
Процес експресії гена складається з декількох етапів:

Кожен етап, у свою чергу, має початок (ініціація), продовження (элонгация) і кінець (терминация), де також здійснюється контроль генної експресії *
а) на основі гена ДНК синтезується про-мРНК. Перший етап експресії називається «транскрипцією»; б) крупна молекула про-мРНК піддається «процесингу», в результаті цього значно зменшується в розмірах. Утворюється «зріла» мРНК, прочитування інформації з якою спрощується. Біологічний сенс процесингу - полегшення доступу до генетичної інформації; у) мРНК за участю тРНК «вибирає» необхідні амінокислоти, які зв'язуються на рибосоме в строго певну послідовність поліпептиду. Процес перенесення інформації з мРНК на поліпептид називається «трансляцією»; г) синтезований поліпептид піддається «модифікації» і перетворюється на активний білок; д) функціонуючи, білок робить свій внесок в морфологічну або функціональну ознаку (фенотип) клітки або організму. Це процес називається «експресією».
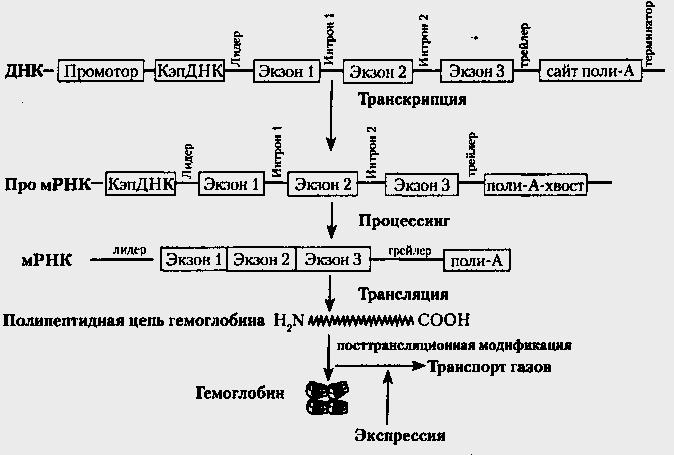
Ріс.18. Схема етапів експресії гена Я - цenu гемоглобіну
Схема механізму експресії представлена на рис.18 на прикладі експресії гена в-цепи гемоглобіну. В процесі транскрипції бере участь не тільки смислова частина гена, але і інші регуляторні і структурні частини. Утворювана про-мРНК містить всі елементи, характерні для гена ДНК. Процесинг істотно модифікує про-мРНК, яка перетворюється на мРНК і містить набагато менше структурно-функціональних елементів. На основі мРНК трансляція створює молекули абсолютно іншої природи — поліпептиди, нічого що не мають загального з нуклеїновими кислотами і абсолютно іншими властивостями, що володіють, і організацією. Модифікація поліпептидів приводить до ще одного природного явища — появи складної просторової організації молекули білка. Відбувається перехід лінійної інформації ДНК і РНК в просторову організацію протеїну, яка, у свою чергу, є основою специфічної просторової взаємодії молекул в живому організмі, що і лежить в основі життя і всіх життєвих явищ. В даному випадку процес модифікації забезпечує просторову організацію – об'єднання чотири субъединиц гемоглобіну в єдиний комплекс. В результаті всіх етапів експресії виявляється ознака — здібність до транспорту газів (О2 і Со2).
Сучасний стан центральної догми молекулярної біології. Хромосомна ДНК містить повну інформацію про всіх білок, що синтезуються в клітці. Ця інформація закодована в ДНК у вигляді особливої послідовності азотистих підстав, званої генетичним кодом. Специфічна послідовність нуклеотидов гена транскрибируется в мРНК і потім транслюється на рибосомах, забезпечуючи строгий порядок амінокислот в полипептидной ланцюзі. Уявлення про те, що інформація зберігається в ДНК і реалізується шляхом її передачі від ДНК до мРНК, а потім до поліпептиду, а при розмноженні шляхом реплікації з одного покоління в інше, вважається основною догмою (основним законом) молекулярної біології. Вона була запропонована Ф. Кріком в 1958 р. Схематично її можна представити таким чином:
Реплікація транскрипція трансляція ДНК > ДНК > РНК > Білок
У 1970 р. Темін повідомив про те, що РНК, що функціонує як генетичний матеріал в деяких вірусах, може синтезувати комплементарну копію ДНК для впровадження в геном клітки-господаря. Значить, у вірусів інформація поступає не обов'язково від ДНК до РНК, але може також і від РНК до ДНК (зворотна транскрипція). Здійснюється вона за допомогою ферментів — ревертаз (лат. rever-sio — повернення). Це властивість нуклеїнових кислот використовується в генній інженерії.
Передача інформації «заборонена» від білків назад до нуклеїнових кислот. Це означає, що модифікації білків - генних продуктів не успадковуються. Центральна догма відкидає ламаркізм. Всі типи передачі генетичній інформації здійснюються на основі комплементарних міжмолекулярних взаємодій: А=т, Ц=г.
Проте історія з клонуванням в 1996 році знаменитої нині овечки Доллі в шотландській фірмі PPL Therapeutics (комерційного відділення Розлін Інституту в Едінбургу) дозволяє поглянути на центральну догму зовсім інакше. Колектив учених, очолюваний Іеном Уїлмутом, продемонстрував, що їм вдалося, використовуючи соматичні клітки дорослої тварини, отримати клональное тварина. Це означає, що біологічний годинник може бути повернені назад, і розвиток організму може початися з генетичного матеріалу дорослої диференційованої клітки, що повністю противоречит раніше загальноприйнятій біологічній догмі.
Властивості генетичного коду. Унікальність різноманітних кліток обумовлена унікальністю їх білків. Клітки здатні синтезувати індивідуальні білки за рахунок використання інформації, записаної в молекулі ДНК. Ця інформація існує у вигляді особливої послідовності азотистих підстав нуклеотидов в нитках ДНК і називається генетичним кодом. Порядок азотистих підстав в мРНК, яка побудована по матриці ДНК, визначає порядок скріплення амінокислот в поліпептиді, що синтезується (табл.3). Кожна амінокислота кодується послідовністю трьох азотистих підстав (триплетом, або кодоном). Таким чином, генетичний код є певною строгою послідовністю триплетів в молекулі ДНК, контролюючу порядок розташування амінокислот в молекулах білків.
У ДНК є чотири підстави, а в білках-20 амінокислотних залишків; синглетный код міг би кодувати тільки чотири амінокислотні залишки, дублетний-4-4 = 16 амінокислот, а триплетный утворює 4 - 4 • 4 = 64 разных кодону.
Код не перекривається, тобто в послідовності підстав Авсdеfgнi перші три підстави, АВС, кодують амінокислоту 1, DЕF- амінокислоту 2 і так далі Якби код був таким, що перекривається, то послідовність АВС кодувала б амінокислоту 1, СDЕ-аминокислоту 2 і так далі Характер коду, що не перекривається, відноситься тільки до випадку, коли рамка прочитування не міняється. У коді відсутні коми, тобто немає знаків, що відокремлюють один кодон від іншого.
Напрям читання закодованому запису - від 5'-конца до З'-концу мРНК, транскриптом, що є « + »-цeпи ДНК, ліченій з неї у напрямі 5' -» 3'. Перший з 5'- кінця кодон відповідає N-концевой амінокислоті полипептидной ланцюга. Отже, білки синтезуються від N-конца до С-концу.

Табл.3. Генетичний код
Таблиця коду указує, яка амінокислота кодується тим або іншим кодоном. У таблиці 5 перший (з 5'-конца) нуклеотид поміщений в лівому стовпці, другий - у верхньому рядку, а третій (на 3'-конце) -в правому стовпці. З представлених в таблиці 64 кодонів 61 кодон детермінує ту або іншу амінокислоту (наприклад, Сuа відповідає лейцину Lеu), а три останніх кодону є сигналами терминации. Ці три кодони називаються нонсенсом-кодоном, оскільки вони не визначають ніякої амінокислоти. Крім цього, коли кодони Аug для Меt і іноді GUG для Vаl знаходяться на початку послідовності і відповідні амінокислоти повинні бути поміщені на початку білкового ланцюга, ці амінокислоти зазвичай присутні у вигляді N-формильных похідних. Коли ж ці кодони знаходяться в будь-якому іншому місці послідовності, то в пептидний ланцюг включаються нормальні Меt і Vаl.
Код вироджений, тобто більшість амінокислот кодуються більш ніж одним кодоном. Наприклад, Рhе кодується двома кодонами -UUU і UUС. Кодони, які визначають одну і ту ж амінокислоту, називаються кодонами- синонімами. Вирожденность коду, як правило, виражається в тому, що у кодонів, що визначають одну і ту ж амінокислоту, перші дві підстави фіксовано, а третє положення може займати одне з двох, три або чотирьох різних підстав. Зокрема, кодони з одним з двох пиримидинов (З або U) в третьому положенні завжди є синонімами, тоді як кодони з одним з двох пуринів (А і G) в третьому положенні бувають синонімами лише іноді. Відмінності по всіх трьом положенням спостерігаються лише в деяких випадках (наприклад, UСG і Аgu обидва кодують Sеr).
Кожна тРНК може дізнаватися до трьох кодонів. Хімічні властивості різних амінокислот знаходять віддзеркалення в структурі коду. Всі кодони з U в другому положенні кодують амінокислоти з гидрофобной бічним ланцюгом (Рhе, Lеu, Не, Меt і Vаl). Якщо виключити кодони, що термінують, то наявність А в другому положенні визначає полярний або заряджений бічний ланцюг (Тугий, Нis, Glп, Аsп, Lуs, Аsр і Glu). Рамка прочитування задає положення першої підстави кодону мРНК (або гена). Оскільки код триплетен, число можливих рамок прочитування рівне трем. Зазвичай функціональний білок синтезується тільки при одній рамці прочитування, але деякі віруси використовують дві або навіть три рамки прочитування, при цьому синтезуються різні білки.
Мутация- це зміна в послідовності підстав генетичного матеріалу даного організму. Знання генетичного коду дозволяє пояснити ефект деяких мутацій.
Мутация-, що мовчить, це така зміна в нуклеотидной послідовності, яка приводить до утворення синонімічного кодону, і в результаті амінокислотна послідовність кодованого білка не змінюється. Структура коду така, що мутації, що мовчать, часто бувають, обумовлені змінами підстав лише в третьому положенні кодону.
Заміна (миссенс-мутация) веде до заміщення однієї амінокислоти інший в результаті такої зміни послідовності підстав, яке не приводить до утворення синонімічного кодону. Так, захворювання серповидно-клітинна анемія виникає в результаті заміни Glu на Vаl в шостому положенні Я-цепі гемоглобіну людини. Це обумовлено зміною кодону GАА на GUА, тобто заміною А на U в другому положенні.
Мутація із зрушенням рамки обумовлена вставкою або видаленням (делецией) одного або більшого числа підстав в послідовності, так що при цьому змінюється рамка прочитування. Це приводить до зміни амінокислотній послідовності білка від точки мутації до С-конца молекули.
Універсальність генетичного коду означає, що все живі организмы-эукариоты, прокариоты і віруси - використовують один і той же код. Хоча, взагалі кажучи, це положення справедливе, проведені порівняно недавно (1981 р.) визначення нуклеотидной послідовності мітохондріальної ДНК людини і дріжджів виявили деякі незвичайні факти. Наприклад, триплет UGА не є кодоном, що термінує, а кодує Тгр, а триплети Аgа і Аgс не кодують Аrg, а є терминаторами.
Генетичний код був розшифрований на початку 60-х років Ніренбергом, Кораной і їх співробітниками. Ніренберг отримав клітинний екстракт Е. соli, що містив всі компоненти, необхідні для синтезу білка, включаючи рибосомы, все тРНК і аминоацил-тРНК-синтетазы. У систему додавали полінуклеотид poly(U) (тобто UUUUU UU...), що функціонував як штучна мРНК. Виявилось, що poly(U) детермінує синтез poly(Phe) (тобто Рhе Рhе Рhе ...); отже, триплет UUU кодує Рhе. Аналогічні досліди показали, що триплет ССС кодує Рrо, а триплет Ааа-lуs. Наступний крок полягав у використанні полирибонуклеотидов, що містили два, три або чотири разных підстави, розташованих у випадковому порядку. В результаті цих досліджень вдалося визначити склад інших кодонів, але не послідовність підстав в них; так, було показано, що кодон, 2U, що містить, і 1G, детермінує Суs, але порядок підстав залишався невідомим. Корану використовував полирибонуклеотиды не з випадковою, а із заздалегідь заданою послідовністю і визначив структуру декількох кодонів. Ці дослідження отримали подальший розвиток за допомогою іншого підходу, розробленого Ніренбергом. Він виявив, що тринуклеотиды викликають пов'язання специфічних аминоацил-тРНК з рибосомой. Наприклад, у присутності UGU з рибосомой зв'язується тільки аминоацил-тРНК для Суs. Отже, UGU кодує Суs. Три кодони, UАА, UАG і UGА, не кодують ніяких амінокислот і визначають терминацию синтезу.

Ріс.19. Схема організації генетичного коду і процесу реалізації спадкової інформації: 1 — ДНК, 2 — мРНК, 3 — поліпептид.
Строга послідовність нуклеотидов в молекулі ДНК кодує певну послідовність нуклеотидов в мРНК. Кожен триплет нуклеотидов кодує одну конкретну амінокислоту. В результаті трансляції, на основі генетичного коду, на рибосомах синтезується необхідний білок (рис.19).
Таким чином, генетичний код ДНК має наступні фундаментальні характеристики:
Тріплетность. Три азотисті підстави, що є сусідами, звані кодоном, кодують одну амінокислоту.
Специфічність. Кожен окремий триплет кодує тільки одну певну амінокислоту.
Неперекриваємость. Азотиста підстава певного триплета ніколи не входить до складу іншого кодону.
Відсутність розділових знаків. Генетичний код не має «відміток пунктуацій» між кодуючими триплетами в структурних генах.
Універсальність. Кодон в ДНК або мРНК визначає одну і ту ж амінокислоту в білкових системах всіх організмів від вірусу до людини.
Надмірність. Одна амінокислота часто має більш ніж один кодовий триплет.
Коллінеарность. ДНК — лінійний полинуклеотидная ланцюг, а білок — лінійна полипептидная. Послідовність амінокислот в білці відповідає послідовності триплетів в його гені (у прокариот).
Однонаправленість — процес прочитування інформації генетичного коду з матричного ланцюга молекули ДНК йде тільки в одному напрямі — від 5 '- кінця до 3 '-концу.
Етапи біосинтезу білка. Транскрипція ДНК і процесинг РНК. Транскрипція - процес перенесення генетичної інформації від ДНК до РНК. Всі види РНК- мРНК, рРНК і тРНК - синтезуються відповідно до послідовності підстав в ДНК, матрицею, що служить. Транськрібіруєтся тільки одна, так звана « + » - ланцюг ДНК. Процес транскрипції у прокариот і эукариот істотно розрізняється.
Транскрипція у прокариот. ДНК-ЗАВІСИМАЯ РНК-полімераза - це фермент, що каталізує синтез РНК. Він складається з 4 субъединиц. Їх комплекс називається холоферментом. Для ініціації транскрипції необхідні холофермент, нуклеозидтрифосфат (завжди АТР або GTP) і наявність спеціальної ділянки в ДНК, званого промотором. Коли полимераза зв'язується з промотором, відбувається локальне розплітання подвійної спіралі ДНК і утворюється відкритий промоторний комплекс.
Промотор- це ділянка молекули ДНК, що має розмір близько 40 пар підстав і розташований безпосередньо перед ділянкою ініціації транскрипції. Синтез РНК завжди починається з підстав А або G в « + »- ланцюги ДНК. Ділянка скріплення холофермента розташована вище за сайт ініціації (тобто у напрямі 3' -> 5' в «+ »-цепи) на відстані приблизно 10 підстав. Якщо порівняти послідовності підстав « + »-цепи ДНК у разных промоторов, то ми виявимо, що вони вельми близькі, хоча і не ідентичні. Ця так звана послідовність Прібнова має вид Татрuатрu, де Рu означає пурин (А або G). Таким чином, холофермент зв'язується із специфічною послідовністю або групою послідовностей. Зазвичай на відстані близько 40 підстав вище ділянки ініціації знаходиться друге місце скріплення РНК-полімерази.
Елонгация ланцюга РНК- це та стадія транскрипції, яка наступає після приєднання приблизно восьми рибонуклеотидов. У цей момент РНК-полімераза зазнає деякі структурні зміни, при якому від комплексу відділяється одна субъединица, а що залишаються три (кор-фермент) каталізують подальше подовження ланцюга РНК. При цьому до ланцюга приєднуються ті рибонуклеотидтрифосфаты, які забезпечують правильне спаровування з « —»- ланцюгом ДНК. Рухомий уздовж ДНК кор-фермент діє подібно до застібки-блискавки, «розкриваючи» подвійну спіраль, яка замикається позаду ферменту у міру того, як відповідні підстави РНК злучаються з підставами ДНК в « —»-цeпи. «Розкрита» ферментом область тягнеться тільки на декілька пар підстав. Термінация (припинення зростання) ланцюга РНК відбувається на специфічних ділянках ДНК, званої терминаторами. Початок цих ділянок зазвичай збагачений GС-парами, а решта послідовності -АТ-парами. GС-богатый ділянка часто є палиндром. Це означає, що при русі уподовж « + »-цeпи в одному напрямі, а уподовж « — »-цeпи- в протилежному, читається одна і та ж послідовність підстав. У зупинці синтезу РНК саме на терминаторе важливу роль грає р-белок.
Процесинг транскрипції поста - це процес дозрівання, при якому первинний Рнк-транськріпт модифікується і перетворюється на зрілу РНК. Характер і ступінь модифікації РНК залежать від типу РНК.
Молекули мРНК у прокариот не піддаються процесингу. У деяких бактерій транскрипція і трансляція зв'язані, тобто відбуваються одночасно. 5'-конец мРНК може транслюватися на рибосоме і потім піддаватися деградації ще до завершення синтезу її З'-конца. Молекули тРНК спочатку синтезуються у вигляді про-тРНК, яка приблизно на 20% довше, ніж відповідна тРНК. Зайві послідовності, розташовані у 5'- і З'-концов, віддаляються за допомогою таких ферментів, як рибонуклеазы Q і Р. Іногда молекула про-тРНК складається з двох або більш за молекули тРНК, сполучених між собою. Їх розділення також здійснюється за допомогою рибонуклеаз. Якщо З'-конец тРНК не несе кінцевої послідовності ССА, то ці підстави приєднуються при синтетичній для поста модифікації. Всі тРНК містять мінорні підстави, які є хімічно модифікованими формами чотирьох головних підстав (А, З, G і U). Ця модифікація відбувається після завершення транскрипції.
Гени рРНК прокариот розташовані в блоках транскрипцій. Три гени рРНК Е. соli (16S, 23S і 5S) розташовуються разом з генами декілька тРНК в одному такому блоці і транскрибируются у вигляді однієї молекули РНК. Ці молекули рРНК і тРНК відокремлені один від одного спейсерной РНК. Розщеплювання первинного транскрипта на окремі складові каталізує рибонуклеаза Q; оскільки цей фермент специфічний до двухцепочечной РНК, припускають, що в області спейсеров утворюються двухцепочечные шпильки, які фермент дізнається і вирізує.
Транскрипція у эукариот. У эукариот для транскрипції використовуються три ДНК-ЗАВІСИМИХ РНК-полімерази. Полімераза I локалізована в ядерці, де вона каталізує синтез рРНК у вигляді великого первинного транскрипта, що містить молекули рРНК 18S, 5,8S і 28S. Полімераза II знаходиться в нуклеоплазме і, ймовірно, бере участь в синтезі первинного транскрипта мРНК. Полімераза III також локалізована в нуклеоплазме і бере участь в синтезі тРНК і 5S-pPHK.
Синтез РНК (мал. 20) включає стадії ініціації, элонгации і терминации, але в цих процесах часто беруть участь інші ферменти і послідовності підстав, чим у прокариот. Наприклад, промоторні послідовності у эукариот відрізняються від таких у прокариот. Проте першими підставами, що включаються в РНК при ініціації, є, як і у прокариот, А або G.
Молекули мРНК зазвичай утворюються з великих за розміром молекул-попередників, званих гетерогенною ядерною РНК (гяРНК). Для утворення зрілої мРНК ці молекули піддаються модифікації по 5'- і З'-концам і сплайсингу. Після такої модифікації транскрипты переносяться з ядра в цитоплазму.

Ріс.20. Схема синтезу мРНК
Сплайсинг мPHK-это видалення послідовностей РНК, відповідних интронам ДНК, і з'єднання ділянок, які транскрибированы з кодуючих послідовностей (экзонов). Місце сплайсинга повинне бути визначене з високою точністю, оскільки помилка навіть в одну підставу приведе до синтезу білка з неправильною амінокислотною послідовністю. Така специфічність сплайсинга забезпечується строго певною послідовністю підстав в интроне, що відповідає зазвичай підставам GU або GА на початку відповідної РНК і підстав Аg-в кінці.
Модифікація 5'-конца мРНК приводить до утворення особливої послідовності, званою кэп-структурой. При модифікації З'-конца до нього приєднується послідовність poly(A) довжиною 150-200 нуклеотидов.
Завдяки альтернативному сплайсингу число білкових продуктів, що синтезуються, очевидно, в 1,5-2 рази більше, ніж число генів. Явище альтернативного сплайсинга полягає в наступному. З одного і того ж первинного Рнк-транськріпта в процесингу РНК в різних тканинах утворюється не один, а декілька разных по довжині мРНК-транскриптов. Відповідно синтезовані поліпептиди також будуть різними. Таким чином, одна і та ж ДНК-послідовність може кодувати не один, а декілька різних поліпептидів.
Роль сплайсинга:
Створення нових генів в ході еволюції.
Повніше економічне використання записаної в геномі інформації.
Регуляція активності генів.
Мутації, що ведуть до порушення сплайсинга на межі экзон-интрон (усередині интрона вони бесследны) грають істотну роль у виникненні ряду спадкових хвороб людини. Очевидно, що раз вони так сильно міняють функціональну організацію гена, то їм може належати істотна роль в е р б процесах створення нових генів в ході еволюції.
Процесинг тРНК у эукариот протікає приблизно по такому ж механізму, як і у прокариот. Функціонально активні молекули утворюються з довшого попередника, який піддається розщеплюванню і модифікації з включенням мінорних підстав.
Процесинг рРНК також аналогічний відповідному процесу у прокариот. Первинний транскрипт містить ділянки, 18S-, що відповідають, 5,8S- 28S-pPHK, розділені спейсерами. Як і у прокариот, ці три рРНК утворюються при розщеплюванні спейсерных послідовностей.
Молекулярна організація рибосом. Суб'едініци рибосом утворюються в ядерці, а потім через ядерні пори окремо поступають в цитоплазму. Їх кількість в цитоплазмі залежить від синтетичної активності клітки і може складати від сотні до тисяч на одну клітку. Їх функцією є синтез білків. Найбільша кількість рибосом виявлена в клітках, що інтенсивно синтезують протеїни. Зустрічаються також в мітохондріальному матриксі і хлоропластах.
Рібосоми будь-яких організмів — від бактерій до ссавців, характеризуються схожістю структури і складу, хоча клітки прокариот мають рибосомы менших розмірів і в меншій кількості. Кожна складається з декількох різновидів молекул рРНК і десятків різновидів білків приблизно в однаковій пропорції. Маленька і великі субъединицы знаходяться в цитоплазмі окремо, поки не залучені в білковий синтез. Вони об'єднуються один з одним молекулою мРНК при необхідності синтезу і знов відокремлюються з припиненням процесу (рис.21).

Ріс.21. Суб'едініци прокариотических (а) і эукариотических (б) рибосом
Різні розміри і склад білків і рРНК, що відрізняється, обумовлює різну чутливість до деяких антибіотиків. Наприклад, тетрациклін діє тільки на рибосомы бактерії і пригнічує синтез білків в цих клітках, не впливаючи на эукариотические клітки господаря.
Молекули мРНК, синтезовані в ядрі, поступають в цитоплазму до рибосомам. З цитозоля молекулами тРНК до рибосомам доставляються амінокислоти, де за участю ферментів і АТФ синтезуються білки. Якщо з однією молекулою мРНК з'єднуються декілька рибосом, то утворюються полісоми, які містять від 5 до 70 рибосом.
Механізм трансляції у прокариот (Е. соli). Стартовим сигналом на початок синтезу білка служить розташований на мРНК кодон Аug, що кодує метіонін (Меt) [іноді це кодон GUС для валина (Vаl)]. У полипептидной ланцюзі, що росте, першим амінокислотним залишком завжди буде або Меt, або Vаl. Тоді виникає законне питання: яким чином клітка відрізняє стартовий сигнал від кодонів Аug або GUС, розташованих в середині молекули мРНК? Ця проблема вирішується за допомогою модифікованої форми Меt (або Vаl) і спеціальною тРНК, що ініціює. Формілметіонін (fМеt) і є тією модифікованою формою Меt, з якою починається синтез білка. Він приєднується до молекул тРНК певного типу (тPHKf), відмінним від тPHKMet, за допомогою яких Меt включається в серединну частину полипептидной ланцюга. І тPHKf, і тPHKMet дізнаються кодон Аug, але лише тPHKf здатна приєднуватися до стартового кодону Аug. Ініціація синтезу білка починається з моменту утворення комплексу, що ініціює, на 30S-субчастице, що складається з мРНК, Зоs-субчастіци рибосомы і молекули aминoaцил-тPHKf з приєднаним fМеt, яка зв'язується з ділянкою Р. Следующим кроком є приєднання 50S-cyбчacтицы, внаслідок чого утворюється комплекс, що 70S-инициирующий. Джерелом енергії для ініціації синтезу білка служить реакція гідролізу GТР до GDР і Рj. На цьому етапі необхідно ще декілька білків, званих чинниками ініціації (IF1, IF2 і IFЗ).
Елонгация - це послідовне включення амінокислотних залишків до складу полипептидной ланцюга, що росте. Кожен акт элонгации складається з трьох етапів: 1) пізнавання кодону, 2) утворення пептидного зв'язку і 3) транслокация.
Пізнавання кодону полягає в скріпленні антикодону чергової молекули аминоацил - тРНК з кодоном вільної ділянки А на рибосоме. Щоб прикріплятися до рибосоме, тРНК з приєднаною до неї амінокислотою повинна спочатку утворити комплекс з білком, званим чинником элонгации Еf-тu, або EF1, який заздалегідь повинен бути активований за допомогою GТР. Після того, як відбудеться пов'язання всього комплексу тРНК-ЕFl -GТР з ділянкою А рибосомы, здійснюється гідроліз GТР до GDР і Рj, що задовольняє енергетичні потреби на цьому етапі элонгации. Чинник EF1 • GDР, нездібний більш зв'язуватися з тРНК, покидає рибосому, на якій залишається аминоацил-тРНК. Регенерацію активованого чинника EF1 каталізує другий чинник элонгации, Еf-тs, або EF2, який заміщає GDР в неактивованому комплексі, внаслідок чого утворюється комплекс EF1 • EF2.
Утворення пептидного зв'язку відбувається лише тоді, коли обидві ділянки, А і Р, зайнято молекулами аминоацил-тРНК. Частиною 50S-cyбчacтицы є фермент пептидилтрансферазу, що каталізує утворення пептидного зв'язку. В результаті цієї реакції полипептидная ланцюг, що росте, виявляється приєднаним до тРНК ділянки А, а тРНК ділянки Р вивільняється з комплексу з пептидом і несе на З'-конце групу — ОН.
Транслокация включає три акти, що каталізують ще одним чинником элонгации, EF-G(EFЗ), і енергетично зв'язаних з гідролізом GТР. Спочатку тРНК ділянки Р, не пов'язана з пептидом, покидає рибосому, потім молекула полипептидил-тРНК переходить з ділянки А на Р і, нарешті, рибосома переміщається уподовж мРНК на три нуклеотидных залишку у бік З'-конца. В результаті цих трьох актів звільняється ділянка А і експонується черговий кодон, що дозволяє початися наступному циклу элонгации.
Термінация, тобто закінчення синтезу, відбувається по команді кодонів UАА, UGА або UАG. У природі не існує таких молекул тРНК, антикодони яких відповідали б цим кодонам. Замість продовження синтезу ланцюга відбувається терминация, що каталізує спеціальними білками, які названі чинниками терминации (RF1 і RF2) і які дізнаються кодони, що термінують, коли вільна ділянка А. Еті чинники змінюють специфічність ферменту пептидилтрансферазы таким чином, що відбувається гідроліз зв'язку між кінцевим пептидом і тРНК, а звільнений полипептидная ланцюг диффундирует від рибосомы. Услід за цим відбувається дисоціація комплексу мРНК- рибосома. Далі рибосома диссоциирует на 30S- і 50S-cyбчacтицы. Після реассоциации цих субчастинок з іншою молекулою мРНК весь цикл синтезу білка починається спочатку.
Трансляція у эукариот, що здійснюється в цитоплазмі, включає такі ж етапи, що і трансляція у прокариот. Основною відмінністю тут є те, що першим залишком в полипептидной ланцюзі, що росте, є Меt, а не fМеt. Проте і в цьому випадку є два типи молекул тРНК, що дізнаються кодон Аug: один- коли кодон ініціює, а другой- коли він кодує Меt, який повинен бути приєднаний в середині полипептидной ланцюга, що росте. В ролі чинників ініціації і элонгации виступають різні білки. Ще одна істотна відмінність полягає в тому, що в цитоплазмі эукариот рибосомы більші (80S).
У мітохондрій і хлоропластів трансляція здійснюється в самих цих органеллах. Рібосоми, які вони містять, є 70S-частицы і схожі на рибосомы бактерій. При ініціації використовується fМеt. Послідовність подій при трансляції у эукариот така:
інформосоми переносять мРНК в цитоплазму
утворюється комплекс старту трансляції: мРНК + мала субъединица рибосомы + стартова тРНК
приєднання великої субъединицы рибосомы і початок синтезу білка від 5’ до 3’
в цей же час відбувається активація амінокислот шляхом їх взаємодії з АТФ
приєднання активованих амінокислот до специфічної тРНК
власне трансляція або полімеризація амінокислотних залишків на рибосоме в полипептидную ланцюг
закінчення синтезу (терминация) – рибосома дійшла до кодону-терминатора і весь комплекс – мРНК, мала і велика частини рибосомы, тРНК, білок – розпадається і при необхідності він знову може збиратися до нового синтезу білка.
Весь процес трансляції йде за допомогою додаткових приблизно 50 спеціальних білків: чинників ініціації, элонгации, терминации. У загальних рисах процес трансляції однаковий у всіх організмів.
Трансляція поста модифікація білків. Синтезований з амінокислот поліпептид — це практично прямолінійна молекула, що не володіє метаболічною активністю. Далі білок мимоволі і за допомогою шаперонов приймає II, III і інші структури. Новий полипептидная ланцюг вивільняється в цитоплазму, эндоплазматическую мережу або комплекс Гольджі, де завершується побудова білкової молекули. В процесі «дозрівання» вона може втрачати деякі кінцеві амінокислоти за допомогою ферменту экзопептидазы, а потім утворювати вторинну і третинну структури. Молекули можуть об'єднуватися з іншими поліпептидами для утворення чверткової структури. Синтезовані макромолекули можуть об'єднуватися з вуглеводними або ліпідними молекулами, а також вбудовуватися в біомембрани або інші комплекси клітки. Процеси зміни первинної лінійної структури поліпептиду і формування просторової структури білкових молекул називаються пострансляционной модифікацією. В результаті цього білки набувають специфічних властивостей і функціональної активності.
Роль шаперонов у формуванні бактеріофагів. Для фолдинга вірусних білків теж потрібні шапероны. Розглянемо це на прикладі бактеріофага Т4, який розмножується в клітках E.Coli. Віріон Т4 включає три компоненти – головка, хвіст і хвостові фибрилы (короткі і довгі). Головка є білковою порожнистою капсулою (капсид) у вигляді многогранника і щільно упакованою в ній лінійною молекулою ДНК. За останніми даними, ДНК фага Т4 містить близько 250 генів. До складу ж зібраної фаговой частинки входить не більше сотні різних білків. Решта білок, кодованої фаговой ДНК, грає допоміжну роль: забезпечують протікання різних стадій фаговой інфекції, у тому числі і збірку готових віріонів.
Серед цих допоміжних білків є і шапероны. Т. е. фаг приносить з собою в клітку, крім іншого, інформацію про своїх власних шаперонах, які забезпечуватимуть фолдинг його власних структурних білків. Абсолютно вражаюча «передбачливість »!
В той же час при фолдинге ряду фаговых білків використовуються і бактерійні шапероны.
Регуляція експресії генів.
Контроль експресії генів здійснюється на наступних рівнях:
на рівні транскрипції (контролюється час і характер транскрипції гена)
на рівні процесингу первинного транскрипта
при відборі зрілих мРНК для їх транспорту в цитоплазму
на рівні трансляції - відбір в цитоплазмі мРНК для трансляції на рибосомах
на рівні деградації - виборча дестабілізація певних типів мРНК в цитоплазмі
на рівні активності білка - селективна активація, инактивация або компартментация молекул білка після їх синтезу.
Експресія генів як у прокариот, так і у эукариот регулюється за допомогою цілого ряду механізмів. Деякі з механізмів такого роду, що діють в бактерійних системах, вивчені досить добре, і два з них будуть розглянуті нижче, але про те, як діє реrуляторные механізми в клітках эукариот, відомо небагато.
Концепція оперону в регуляції експресії генів у прокариот. Ген зазвичай неактивний, але коли необхідний певний білок, конкретний ген «активується», що обумовлює виробництво цього білка. Таким чином, клітки мають механізм, контролюючий кількість будь-якого білка в певний час. Синтез білків регулюється генетичним апаратом, а також чинниками внутрішнього і зовнішнього середовища.
Структура оперону прокариот. У 1961 р. два французькі біологи Ф. Джакоб і Ж. Моно запропонували механізм регуляції генів, названий гіпотезою оперону.
Оперон — це послідовність спеціальних, функціональних сегментів ДНК, а також структурних генів, які кодують і регулюють синтез певної групи білків одного метаболічного ланцюга, наприклад, ферментів гліколізу. Оперон (регульована одиниця транскрипції) складається з наступних структурних частин (спеціальних послідовностей нуклeoтидoв) (риc.22):
Промотор — ділянка ДНК, до якої приєднується РНК- полимераза і починається транскрипція.
Оператор — ділянка промотора, що зв'язує білок-регулятор.
Структурні гени (цистроны) — ділянки ДНК, кодуючі мРНК конкретних білків.
Термінаторний ділянку ДНК несе сигнал про зупинку транскрипції.

Ріс.22. Схема структури оперону (А): негативний контроль (Б) і позитивний контроль (В) експресії генів.
Основні механізми регуляції функціонування оперону прокариот. Гени-регулятори під дією клітинних чинників обумовлюють синтез регуляторних білків. Такі білки, з'єднуючись з певними нуклеотидными послідовностями ДНК (оператором), можуть сприяти або перешкоджати приєднанню РНК-полімерази до промотору. У випадку якщо білок регулятор не дає можливість ферменту приєднуватися до промотору, він називається репрессором (мал. 22, Би). В цьому випадку здійснюється негативний контроль транскрипції з боку гена-регулятора. У випадку якщо білок-регулятор сприяє приєднанню РНК-полімерази до промотору і початку процесу транскрипції, його називають білком-активатором, і здійснюється позитивний контроль з боку гена-регулятора (мал. 22, В). У процесах регуляції експресії генів беруть участь також речовини небілкової природи { эффекторы), що взаємодіють з білками-регуляторами і що змінюють їх здатність зв'язуватися з опероном. Наприклад, кінцевий продукт метаболічного ланцюга. Залежно від результатів такої дії серед эффекторов розрізняють індуктори, сприяючі транскрипції, і корепрессоры, що перешкоджають їй.
Функціонування лактозного оперону Е. coli. У своїх эксперементах Джакоб і Моно виявили, що додавання лактози до культури E.coli індукує освіту відразу трьох білків-ферментів: галактозидазы, пермеазы і трансацетилазы, необхідних клітці для розщеплювання лактози до глюкози і галактозы. Гени, що кодують ці ферменти, є сусідами один з одним в хромосомі. Їх назвали структурними генами, або цистронами. Вони одночасно транскрибируются РНК-полімеразой в довгу одиночну мРНК, яка має кодони для всіх трьох ферментів. мРНК, трансрибируемая з декількох генів, називається полицистронной. Здібність до транскрипції цих цистронов контролюється ділянкою молекули ДНК — оператором. Операторний локус — це певна ділянка оперону, що має певну послідовність нуклеотидов, завдовжки 27 пар підстав. Цей сегмент ДНК розташовується в області промотора, до якого перед початком транскрипції приєднується РНК-полімераза. Промотор розташований перед початком першого структурного гена в-галактозидазы. Цистрон «синтезує» мРНК, коли оператор включений і припиняє синтез, коли він «вимкнений». Оператор включається або вимикається білком, званим репрессором. Його синтез контролюється регуляторним геном. Репрессор або зв'язується з оператором, пригнічуючи його активність, або не зв'язується з ним, дозволяючи прояв активності структурних генів. Таким чином, репрессор є негативним регулятором.
На малюнку 23 представлена схема функціонування лактозного оперону. Репресія (I). За відсутності індуктора (лактози), репрессор зв'язується з оператором і блокує транскрипцію, в цьому випадку ферменти не утворюються. Індукція (II). Лактоза індукує транскрипцію генів, оскільки инактивирует репрессор. До промотору приєднується РНК-полімераза і починається транскрипція генів А, В і З. В результаті утворюються необхідні в даних умовах ферменти. Синтез ферментів може не тільки індукуватися, але і пригнічуватися.
Наприклад, в результаті якогось ланцюга реакцій в клітці утворюється кінцевий продукт Д в більшому, ніж це необхідно клітці, кількості. Це може порушити нормальний хід реакцій обміну, тому в клітці виникає необхідність зупинити даний процес. Тоді речовина Д вступає в реакцію з відповідним білком-репрессором і переводить його в активний стан. Після цього відбувається приєднання репрессора до оператора, тим самим вимикається вся система оперону і синтез ферментів припиняється. В даному випадку, гальмування синтезу проводиться кінцевим продуктом, що утворюється в результаті реакції. Такий механізм дії називається регуляцією за принципом зворотного зв'язку.

Ріс.23. Схема функціонування лактозного оперону Е. соli
Описаний механізм регуляції має велике пристосовне значення. Наприклад, згідно наявній генетичній програмі, кишкова паличка може синтезувати декілька десятків ферментів, що розщеплюють різні речовини, оскільки склад середовища, навколишній бактерії, дуже мінливий. У цих умовах постійне утворення всього набору ферментів було б неекономічним для клітки, оскільки недоцільно продукувати одночасні 60-80 ферментів, з яких в даних умовах середовища можуть знадобитися лише 6-8. Тому синтез непотрібних в цих умовах ферментів блокований, а клітки утворюють лише декілька необхідних білків.
Ще одним різновидом негативної регуляції є так звана катаболитная репресія. Репресія відбувається тоді, коли репрессор зв'язується з оператором не інакше, як в комплексі з низькомолекулярним кофактором (корепрессором). Таким корепрессором часто буває кінцевий продукт білкового синтезу, що кодується опероном. Тоді, якщо концентрація цього продукту стає дуже високою, він зв'язується з репрессором і подальший його синтез припиняється. Прикладом такої системи може служити триптофановый оперон.
Тріптофановий оперон складається з оператора і п'яти структурних генів (А-Е). Останні кодують ферменти, що беруть участь в біосинтезі триптофана, одній з незамінних амінокислот. У міру збільшення концентрації триптофана наступає момент, коли подальший його синтез стає небажаним і транскрипція припиняється. «Виключення» транскрипції відбувається таким чином. Тріптофан зв'язується з димерным репрессором (trр-репрессором), який кодується окремим регуляторним геном, що не входить в оперон. При цьому відбувається конформаційна зміна, і відкривається ділянка, здатна зв'язуватися з операторною послідовністю в ДНК. Весь комплекс зв'язується далі з ДНК і блокує місце пов'язання з РНК-полімеразой (промотор). Це приклад регуляції за допомогою репресії.
Варіація довжини транскрипта - ще один механізм, за допомогою якого може здійснюватися регуляція экспресии оперонів в бактеріях. Так, в trр-опероне крім репресії використовується і інша система регуляції. Вона пов'язана з наявністю в ДНК ділянки, розташованої безпосередньо перед першим структурним геном {trрЕ) і званого аттенуатором. Аттенуатор є нуклеотидную послідовністю, що містить команду, по якій відбувається передчасна терминация транскрипції. У разі trр-оперона при високій концентрації триптофана 90% всіх транскриптов термінує після транскрипції всього лише 140 нуклеотидов і до початку транскрипції структурних trр-генов. Позитивна регуляція - ще один спосіб регуляції експресії гена (на малюнку не показаний). Він відрізняється від негативної регуляції тим, що транскрипція «включається», а не «вимикається» після приєднання регуляторного білка до оперону. Корепрессор, або швидше коактиватор, приєднується до білка-активатора; далі весь комплекс зв'язується з відповідною ділянкою на ДНК, і лише після цього може відбуватися транскрипція. Прикладом регуляції такого типу може служити процес, що відбувається за участю катаболитного білка-активатора, коактиватором якого є сАМР (див. додаткову літературу). У відсутність (або при низькій концентрації) сАМР, що має місце при розмноженні бактерій у присутності глюкози, блокується, таким чином, транскрипція деяких оперонів, включаючи lбс-оперон. Таке явище називається катаболитной репресією.
Контроль експресії генів у эукариот. Еукаріотічеськие організми в значній частині представлені багатоклітинними формами з високою спеціалізацією кліток. Всі клітки багатоклітинного організму виникають із зиготы шляхом митоза і отримують повноцінний набір генетичної інформації. Проте вони відрізняються один від одного по морфології, біохімічним і функціональним властивостям. Ці відмінності засновані на функціонуванні в різних клітках неоднакових частин генома. Велика частина генома людини знаходиться в клітках організму в неактивному, репресованому, стані, і лише 7-10 % активно транскрибируются. Функціональна активність генів залежить від тканинної приналежності клітки, від періоду її, життєвого циклу і стадії індивідуального розвитку організму. З активно функціонуючих генів в більшості кліток основна маса генів забезпечує синтез білків загального призначення (білки рибосом, гистоны, тубулины і так далі), тРНК і рРНК. Транськрібірованіє цих генів відбувається шляхом приєднання РНК-полімерази до промотору і називаються вони конститутивними генами. Існує ще одна група генів, функціонування яких, а також швидкість і тривалість їх транскрипції залежить від різних регулюючих чинників, що стимулюючих або забороняють з'єднання РНК-полімерази з промотором гена. Називають ці гени - регульовані. Хоча у всіх клітках людини міститься абсолютно однакова ДНК, в різних тканинах відбувається експресія далеко не однакових наборів генів. Таким чином, повинні існувати якісь механізми, за участю яких одні гени працюють (тобто экспрессируются), а інші немає. Для цієї мети використовується цілий ряд механізмів: регуляція на рівні транскрипції і на рівні трансляції, регуляція транскрипції поста і трансляції поста і регуляція за допомогою гормонів.
Регуляція на рівні транскрипції здійснюється при синтезі мРНК. Середні концентрації індивідуальних мРНК, транскрибируемых з різних генів, сильно відрізняються один від одного. Це обумовлено тим, наприклад, що мРНК-копии одних генів руйнуються швидше за інших, або тим, що їх синтез відбувається повільніше. Регуляція може здійснюватися за допомогою білків, здатних зв'язуватися з ДНК, і навіть за допомогою коротких фрагментів РНК, які злучаються з ДНК, імовірно блокуючи місця прикріплення РНК-полімерази. Таким чином, швидкість транскрипції може знижуватися або, навпаки, підвищуватися.
Окрім більш менш постійного статусу експресії, активність багатьох генів може швидко мінятися під дією спеціальних регуляторів. Наприклад, інтенсивність транскрипції матричної рибонуклеиновой кислоти (мРНК) може тимчасово збільшуватися або зменшуватися під впливом білків, які зв'язуються з регуляторними зонами гена. Активність регуляторних білків, у свою чергу, контролюється рецепторами, локалізованими або усередині клітки, або на її поверхні. Різноманітні рецептори розпізнають специфічні молекули, такі як стероїдні гормони, пептидні чинники зростання і нейромедиаторы, і передають молекулярні сигнали всередину клітки, що контролює активність регуляторних білків, що діють на дезоксирибонуклеїнову кислоту (ДНК).
У транскрибируемой матриці ДНК виділяє дві головні функціональні області — що кодує і регуляторну. Матрична РНК транскрибируется з ДНК (що кодує білок) за допомогою ферменту РНК-полімерази II. Регуляторна область гена зазвичай знаходиться перед початком кодуючої області. Регуляторні елементи ДНК розташовуються поряд з кодуючою областю (примикають до неї), вони називаються cis-регуляторными елементами. Навпаки, чинники транскрипції регуляторних білків, що зв'язуються з субелементами, є trans-регуляторами після відношення до гена-мішені, оскільки гени, що кодують їх, знаходяться далеко (наприклад, на іншій хромосомі).
Регуляторна область структурного гена містить ділянку, званий промотором. Ця ділянка примикає до крапки почала транскрипції і в більшості випадків містить ділянку близько 8 пар підстав, які включають декілька адениновых (А) і тимидиновых (Т) нуклеотидов. Цей елемент, званий ТАТА-блоком, оточений ділянками, багатими гуанином (Г) і цитозином (Ц).
Білки – чинники транскрипції. ТАТА- блок і сусідні елементи ДНК промотора указують РНК-полімеразе крапку, з якою повинна початися транскрипція мРНК. До ТАТА- блоку прикріпляється комплекс білків, званих зв'язуючими для ТАТА-блок білками. Вважають, що ці білки взаємодіють безпосередньо з РНК-полімеразой II, і їх скріплення направлене на область ДНК, прилеглу до крапки почала транскрипції. Інші регуляторні елементи ДНК часто знаходяться поряд з ТАТА- блоком. До них відносяться СААТ-блок і G-C-богатые ділянки, які, ймовірно, сприяють початковому скріпленню полимеразы. Інші регуляторні зони ДНК називаються энхансерами («підсилювальними»).
Енхансери можуть розташовуватися усередині декількох сотів підстав промотора, але зазвичай знаходяться далеко від нього. Кожен окремий сегмент энхансера має довжину близько 7-20 пар підстав і служить місцем прикріплення білків, які контролюють можливість транскрипції гена за допомогою РНК-полімерази II. Цікаво, що энхансеры не специфічні ні до последовательности- мішені, ні до своєї орієнтації. Послідовності энхансера або промотора ДНК, до якої прикріпляються тканеспецифичные регуляторні молекули, називаються респонсивными елементами. Наприклад, респонсивный елемент циклічного аденозинмонофосфата (сАМР) складається з послідовності ACGTCA; саме цю послідовність дізнаються молекули сАМР (сАМР — элемент-связывающиеся білки), які активуються шляхом фосфорилування за допомогою сАМР-зависимой протеинкиназы. Відомі і інші респонсивные елементи. Наприклад, внутріклітинні рецептори стероїдних гормонів, гормон зростання і інші білки зв'язуються з особливими послідовностями ДНК і контролюють транскрипцію генів, лежачих поряд з місцем прикріплення цих білків. Деякі гени, так звані конститутивно экспрессирующиеся гени, мають регуляторні білки, які завжди пов'язані з їх промоторами; таким чином, встановлюється постійний рівень транскрипції. Промотори інших генів пов'язані з регуляторними білками тільки періодично, що забезпечує тимчасову індукцію або репресію гена відповідними регуляторами транскрипції. Чи зв'яжеться РНК-полімераза II з геном, чи почнеться транскрипція, і скільки разів в одиницю часу це відбудеться, визначається регуляторами транскрипції, які з'єднуються з різними ділянками промоторов і энхансеров. Чинники транскрипції, які зв'язуються з регуляторними областями генів, як правило, мають три функціональні відділи (домена):
ДНК-СВЯЗИВАЮЩИЙ домен, який містить багато лужних амінокислотних залишків і дозволяє білку розпізнавати і вибірково зв'язуватися із специфічною послідовністю ДНК.
Актіваторний домен, що має кислую реакцію, який дозволяє білку контактувати і активувати основний механізм транскрипції (Тата-блок- зв'язуючі білки і РНК-полімеразу II).
Один або більш лиганд-связывающих або фосфорилирующих доменів, які потрібні для активації чинників транскрипції. Чинники транскрипції ДНК служать ключовими регуляторами експресії гена, тому їх біохімічні властивості є предметом інтенсивного вивчення.
Ми знаємо на даний момент три основні сімейства білків – чинників транскрипції:
Білки «спираль-поворот-спираль» (helix-tum-helix). Ця група ДНК-СВЯЗИВАЮЩИХ білків представлена в більшості випадків гомодимерами. Кожна субъединица білка містить альфа-спираль, яка підходить до великої борозенки спіралі ДНК. Це домен, що «дізнається». Решта частини білка завжди вигинається з молекули ДНК і обвиває її, а друга альфа-спираль білка входить у велику борозенку на наступному витку ДНК. Коли такі білки з'єднуються з ділянкою ДНК, вони змінюють конформацію ДНК і роблять її або доступнішою для транскрипції (і тоді вони служать «індукторами»), або менш доступнішою (тоді вони працюють як «репрессоры»).
Білки типу «цинковий палець». Білки цієї групи названі так тому, що вони мають ділянку приблизно з 23 амінокислот, який містить залишки цистину і гистидина, що чергуються, і формує пальцевидні виступи, чия структура підтримується завдяки зв'язаним іонам цинку. Такі білки взаємодіють з ДНК за допомогою петлевидных ділянок. Рецептори глюкокортикоїдів, естрогену, вітаміну А, прогестерону, гормонів щитовидної залози і ретиноевой кислоти містять по два «цинкові пальці».
Амфіфільниє спіральні білки. Ця група включає дві підгрупи: білки «спираль-петля-спираль» (helix-loop-helix) і білки типу «лейциновой блискавки». Білки-регулятори, що мають структуру типу «лейциновых блискавок», можуть формувати або гомодимеры, в яких обидві субъединицы ідентичні, або гетеродимеры, в яких субъединицы не схожі один на одного. Гетеродімери складаються з двох різних білків з різною специфічністю до ДНК, тому здібність певних чинників транскрипції до формування функціональних димеров значно збільшує різноманітність ДНК- зв'язуючих білків і, отже, вариабельность контролю гена. Утворення гетеродимеров і навіть олигомеров ДНК- зв'язуючих білків (тобто комбінаційний контроль) — один з найважливіших механізмів, використовуваних эукариотической кліткою для регуляції експресії генів. Також важливо, що не всі чинники транскрипції формують гетеродимеры. Інакше перехресний контроль і специфічність регуляції генів в клітці були б неможливі.
Очевидно, що рівень транскрипції генів — головний чинник в регуляції життєдіяльності і морфології клітки. Проте це не єдина можливість впливати на клітинний фенотип. Як показали численні дослідження, інші події також важливі для контролю експресії генів. Наприклад, на додаток до транскрипції гена, створюючою мРНК, молекулярний апарат повинен сприймати сигнали самого гена; тобто повинні бути вирізані интроны (сплайсинг мРНК) і додані інші компоненти, що забезпечують функціональність мРНК. Після такого процесингу мРНК повинна бути перенесена з ядра в цитоплазму. У цитоплазмі на мРНК повинна початися трансляція білка. Механізми трансляції мРНК вимагають участі великої кількості регуляторних молекул; недолік або зниження активності будь-яка з цих молекул може зробити сильний вплив на експресію цитоплазми продукту гена. У цитоплазмі мРНК може бути швидко зруйнована або захищена від деградації білками цитоплазми; стабільність і період напівжиття мРНК — особливий механізм генної регуляції. Остаточний продукт гена, білок, також повинні бути функціонально активним для прояву активності гена.
Регуляція транскрипції поста здійснюється на рівні процесингу мРНК. Навіть в тому випадку, якщо транскрипція двох різних генів проходить з однаковою швидкістю, подальший процесинг мРНК, що включає модифікацію 5'- і 3'-концов і сплайсинг экзонов, може протікати по-різному у разных мРНК.
Регуляція на рівні трансляції здійснюється за рахунок того, що виключається можливість використання мРНК як матриця для синтезу білка, хоча вона і присутня в цитоплазмі. У ооците морського їжака, наприклад, багато мРНК, але скільки-небудь помітного синтезу білка не відбувається до тих пір, поки ооцит не буде запліднений. Лише після цього молекули мРНК піддаються модифікації, тобто «набувають» шпильки на 5'-конце (так званий кэп, або «шапочку») і «шлейфу» з роlу А на З'-конце, і можуть далі включитися в нормальний процес трансляції, який завершується побудовою молекули білка.
Регуляція трансляції поста заснована на тому, що багато білок синтезуються в неактивній формі і повинні ще пройти стадію модифікації. Так, в Я-клетках підшлункової залози синтезується не інсулін як такий, а його попередник, полипептидная ланцюг якого довше інсуліновою і містить ще деяку додаткову послідовність амінокислотних залишків. Лише після того, як ця послідовність вирізується протеолітичним ферментом, виходить власне гормон в своїй функціональній формі. Таким чином, виробництво активного гормону може регулюватися трансляцією поста шляхом через регуляцію активності протеолітичного ферменту.
Епігенетічеськая регуляція експресії генів. Процеси, керівники програмою розвитку, називаються эпигенетическими. Як відомо, злиття одного сперматозоїда з єдиною яйцеклітиною приводить до народження повністю сформованого індивіда, зі всім набором функціонально різних тканин і органів.
Очевидно, програма розвитку, закладена в генах зародка, «включає» або «вимикає» їх (на якийсь час або назавжди) в заздалегідь заданій послідовності. При цьому змінюється склад білків в клітках, що знов формуються, і тим самим змінюються властивості кліток. Наявність програми розвитку не пояснює, чому доля перших кліток різна. На ДНК повинен діяти якийсь процес, керівник розгортанням програми, що відбирає ті або інші гени для включення або виключення в даній клітці зараз. Без цього всі соматичні клітки тіла, що мають одні і ті ж хромосоми, розвивалися б однаково. Крім того, щось повинне управляти передачею розподілу станів «включен-выключен» між генами від одного покоління кліток до іншого. Дочернім кліткам призначається зберегти рівень диференціювання батьківської клітки або ж просунутися далі по шляху спеціалізації.
З генетичної точки зору питання про причини диференціювання 100 трильйонів (1014) кліток організму людини, що мають єдиний геном, зводиться до проблеми диференціальної експресії генів в різних клітках організму, що розвивається. Стає все більш очевидним, що стабільна підтримка цих відмінностей обумовлена эпигенетическим контролем генної експресії. В даний час під эпигенетической мінливістю розуміється зміна експресії генів без зміни первинній послідовності нуклеотидов в ДНК. У вужчому сенсі слово «эпигенетика» означає модифікацію генної експресії, обумовлену спадковими, але потенційно оборотними змінами в структурі хроматина і/або в результаті метилирования ДНК. Інтенсивні дослідження регуляції активності генів різних видів мікроорганізмів, рослин, комах, тварин і людини і секвенирование геномів, виконані в останні десятиліття XX ст., ознаменувалися відкриттям ряду эпигенетических феноменів, до яких можна віднести ефект положення, парамутацию, трансвекцию, РНК-интерференцию, явище прионизации, супрессию транспозонов, імпринтінг генома і инактивацию Х-хромосомы.
Під ефектом положення розуміють зміну фенотипічного ефекту гена залежно від розташування сусідніх з ним генів. Цей ефект був виявлений А. Стертевантом в 1925 р. у дрозофилы. У даного об'єкту часто спостерігається зміна експресії эухроматинового гена в результаті його переміщення в гетерохроматиновую область генома. Ефект положення був виявлений згодом у багатьох організмів, включаючи людину. Слід зазначити, що коректна експресія генів залежить від ряду чинників: 1) стани промоторної області, де фіксується комплекс транскрипції; 2) стану энхансеров і сайленсеров - коротких областей ДНК, що забезпечує приєднання тканеспецифичных чинників транскрипцій і що допомагають збірці комплексу транскрипції на промоторе; 3) локального стану хроматина, навколишнього промоторы і энхансеры, яке забезпечує їх доступність для білків, що беруть участь в контролі транскрипції. Порушення будь-якого з цих чинників, а також зміна взаєморозташування окремих елементів, контролюючих роботу комплексу транскрипції, можуть привести до зміни транскрипції гена.
Під парамутацией розуміють таке взаимодейстие аллельных генів, що знаходяться в гетерозиготном стані, який приводить до успадкованої зміни експресії одного з аллелей. Термін «парамутация» був введений Р.А. Брінком в 1956 р. для опису виявленого ним порушення I закону Менделя, згідно якому генетичні чинники сегрегируют в незміненому вигляді від гетерозиготных носіїв. Передбачається, що парамутация також пов'язана із спадковими змінами структури хроматина, що виявляються через дистантные цис- і транс- взаємодії генів.
Під трансвекцией розуміють взаємодію гомологичных генів, при якій один ген надає прямий вплив на функцію іншого шляхом спаровування гомологов. Як приклад трансвекции служить локус уеllou у дрозофилы - энхансер одного аллеля цього локуса в трансположении впливає на промотор іншого гомолога. Моделі трансвекции включають прямий вплив гомологичных послідовностей ДНК один на одного в результаті утворення петельных структур, трансдействующих энхансеров, диффундирующих регуляторних молекул РНК, стрибаючих полимераз, транссплайсинга і так далі
Епігенетічеськую спадковість можна розділити на ядерну і внеядерную (цитоплазму). У рослин, наприклад, відоме явище косупрессии, або транскрипція поста виключення гена, пов'язане з цитоплазмою транскрипції поста модифікацією двуспиральной РНК. Двуспіральная РНК з допомогою поки що не ясного біологічного перетворення розпадається на короткі шматочки - РНК, що інтерферує, яка запускає деградацію відповідної матричною РНК. Процес такої специфічної деградації певних послідовностей інформаційної РНК, ініційований двуспиральными молекулами РНК, гомологичными до гена, що вимикається, і що приводить до виключення його експресії, отримав назву «РНК-интерференции» (див. 1.2.4).
РНК-интерференция часто приводить до несприятливих наслідків для організму, формуючи аномальний фенотип, що дозволяє ідентифікувати функцію даних генів.
Інше явище спадковості цитоплазми - прионизация - пов'язано вже з модифікацією білків. Це явище привертає увага дослідників у зв'язку з важкими нейродегенеративными захворюваннями з пізнім проявом, що виникають в результаті дії приона - інфекційного агента білкової природи, позбавленого нуклеїнової кислоти. Ці хвороби характеризуються атаксією, деменцією, дегенерацією нейронів і відкладенням амилоидных бляшок в центральній нервовій системі. Встановлено, що вони виникають в результаті накопичення конформаційно зміненого аномального прионового білка в мозку при мутаціях гена РККР (20р12). До таких захворювань належить хвороба Крейнцфельда-якоба, куру, сімейне фатальне безсоння і трансмісивна губчаста енцефалопатія - хвороба скажених корів.
У багатьох організмів эпигенетическое виключення генів пов'язане з послідовностями, що повторюються, ДНК, локалізованою переважно в гетерохроматиновых областях генома. Гетерохроматін включає як прості повтори, так і неактивні мобільні генетичні елементи - транспозоны. Число транспозонов в геномі людини достатньо велике – відомо більше 106 елементів. Оскільки транспозоны дестабілізують геном шляхом инсерционного мутагенезу і сприяють хромосомним перебудовам через рекомбінацію між неаллельными повторами, то передбачається, що роль эпигенетической супрессии транспозонов в геномі ссавців полягає в захисті господаря проти паразитичних послідовностей ДНК.
Імпринтінг генома - це эпигенетический процес, що диференціально маркірує материнські і батьківські гомологичные хромосоми, приводить до різного фенотипічного прояву мутацій у потомства, успадкованих від матери або отця.
У генетичному сенсі термін «імпринтінг» (від англійського «відбиток») вперше був застосований в 1960 р. Хелен Кроуз для опису селективної елімінації батьківських хромосом у комах.
У 80-х роках в експериментах з трансплантацією ядер статевих кліток у мишей було показано, що андрогенетические або гиногенетические ембріони не могли нормально розвиватися в ході эмбриогенеза.
У ділянках генома, схильних до імпринтінгу, экспрессируется тільки один з двох аллелей - батьківський або материнський. Другий аллель импринтирован (вимкнений або пригнічений) і не экспрессируется.
Такий спосіб регуляції роботи генів свідчить про нееквівалентний внесок батьків в геном нащадків. Всі ми отримуємо один набір генів від матери, інший - від отця. У більшості генів працюють обидві копії. Але є такі гени, у яких працює тільки материнська. У деяких інших тільки батьківська копія. Інша копія в цьому випадку не діє, «мовчить»; говорять що вона «знаходиться під імпринтінгом». Відомо близько 40 таких генів.
Зазвичай для синтезу будь-якого білка організму достатньо однієї копії гена. Якщо в геномі зародка, що розвивається, є і материнські і батьківські гени, то будь-який импринтированный, ген, що «мовчить», має свою працюючу копію. Тоді все гаразд. Проте якщо скласти геном зародка тільки з материнських або батьківських хромосом, то «мовчати» будуть обидві копії.
У людини відомо близько 30 таких генів і транскриптов і передбачається, що їх число може досягати 200-500. Імпрінтірованниє гени і транскрипты виявлені на багатьох хромосомах человека- 1,5,6,7 і 13,15,19,20.
В даний час добре вивченим є кластер импринтированных генів, розташований на довгому плечі хромосоми 15 людини. Порушення роботи даних генів приводить до двох класичних хвороб імпринтінгу генома – синдром Прадера-Вилли (СПВ) і синдром Ангельмана (СА). Ці захворювання мають різні клінічні ознаки (гипотонсиндромия, ожиріння, розумова відсталість, гипогонадизм при СПВ і атаксії, гіперкінезах, пароксизмальному сміху, відсутності мови при СА), але при цитогенетичному дослідженні в обох випадках у більшості хворих виявляється делеция загальної ділянки д11- д13 хромосоми 15. При аналізі батьківського походження хромосом виявлено, що СПВ виникає в результаті делеции батьківською хромосомы- 15, а СА- материнською.
Відомо, що прояв розумових і соціальних якостей людини (поведінка в соціумі) обумовлений різним функціонуванням певних генів, що передаються від отця або від матери своїм нащадкам залежно від підлоги останніх. Судячи по дослідженнях хворих дітей з порушенням будови Х-хромосомы, саме в ній знаходяться гени, від яких залежать пізнавальні здібності людини і його соціальна поведінка. Оскільки син отримує тільки одну, материнську, Х-хромосому, його розумові і соціальні можливості, в першу чергу успадковуються від матери. Інша справа дочки, геном яких формується Х-хромосомами обох батьків. Тут набуває чинності механізм імпринтінгу: материнські або батьківські копії генів, що визначають інтелект і соціальну поведінку, вимикаються. Отже, соціальна поведінка жінки залежить від батьківської Х-хромосомы, яка завжди успадковується дочками. Інформація, яка зберігається в материнській Х-хромосоме і виявляється у синів, не прочитуватиметься в організмі дочки. У передачі інтелекту беруть участь і інші гени тієї ж хромосоми. Материнські копії деяких з них активують зростання кори головного мозку, а батьківські навпаки - гальмують.
В даний час запропоновано, принаймні, дві теорії, що пояснюють функцію імпринтінгу генома. Перша з них - конфліктна теорія батьківського і материнського геномів в регуляції зростання плоду. Збільшення плаценти і маси плоду може забезпечити переважне розмноження нащадків по лінії отця, але виснажить ресурси матери. Проте якщо зростання плаценти і плоду знаходиться під контролем з боку матери, то вона зможе забезпечити відтворення більшого числа нащадків по своїй лінії. Звідси можна припускати, що мати буде импринтировать або вимикати гени, сприяючі зростанню плаценти і плоду, тоді як отець вимикатиме гени, що перешкоджають цьому зростанню.
Друга (захисна) теорія пояснює роль імпринтінгу генома з погляду захисту генома господаря від проникнення в нього чужорідних елементів. Згідно цієї теорії, імпринтінг, і зокрема метилирование ДНК, це захисний механізм, що забезпечує инактивацию паразитичних послідовностей ДНК, таких як транспозоны і провірусна ДНК.
Визначення импринтированной експресії якого-небудь гена в окремій тканині зовсім не означає, що цей ген буде импринтирован у всіх останніх. І навпаки, відсутність импринтированного статусу гена в деяких тканинах зовсім не виключає його наявності в інших. Ці дані підтверджують припущення про те, що тканеспецифичная эпигенетическая модифікація генів є одним з основних механізмів, що забезпечують диференціальну експресію генів кліток різних тканин в ході розвитку.
Встановлено, що в основі эпигенетической «маркіровки» окремих ділянок генома і явища імпринтінгу генома зокрема лежать специфічні структурно-молекулярні зміни окремих ділянок хромосом, що відбуваються під час формування чоловічих і жіночих статевих кліток, які приводять до стійких функціональних відмінностей експресії гомологичных генів у потомства. Основну роль в цьому процесі відводять специфічному для особин різної підлоги метилированию цитозиновых підстав в Цг-дінуклеотідах ДНК, яке встановлюється під час гаметогенеза і вимикає транскрипцію генів.
Специфічні для батьків эпигенетические відбитки, що пригнічують транскрипцію генів, стираються в примордиальных статевих клітках плоду і знов встановлюються в зрілих статевих клітках нащадка відповідно до його підлоги, забезпечуючи диференціальну експресію батьківських або материнських генів в наступному поколінні.
Тканеспецифічноє метилирование цитозиновых залишків ДНК у ссавців здійснюється за допомогою 4-х ДНК-МЕТІЛТРАНСФЕРАЗ і підтримує специфічний малюнок метилирования (мал. 24) в митотически клітках, що розмножуються. Після реплікації дві полуметилированные дочірні молекули ДНК розпізнаються цим ферментом і конвертуються в повністю метилированные.

Ріс.24. Метілірованіє ДНК
Більш того, існує припущення, що порушення эпигенетической регуляції генів може визначати розвиток комплексних (мультифакториальных) захворювань, Підтримка потрібного статусу метилирования генома є неодмінною умовою нормального розвитку у мишей, а аберрантное метилирование пов'язане з виникненням пухлин і аномалій розвитку у людини.
Останніми роками стало ясно, що механізм компактизации- декомпактизации хроматина безпосередньо пов'язаний з репрессией- дерепрессией локалізованих в нім генів, і встановлений особливий клас захворювань людини, обумовлений дефектами структури і модифікації хроматина, - так звані «хроматиновые хвороби». Показано, що до метилированной ДНК приєднуються білки, метилированные підстави, що розпізнають, завдяки наявності в них особливих доменів, що метил-ЦГ-связывающихся. Відомо 4 види таких білків. Вони взаємодіють з гистонами.
Деацетілірованіє гистонов, ремоделирует структуру хроматина, підвищуючи ступінь його компактизации, що приводить до репресії транскрипції. Ацетилювання гистонов, навпаки, знімає репресію.
Процеси метилирования тісно пов'язані з виникненням пухлин. Передбачається, що в процесі еволюції метилирование виникло вже у одноклітинних як засіб захисту від проникнення в клітку чужої ДНК, наприклад вірусної. Метілірованіє могло б инактивировать гени інфекційних агентів, проникаючих в клітку. Метілірованіє могло б також перешкоджати розмноженню так званих рухомих елементів генома, які часто розглядаються як паразити геномів, мета яких полягає лише в розповсюдженні по геному власної ДНК.
Система метилирования генів і імпринтінг генома виникли у хребетних. У безхребетних метилирование цитозина, як правило, відсутній.
За своєю суттю, метилирование - подія эпигенетическое. Порушення регуляції метилирования в эмбриогенезе може приводити до загибелі організму. Зміна ступеню метилирования в соматичних клітках дорослого організму спостерігається при деяких патологічних станах у людини, у тому числі і злоякісних новоутвореннях.
Проблема імпринтінгу генома із загальнобіологічної перейшла в практичну область досліджень клінічної генетики. Подальше його вивчення дозволить поліпшити діагностику і профілактику цілого ряду спадкових захворювань.
Багато дослідників вважають, що у вищих організмів важливим эпигенетическим процесом може бути хімічна модифікація ДНК. Зокрема, в управлінні генетичним перемиканням в клітках, що розвиваються, може брати участь приєднання метильной (Сн3) групи до цитозину, тобто метилирование ДНК.
Очевидно, від одного покоління кліток до іншого передаються без зміни не які-небудь регуляторні білки, а метильные групи у складі ДНК. Можливо, що наявність або відсутність метильных груп служить сигналом для регуляторних білків і в результаті ці білки взаємодіють з ДНК в дочірніх клітках так само, як в батьківській клітці. Експерименти по активації генів в культурах кліток вельми переконливо свідчить на користь зв'язку між генною експресією і метилированием ДНК.
Так, дослідження статевих хромосом жіночого організму (ХХ) показало, що вони метилированы неоднаково. Зокрема, в неактивній Х-хромосоме опинилися метилированными ділянки регуляторних генів «внутрішнього вживання» (тобто гени, активні у всіх клітках). У активній же гомологичной хромосомі ці ділянки не метилированы. Таким чином, метилирование ДНК – важливий эпигенетический чинник в розвитку вищих організмів. Функції генів взаємозв'язані і можуть змінюватися аж до диференціального виключення одного з аллелей впродовж всього онтогенезу. Такі випадки спадкоємства пояснюють генетичним імпринтінгом.
Генетичний імпринтінг може виявлятися не тільки на рівні гена або кластера генів. Він може зачіпати цілу хромосому (однородительские дисомии) і навіть геноми. Ефекти імпринтінгу генома у людини вивчені на прикладі занесення міхура (табл.4).
Табл.4. Наслідки різних варіантів імпринтінгу цілого генома у людини
Генетична «композиція» |
Наслідки |
1.Хромосомний набір 2n. Яйцеклітина без ядра. Два сперматозоїди з Х-хромосомами (андрогенез)
2.Хромосомний набір 2n. Яйцеклітина з подвійним набором хромосом. Сперматозоїди не беруть участь в заплідненні (гиногенез) 3.Хромосомний набір Зn. Андроїд (2 батьківських + 1 материнський)
4.Хромосомний набір Зn. Гиноїд (2 материнських + 1 батьківський) |
1.Ранній эмбриогенез нормальний. Далі тканини власне ембріона не формуються. Бурхливо розростається трофобласт з утворенням повного занесення міхура 2.Утворюється тератома, що включає все 3 зародкових листка. Плацентарна тканина відсутня
3.Велика голова плоду. Маленьке веретеноподібне тіло. Відставання в зростанні і розвитку. Часткове занесення міхура 4.Плацента недорозвинена. Ембріон і плід не розвиваються (недиференційована клітинна маса) |
З представлених в таблиці даних можна зробити вивід, що розвиток плаценти забезпечується геномом отця, а ранній розвиток ембріональних структур забезпечується геномом матери.
Гормональна регуляція експресії генів. Регуляція за допомогою гормонів - це окремий випадок регуляції на рівні транскрипції. Таким шляхом організм примушує клітку «включити» певні гени у відповідь на зовнішній стимул. Так, стероїдні гормони з тих кліток, де вони були синтезовані, потраплять, кінець кінцем, в цитоплазму відповідних кліток-мішеней, звідки спеціальний транспортний білок перенесе їх в ядро, де вони зможуть активувати ті або інші гени шляхом прямої взаємодії з хроматином у відповідних місцях. Кожен гормон активує свій набір генів. У такий спосіб забезпечується відповідність реакції клітки роду сигналу, який клітка сприймає через посередництво відповідного гормону. Гормони зв'язуються з особливими білками рецепторами, утворюючи з ними комплекс. Активованого гормоном рецептора набуває здатність дізнаватися певні послідовності ДНК, в результаті ген инактивируется.
Наприклад: вплив тестостерона на розвиток тканин організму за чоловічим типом за наявності специфічного білка-репрессора.
Встановлено, що одне лише присутність гена Y-хромосомы, який визначає диференціювання статевих залоз за чоловічим типом і синтез гормону тестостерона, не здатна забезпечувати розвиток організму чоловічого типу. Для цього необхідний також білок-рецептор, що забезпечує проникнення гормону в клітки тканин-мішеней. 3а синтез такого білка відповідає особливий ген, розташований в іншій хромосомі. Його мутація, що порушує утворення нормального білка-ферменту, робить тканини-мішені несприйнятливими до гормону, що направляє їх розвиток за чоловічим типом. В результаті гормон не проникає в клітку-мішень і не включається певний набір генів. Не використавши таку можливість на певному етапі онтогенезу, організм здійснює розвиток за жіночим типом. В результаті з'являється особина з каріотипом Хy, але зовні більш схожа з жінкою. Такі люди не здатні мати потомства, оскільки статеві залози (семенники) недорозвинені, а їх вивідні протоки часто формуються по жіночому шляху (недорозвинена матка, наявність піхви). Т. о., вторинні статеві ознаки формуються такі ж, як і у жінки. Ця патологія називається тестикулярная фемінізація або синдром Моріса.
Контроль на рівні трансляції і процесів трансляцій поста.
Регуляція на рівні трансляції здійснюється за рахунок того, що виключається можливість використання мРНК як матриця для синтезу білка, хоча вона і присутня в цитоплазмі. У ооците морського їжака, наприклад, багато мРНК, але скільки-небудь помітного синтезу білка не відбувається до тих пір, поки ооцит не буде запліднений. Лише після цього молекули мРНК піддаються модифікації, тобто «набувають» шпильки на 5'-конце (так званий кэп, або «шапочку») і «шлейфу» з роlу А на З'-конце, і можуть далі включитися в нормальний процес трансляції, який завершується побудовою молекули білка.
Регуляція заснована на тому, що багато білок синтезуються в неактивній формі і повинні ще пройти стадію модифікації. Так, в Я-клетках підшлункової залози синтезується не інсулін як такий, а його попередник, полипептидная ланцюг якого довше інсуліновою і містить ще деяку додаткову послідовність амінокислотних залишків. Лише після того, як ця послідовність вирізується протеолітичним ферментом, виходить власне гормон в своїй функціональній формі. Таким чином, виробництво активного гормону може регулюватися трансляцією поста шляхом через регуляцію активності протеолітичного ферменту.
Роль пептидів вилона і эпиталона в генній експресії. Вивчення молекулярно-генетичних механізмів геропротекторного дії коротких пептидів дозволило розробити свідчення для їх медичного застосування при віковій патології і прискореному старінні. Для цього у тварин і людей досліджували в динаміці рівень експресії різних генів, інтенсивність синтезу ДНК в клітках і показники внутріклітинного метаболізму Результати експериментальних досліджень коротких пептидів підтвердили припущення про те, що пептидні біорегулятори володіють властивістю контролювати експресію генів і процеси синтезу білка в клітках.
Так, при вивченні дії пептидів вилона і эпиталона встановлено, що вони міняють профіль генної експресії в міокарді при введенні мишам in vivo. Вплив вилона і эпиталона на експресію генів IL-2 і c-fos обумовлює иммуномодулирующие, онкомодифицирующие і стресс-протекторные властивості цих пептидів.
Дані, отримані при вивченні впливи вилона і эпиталона на канцерогенез у трансгенних мишей, підтверджують це припущення і також свідчать про дію досліджуваних пептидів на експресію гена раки молочної залози HER-2/neu. Вперше встановлені механізми геропротекторного дії коротких пептидів, пов'язані з активацією хроматина в лімфоцитах крові пацієнтів старечого віку.
Ефекти эпиталона, пов'язані із збільшенням ферментативной активності теломеразы, подовженням теломер в різних клітках і збільшенням тривалості життєвого циклу диплоидных людських кліток за рахунок подолання ліміту Хейфліка є найбільшим досягненням сучасної біогеронтології і підтверджують перспективність розробки пептидних геропротекторных засобів. На підставі вивчення впливу пептидів на експресію різних генів і синтез ДНК в різних експериментальних моделях, висунуто припущення, що, короткі пептиди є активаторами і агонистами чинників транскрипції. Слід вважати, що первинним стартовим сигналом для пов'язання чинника транскрипції з промотором є сайт-специфическое скріплення пептиду у великій канавці ДНК.
Подальший розвиток цього напряму дозволить по-новому підійти до вивчення механізмів старіння і з'ясування багатьох питань геронтології. Розширення уявлень про молекулярно-генетичні механізми дії пептидів може привести до перегляду традиційних підходів до створення геропротекторных засобів і методів профілактики прискореного старіння і вікової патології.
