
- •Передмова
- •Частина 1. Молекулярні основи спадковості
- •Введення в молекулярну біологію.
- •1.2. Макромолекули як обьекты вивчення молекулярної біології
- •1.2.2. Будова, функції і властивості днк.
- •Молекулярна організація генів.
- •Рнк і її роль в збереженні і реалізації спадкової інформації.
- •Лікарські засоби, що впливають на синтез нуклеїнових кислот і білків.
- •1.3. Експресія генів і її регуляція
- •1.4. Організація геномів неклітинних і клітинних організмів
- •Геном бактерій
- •Організація генома эукариот.
- •Частина 2. Молекулярні основи спадкових захворювань
- •2.1. Молекулярні механізми генних, хромосомних і геномів мутацій
- •2.2. Регуляція клітинного циклу. Апоптоз. Онкогенетика.
- •Частина 3. Сучасні питання генних технологій
- •3.1 Дослідження нуклеїнових кислот. Методи днк-діагностики
- •3.2 Методи генної інженерії
- •3.3 Клонування організмів і кліток.
- •Додатки контрольно-повчальні питання
- •Відповіді на контрольному – повчальні питання
- •Термінологічний словник
- •Література
Частина 3. Сучасні питання генних технологій
3.1 Дослідження нуклеїнових кислот. Методи днк-діагностики
Методи дослідження нуклеїнових кислот. Методи виділення ДНК з рослинних і тваринних тканин і її очищення. Ферменти, використовувані для генно-інженерних досліджень. Рестріктази. ДНК-зонд. Електрофорез ДНК. Ідентифікація фрагментів ДНК і РНК методами гібридизації. Саузерн-, Норзерн-, Вестерн-блоттінг. Клонування фрагментів нуклеїнових кислот in vitro. Полімеразная ланцюгова реакція. Секвенірованіє ДНК.
Методи ДНК-діагностики. Свідчення до ДНК-діагностики. Прямі і непрямі методи. ДНК-чіп. Молекулярно-генетичні методи дослідження в судовій медицині.
Методи дослідження нуклеїнових кислот. Молекулярно-генетичні методи — велика і різноманітна група методів, кінець кінцем, призначених для виявлення варіацій в структурі досліджуваної ділянки ДНК (аллеля, гена, регіону хромосоми) аж до розшифровки первинної послідовності підстав. У основі цих методів лежать «маніпуляції» з ДНК і РНК. В результаті бурхливого розвитку молекулярної генетики людини в 70—80-х роках і подальшого успішного вивчення генома людини молекулярно-генетичні методи широко увійшли до медико-генетическую практики.
Щоб познайомити з суттю і термінологією молекулярно-генетичних методів, нижче схемний описані їх основні етапи і варіанти. Освоєння цих методів, як і інших методів лабораторної діагностики, вимагає спеціальної підготовки у відповідних лабораторіях.
Отримання зразків ДНК (або РНК) є початковим етапом всіх методів. Цей етап реалізується в двох варіантах: а) виділення всій ДНК (тотальною або геномом) з кліток; би) накопичення певних фрагментів, які передбачається аналізувати, за допомогою ПЦР (полимеразная ланцюгова реакція).
Джерелом ДНК генома можуть бути будь-які ядросодержащие клітки. Виділена з кліток ДНК є всім геномом організму, тому такі зразки називають ДНК генома. На практиці частіше використовують периферичну кров (лейкоцити), хорион, амниотические клітки, культури фибробластов. Для одного аналізу необхідно мати (залежно від використовуваного методу) від декількох нанограмів до декількох микрограммов ДНК. Для цього потрібна дійсно невелика кількість біологічного матеріалу, наприклад 20—40 міліграм хориона, 1 мл крові, 5—10 міліграм культури кліток. Для здійснення деяких методів досить мати 1 краплю крові, соскоб епітелію з щоки або декілька волосяних цибулин. Можливість проведення молекулярно-генетичного аналізу з невеликою кількістю досяжного біологічного матеріалу є методичною перевагою методів названої групи. До цього ще можна додати, що виділена ДНК однаково придатна для проведення різних варіантів методів і може довго зберігатися в замороженому вигляді.
Для виділення ДНК використовують різні методики залежно від поставлених завдань. Їх суть полягає в екстракції (витяганні) ДНК з біопрепарату і видаленні або нейтралізації сторонніх домішок для отримання препарату ДНК з чистотою, придатною для постановки ПЦР.
Іноді буває досить прокип'ятити зразок протягом 5-10 мин., проте в більшості випадків потрібні складніші методи.
Стандартною і такою, що стала вже класичною вважається методика отримання чистого препарату ДНК по Мармуру. Вона включає ферментативный протеолиз з подальшою депротеинизацией і переосаждением ДНК спиртом. Цей метод дозволяє отримати чистий препарат ДНК. Проте він досить трудомісткий і припускає роботу з такими агресивними і такими, що мають різкий запах речовинами, як фенол і хлороформ.
Одним з популярних в даний час є метод виділення ДНК, запропонований Boom із співавторами. Цей метод заснований на використанні для лізису кліток сильного хаотропного агента - гуанидина тиоционата (GUSCN), і подальшій сорбції ДНК на носієві (скляні намиста, диатомовая земля, скляне «молоко» и.т.д.). Після відмивань в пробі залишається ДНК, сорбована на носієві, з якого вона легко знімається за допомогою элюирующего буфера. Метод зручний, технологічний і придатний для підготовки зразка до ампліфікації. Проте можливі втрати ДНК унаслідок необоротної сорбції на носієві, а також в процесі численних відмивань. Особливо велике значення це має при роботі з невеликими кількостями ДНК в зразку. Крім того, навіть кількості слідів GUSCN можуть інгібірувати ПЦР. Тому при використанні цього методу дуже важливий правильний вибір сорбенту і ретельне дотримання технологічних нюансів. Слід зазначити, що через велику кількість стадій додавання і видалення розчинів при роботі із зразком потрібна акуратність, оскільки можлива перехресна контамінація між пробами аэрозолью ДНК, що утворюється.
Інша група методів пробоподготовки заснована на використанні іонообмінників типу Chilex, які, на відміну від скла, сорбували не ДНК, а навпаки, домішки, що заважають реакції. Як правило, ця технологія включає дві стадії: кип'ячення зразка і сорбція домішок на іонообміннику. Метод надзвичайно привабливий простотою виконання. В більшості випадків він придатний для роботи з клінічним матеріалом. На жаль, іноді зустрічаються зразки з такими домішками, які неможливо видалити за допомогою іонообмінників. Крім того, деякі мікроорганізми не піддаються руйнуванню простим кип'яченням. У цих випадках необхідне введення додаткових стадій обробки зразка.
При масовому скринінгу, коли важливо отримати статистичні дані, можливе використання простих методів із застосуванням детергентов або обробки біологічного матеріалу лугами з подальшою їх нейтралізацією. В той же час, використання подібних методів пробоподготовки для клінічної діагностики може приводити до ложноотрицательным результатів, унаслідок використання в реакційній суміші неякісного препарату ДНК.
Таким чином, до вибору методу пробоподготовки слід відноситися з розумінням цілей проведення передбачуваних аналізів.
Зразки тканин, що отримуються при хірургічних операціях, зазвичай фіксують формаліном і заливають в парафін. Такі фіксовані препарати також можуть використовуватися для проведення ПЦР.
Ферменти, використовувані для генно-інженерних досліджень. Рестріктази. Одним з найважливіших інструментів генної інженерії є эндонуклеазы — ферменти, що розщеплюють ДНК по специфічних послідовностях нуклеотидов усередині ланцюга. Ці ферменти отримали назву рестриктаз. Рестріктази розщеплюють ДНК на відносно невеликі фрагменти в ділянках строго певних послідовностей. Цим їх дія відрізняється від більшості інших ферментативных, хімічних або фізичних дій, що приводять до випадкових розривів ланцюгів ДНК. Рестріктази (вже відкрито більше 200 типів ферментів цього класу) є частиною захисної системи бактерій, що охороняють власний геном від чужорідної, головним чином вірусної ДНК. Рестріктази прийнято іменувати по назві бактерій, з яких їх виділяють. Так, назва ECORI свідчить про те, що цей фермент з Esherichia coli, Ватн1 — з Bacillus amilolquefacientsi. Кожен фермент дізнається певну 4-7-членную послідовність в двухцепочечной ДНК. Розрізання ДНК по цих сайтах приводить до утворення або «тупих» (наприклад, при дії рестриктаз Hpal), або «липких», тобто що перекриваються (наприклад, Ватн1), кінців. Для конструювання гібридних молекул особливо зручні липкі кінці. Будь-який фрагмент ДНК володіє характерним розташуванням сайтів пізнавання різних рестриктаз, що дозволяє будувати так звані рестриктазные карти. При розщеплюванні ДНК який-небудь одним рестриктазой отримують суміш фрагментів, кожен з яких має одні і ті ж кінцеві ділянки. Такі фрагменти можна розділити і ідентифікувати методом электрофореза в агарозном або полиакриламидном гелі.
Частина ферментів, вживаних для дослідження ДНК, представлена в таблиці 10.
ДНК-зонд. Інформація про все різноманіття організму поміщена в його генетичному матеріалі. Так патогенність бактерій визначається наявністю в них специфічного гена або набору генів, а спадкове генетичне захворювання виникає в результаті пошкодження певного гена. Сегмент ДНК детермінуюча дана біологічна ознака має строго певну послідовність і може служити діагностичним маркером.
У основі багатьох швидких і надійних діагностичних методів лежить гібридизація нуклеїнових кислот - спаровування двох компліментарних сегментів різних молекул ДНК.
Табл.10. Основні ферменти, використовувані в генній інженерії
-
Фермент
Реакція
Область приложениия
Рестріктази
Розщеплюють ДНК по специфічних послідовностях нуклеотидов
Отримання фрагментів ДНК, створення химерних молекул ДНК
Нуклеаза
Деградація як 5'-, так і 3 '-концов ДНК
Утворення кінцевих делеций в молекулах ДНК
ДНК-ЛІГАЗА
Каталізує утворення зв'язків між молекулами ДНК
«Зшивання» фрагментів ДНК
ДНК-полимераза I
Синтез двухцепочечной ДНК по ДНК-матриці
Синтез двухцепочечной ДНК
Днказа1
Вносить одноцепочечные розриви до ДНК
Картірованіє ділянок в ДНК
ЕКЗОНУКЛЕАЗА-Ш
Видаляє нуклеотиды з 3 '-концов ДНК
Секвенірованіє ДНК
Екзонуклеаза
Видаляє нуклеотиды з 5-концов ДНК.
Секвенірованіє ДНК
Зворотна транскриптаза
Синтезує ДНК по РНК-матрице
Синтез кДНК по мРНК: картирование ДНК
У діагностичних тестах, заснованих на гібридизації нуклеїнових кислот, ключовими є три компоненти: ДНК-зонд, ДНК-мішень і метод детекции гибридизационного сигналу.
Система детекции повинна бути надзвичайно специфічною і високочутливою.
Щоб забезпечити адекватність діагностичного тесту гибридизационные ДНК- і РНК-зонды повинні бути высокоспецифичнными. Іншими словами необхідно, щоб зонд гибридизовался тільки з шуканою нуклеотидной послідовністю. Якщо є вірогідність отримання ложноположительного (наявність гибридизационного сигналу у відсутності послідовності мішені) або ложноотрицательного (відсутність сигналу за наявності послідовності - мішені) результату, то доцільність застосування тесту значно знижує специфічність зондів, яка може виявлятися на різних рівнях: вони можуть «розрізняти» два і більш за вигляд, окремі штами в межах одного вигляду або різні гени. Залежно від ситуації зонди можуть бути представлені молекулами ДНК і РНК; вони можуть бути довгими (більше 100 нуклеотидов) або короткими (менше 50 нуклеотидов), є продукт хімічного синтезу, клоновані интактнные гени або їх фрагменти.
Зонди отримують різними способами. Один з них полягає в наступному. ДНК патогенного мікроорганізму розщеплює за допомогою рестрицирующей эндонуклеазы і клонує в плазмидном векторі. Потім проводять скринінг рекомбинантных плазмид з використанням ДНК генома як патогенного, так і непатогенного штамів. Ті плазмиды, які містять послідовності, гибридизующиеся тільки з ДНК патогенного штаму, складають основу видоспецифических зондів. Після цього проводять ряд додаткової гібридизації з ДНК, виділеною з різних організмів, щоб упевнитися, що потенційні зонди не дають з ними перехресної гібридизації для визначення чутливості методу кожен із зондів перевіряють також на модельних зразках, у тому числі і на змішаних культурах. Вельми бажано, щоб ДНК-діагностові можна було проводити на початковому матеріалі, без додаткового його культивування або виділення нуклеїнових кислот, особливо в тих випадках, коли тестуються клінічні зразки. Дослідники з успіхом проводять гібридизацію з ДНК- мішенями, присутніми в зразках калу, сечі, крові, змивах із зіву і тканинах без попереднього їх очищення. Якщо концентрація послідовності мішені в досліджуваному зразку дуже мала, її можна амплифициравать за допомогою ПЦР.
Як приклад використання ДНК-зонда для діагностики захворювань можна привести процедуру виявлення Plasmodium falciparum. Цей паразит викликає малярію, захворювання, яке загрожує приблизно третини всього населення Землі. Він інфікує еритроцити і руйнує їх, що приводить до розвитку лихоманки, а у важких випадках до ураження мозку, нирок і інших органів. Щоб виявити джерела інфекції, оцінити ефективність заходів по їх ліквідації і забезпечити ранню діагностику і лікування, необхідно достатньо чутливі, прості і недорогі методи. В даний час малярію діагностують за допомогою мікроскопічного дослідження мазків крові - ефективний, але трудомісткий і займаючий багато часу процесу. Імунологічні методи виявлення Plasmodium, такі як ELISA, достатньо швидкі і їх легко автоматизувати, але з їх допомогою не можна відрізнити поточну інфекцію від тієї, що пройшла, оскільки при цьому визначаються тільки наявність антитіл до Plasmodium в крові хворого. Для виборчої ДНК-діагностики поточної інфекції, тобто для виявлення ДНК-збудника, як основа використовують послідовності ДНК Plasmodium falciparum, що високоповторюються. Спочатку за допомогою ДНК-зонда проводять скринінг бібліотеки ДНК генома паразита. Потім відбираються клони що дають найбільш інтенсивний гибридизационный сигнал, оскільки саме вони імовірно містять послідовності, що високоповторюються. ДНК кожного з відібраних клонів перевіряють на здібність до гібридизації з ДНК видів Plasmodium, що не викликають малярію. Як специфічний зонд вибирається послідовність гибридизующейся ДНК з Plasmodium falciparum, але не з ДНК Plasmodium vivax, Plasmodium cynomolgi або з ДНК людини. З його допомогою можна виявити всього 10 пг очищеною ДНК Plasmodium falciparum або 1 нг тієї ж ДНК в крові хворого.
Отримано і охарактеризовано більше 100 різної ДНК-зонда, що дозволяє виявляти патогенні штами різних бактерій, вірусів і паразитичних простих. Так є зонди для діагностики бактерійних інфекцій людини, Legionella, що викликаються, рheumoniae (респіраторні захворювання), Salmonella typhimurium (харчове отруєння), Campylobacter hyointestinalis (racтриты), а також для виявлення энтеротоксичного штаму Escherichia coli (гастроентерити) проте це лише «верхівка айсберга»; в принципі за допомогою гібридизації можна виявляти практично будь-які патогенні мікроорганізми.
У більшості лабораторій для гібридизації використовують зонди, що мітяться яким-небудь радіоактивним ізотопом, частіше всього 32Р. Такі зонди володіють високою питомою радіоактивністю і забезпечують хороші відношення сигнал / шум. Радіоактивний мічений зонд наносять на фільтр з фіксованою на нім ДНК-мішенню, проводять гібридизацію, відмивають ДНК-зонд, що не зв'язалася, і детектують мітку за допомогою радіоавтографа.
Проте 32Р є короткоживучим ізотопом, що випускає високоенергетичне випромінювання; при роботі з ним необхідно використовувати спеціальне устаткування і забезпечити безпечну утилізацію відходів. Щоб обійти ці труднощі, були створені не радіоактивні системи детекции. Для посилення гибридизационного сигналу в цьому випадку використовується ферментативное перетворення хромогенного або хемилюминесцентного субстрата: перший з них під дією ферменту змінюють забарвлення, а другий - випускає світло.
Один з недавно розроблених нерадіоактивних методів детекции заснований на використанні зонда - «молекулярного маяка».
Такий зонд складається з 25 нуклеотидов. До 5' кінця приєднаний флуоресцентний хромофор, а до 3' кінця - не флуоресцентний хромофор, на який передається енергія збудження флуорофора. У розчині при кімнатній температурі маяк має таку конфігурацію, при якій флуорофор і тушитель знаходитися в тісному контакті і флуоресценція флуорофора гаситься. Коли 15 середніх нуклеотидов зонда гибридизуется з комплементарною послідовністю ДНК- і РНК-мишени, відбувається просторове розділення флуорофора і тушителя і зонд випускає світло. Необхідно також, щоб все 15 нуклеотидов зонда були комплементарними відповідній послідовності ДНК- і РНК-мишени.
Електрофорез фрагментів ДНК забезпечує розділення цих фрагментів при їх розподілі на поверхні агарозного або полиакриламидного гелю. Фрагменти ДНК рухаються в гелі, поміщеному в постійне електричне поле, від негативного полюса до позитивного залежно від розмірів (чим більше відносна молекулярна маса фрагмента, тим повільніше він рухається в електричному полі). Після закінчення электрофореза кожен фрагмент ДНК займає певне положення у вигляді дискретної смуги в конкретному місці гелю. Довжину кожного фрагмента можна визначити шляхом порівняння пройденої фрагментом відстані з відстанню, пройденим стандартним зразком ДНК з відомими розмірами.
Ідентифікація фрагментів ДНК і РНК методами гібридизації в гелі є або кінцевим етапом діагностики, або необхідним елементом подальшого аналізу. Для ідентифікації і виділення, що цікавлять дослідника клонів бактерій з химерною ДНК розроблений метод гібридизації в бактерійних колоніях. Для цього на численні колонії бактерії, вирощені на твердому середовищі, спочатку накладають фільтр нітроцелюлози. Частина бактерій прилипає до фільтру. Після лізису кліток, денатурація і фіксації ДНК фільтр інкубують в розчині з радіоактивно міченим зондом. Після закінчення гібридизації фільтр відмивають від надлишку зонда і виявляють мічений гібридний комплекс, що утворився, шляхом контакту з рентгенівською плівкою. Порівнюючи положення плями на радіоавтографі з положенням колоній на чашці, вибирають ту з них, яка дала позитивний сигнал.
Всі різновиди методів гібридизації базуються на комплементарних взаємодіях азотистих підстав різних ланцюгів нуклеїнових кислот. Точна відповідність послідовностей гибридизующихся фрагментів приводить до швидкого утворення міцного стійкого комплексу.
В цілому методи гибридизационного аналізу можна розділити на два типи:
методи гибридизационного аналізу, що проводяться в розчині (гомологичные);
методи гибридизационного аналізу, що проводяться на твердому носієві (гетерогенні).
Метод гібридизації в розчині. При гібридизації в розчині шукана нуклеїнова кислота і зонд вільно взаємодіють у водній реакційній суміші, що підвищує швидкість процесу гібридизації. Детекцию результатів гібридизації в розчині здійснюють шляхом нуклеазного гідролізу одноцепочечных ДНК і виділення двухцепочечных гібридів, що залишилися, містять мічений зонд.
Для успішного проведення реакції гібридизації в розчині необхідно застосовувати одноцепочечные зонди, нездібні до самогибридизации. Метод хороший ще і тим, що вимагає мінімальних об'ємів і кількостей біологічного і клінічного зразків, тому може бути використаний в діагностичних цілях. В той же час цей метод має один істотний недолік — на його основі можна створити діагностичні тест-системи для виявлення специфічних фрагментів невеликих ділянок ДНК за умови достатньої високої концентрації шуканих фрагментів або ділянок в досліджуваному зразку. Це знижує поріг чутливості до рівня иммуноферментного аналізу і навіть нижче.
Метод гібридизації на твердому носієві. Принцип методу заснований на гібридизації зонда на твердій поверхні. Як тверда поверхня найчастіше використовують полімерний мембранний фільтр, наприклад, нейлонову мембрану.
В більшості випадків процедуру проведення аналізу можна розділити на наступні стадії: підготовка зразка (зокрема екстракція і виділення ДНК), фіксація проби на носієві, передгібридизація, власне гібридизація, відмивання продуктів, що не зв'язалися, детекция.
Для підготовки проби, можливо, необхідне попереднє «підрощування» досліджуваного матеріалу для ідентифікації окремих колоній бактерій або збільшення концентрації вірусів в клітинній культурі. Проводиться і безпосередній аналіз зразків кліток, сечі, уретральных соскобов, формених елементів крові або цілісної крові на присутність інфекційних агентів. Для звільнення нуклеїнових кислот з складу клітинних структур проводять лізис кліток, а в деяких випадках очищають препарат ДНК за допомогою фенолу. Денатурація ДНК, тобто перехід в одноцепочечную форму, відбувається при обробці лугом. Потім зразок нуклеїнової кислоти фіксують на носієві — мембрані нітроцелюлози або нейлонової, зазвичай шляхом інкубації від 10 мін до 4 ч при 80°С у вакуумі. Далі в процесі передгібридизації досягається инактивация вільних місць скріплення для зменшення неспецифічної взаємодії зонда з мембраною. Після чого шукані фрагменти ДНК (РНК) комплементарно зв'язуються із специфічним зондом, і тоді даний метод називають ДНК-ЗОНДОВОЇ діагностикою. Далі здійснюють детекцию одним з можливих методів (авторадіографічним, ферментативно-гибридизационным і так далі).
Метод «сэндвич»- гібридизації. Метод є одному з різновидів зондської технології (DNA-probe). При його використанні застосовуються два зонди, гомологичные різним ділянкам шуканої нуклеїнової кислоти. Один зонд фіксують на мембрані для того, щоб зв'язати шукану нуклеїнову кислоту, присутню в досліджуваному зразку. Після здійснення гібридизації мембрану відмивають від досліджуваного матеріалу і додають розчин, що містить другий зонд, який має певну мітку. Процес гібридизації проводять повторно, і при цьому зонд з міткою взаємодіє з шуканою ділянкою ДНК (РНК).
Методи блот-гибридизации. Ідентифікація конкретних фрагментів в гелі серед ДНК генома є складнішим завданням. Із-за великих розмірів генома людини після рестрикції утворюється настільки велике число рестриктных фрагментів, що агарозный гель після электрофореза і забарвлення этидия бромідом при ультрафіолетовому опромінюванні виглядає як більш менш рівномірно забарвлена поверхня. Завдання генетика — виявити специфічні фрагменти ДНК.
ДНК, розділену гель-электрофорезом, можна перенести з гелю на фільтр нітроцелюлози. Для цього її денатурують в гелі лугом, нейтралізують гель, і потім прикладають до нього фільтр нітроцелюлози, забезпечуючи повільний струм буфера через гель і фільтр. Денатурована ДНК диффундирует і затримується на фільтрі, після нагрівання, якого у вакуумі вона «запікається» і иммобилизуется, тобто обездвиживается на фільтрі. Її розподіл на площині фільтру таке саме, як і на площині гелю. Проте на відміну від гелю фільтр з ДНК можна використовувати для подальшої гібридизації з міченою пробою, тобто з міченою ДНК і РНК. Для цього інкубують фільтр з розчином, що містить мічену пробу, при підвищеній температурі, потім ретельно відмивають його і, нарешті, піддають авторадіографії, тобто витримують з рентгенівською фотоплівкою. При прояві останніми на ній виявляються смуги, відповідні смугам ДНК на фільтрі, сгибридизовавшимся з радіоактивною пробою.
Процедура перенесення ДНК з гелю на фільтр позначається англійським терміном blotting (намокання). Тому для таких фільтрів з ДНК використовується термін «блот» (blot). По імені автора Е. Саузерна ці блоты називаються «Блотамі Саузерна» (Southern blots).
Замість ДНК можна перенести на фільтри з гелю РНК. Такі фільтри називають Норзерн-фильтрами [гра слів: прізвище Саузерн означає «південний»; фільтри з ДНК по Саузерну — південні блоты; фільтри з РНК жартівливо позначили як північні блоты (Northern); фільтри з белками— як західні (Western)].
Щоб проводити гібридизацію з Саузерн- і Норзерн- фільтрами, що містять вельми малі кількості індивідуальної ДНК і РНК, були потрібні дуже високомічені проби. Їх навчилися робити шляхом энзиматического введення влучні у виділені препарати нуклеїнових кислот. Найбільш поширений метод — це так звана ник-трансляция (nick-translation). ДНК інкубують з двома ферментами, ДНК-полимеразой I і Днказой I (остання береться в нікчемних кількостях разом з високоміченими попередниками ДНК, дезоксирибонуклеозидтрифосфатами). Днказа вносить до двухцепочечную ДНК одноцепочечные розриви. На ці місця сідає ДНК-полимераза і руйнує один з ланцюгів ДНК, одночасно наново її забудовувавши, але використовуючи при цьому мічені попередники. Таким чином, велика частина ДНК заміщається радіоактивною, зберігаючи при цьому свою нуклеотидную послідовність. Є і інші методи включення влучні в ДНК і РНК.
Розглянемо блот-гибридизацию по Саузерну (1975). Ця методика складається з декількох етапів етапів (рис.49).
Після закінчення электрофореза гель поміщають в розчин підстави (луги), в якій двухцепочечные фрагменти ДНК втрачають зв'язки і стають одноцепочечными.
Перенесення ДНК з гелю на фільтр нітроцелюлози або нейлонового проводиться в буферному розчині. Безпосередньо на поверхню гелю кладуть фільтр і стопку фільтрувального паперу. Із-за капілярного ефекту створюється струм буфера, перпендикулярний площині гелю. ДНК, що вимивається з гелю, затримується фільтром і практично повністю виявляється на його поверхні. Після перенесення одноцепочечные нитки фіксують на фільтрі. Розташування фрагментів на фільтрі точно відповідає їх розташуванню в гелі.
Для того, щоб візуально виявити потрібні фрагменти (фіксована на фільтрі ДНК не видно), проводять гібридизацію із специфічним по нуклеотидной послідовності міченим радіонуклідом або флюоресцентною

Ріс.49. Блот-гибридизация по Саузерну
міткою олигонуклеотидным синтетичним зондом (16—30 пар нуклеотидов) або клонованим фрагментом ДНК. Нуклеотідная послідовність зонда повинна бути повністю або частково комплементарна ділянці ДНК генома, що вивчається.
При інкубації фільтру з розчином, що містить мічений зонд, відбувається гібридизація комплементарних ланцюгів ДНК-зонда і фрагмента на фільтрі. Неспецифічно зв'язані молекули зонда відмиваються за допомогою спеціальної процедури. Радіоактивно мічені ділянки виявляють шляхом експонування фільтру з рентгенівською плівкою (авторадіографія). Після прояву на плівці видно смуги міченої зондом ДНК. Нерадіоактивні мітки візуалізують за допомогою флюоресценції або опосередковано за допомогою антитіл. Блот-гибірідізация — високочутливий, але дорогий і трудомісткий метод виявлення специфічних послідовностей ДНК.
Метод норзерн-блот-гибридизации — Northern-blot. Метод використовується для визначення рівня експресії гена шляхом кількісної оцінки иРНК. Метод складний і тривалий по виконанню (5—7 діб). Труднощі пов'язані з необхідністю блокувати при виділенні РНК так звані Рнкази, які надзвичайно стабільні і стійкі по відношенню до багатьом хімічним процедурам, вживаним при екстракції РНК. Процедури блот-гибридизации по Е. Саузерну і нозерн-блот-гибридизации не знайшли застосування в клінічній мікробіології, оскільки вони трудомісткі. Точками додатку даних методів з'явилися завдання, пов'язані з проведенням наукових досліджень і завдань по вивченню структури генома ДНК (РНК), а також для виявлення точкових мутацій.
Метод гібридизації in situ (ISH - in situ hybridization). Метод заснований на проведенні процесів гібридизації безпосередньо на зрізі або в мазанні з використанням будь-яких зондів. Приватна методика гібридизації in situ — FISH (fluorescent in situ hybridization), дозволяє встановити наявність патогена в препаратах, фіксованих у формаліні, і залитих парафіном зрізах і пунктатах тканині, що особливо важливе при патоморфологічному аналізі. Метод гібридизації in situ базується на основних принципах гібридизації твердофазной і гібридизація в розчині. Чутливість методу гібридизації in situ обмежена можливістю проникнення зондів всередину кліток для пов'язання з шуканою мішенню. Процес гібридизації проходить в тканинах, при цьому зонд забезпечений флуоресцентною міткою. Після промивки матеріалу і видалення молекул, що не зв'язалися, здійснюється детекция, для чого мазок або зріз проглядають у флуоресцентному мікроскопі. Метод ISH складний для здійснення і в порівнянні з іншими молекулярними методами малочутливий. Метод найбільш зручний для визначення мішеней, наприклад, вірусів в інфікованих клітках, які представлені великим числом копій.
Метод розгалуженої ДНК (branch-DNA). Шукана нуклеїнова кислота зв'язується з уловлюючим зондом, один кінець якої комплементарен мішені, а інший — певному кінцю підсилюючого зонда. При цьому підсилюючий зонд може бути комплементарен наступному зонду і так далі Кількість зондів може бути велике, і всі вони пов'язані з декількома (від одного до декількох десятків) люмінофорами, які у міру збільшення кількості зв'язаних зондів підсилюють (хеми-, флуоро-) люмінесценцію. Перевагою даного методу є можливість використання в одній реакції декількох уловлюючих зондів, що зв'язуються з мішенню, що забезпечує виявлення агентів, що характеризуються значною гетерогенністю генома, наприклад, вірус імунодефіциту людини.
Останнім часом в практиці знайшов застосування метод гібридизації в розчині із зондами, міченими акридином. Результати гібридизації реєструють по випусканню міткою світла певної довжини хвилі після обробки лугом.
В даний час ведуться інтенсивні розробки по вдосконаленню методів гібридизації в наступних напрямах:
Спрощення процедури генного зондування до однієї — двох стадій процесу.
Відмова від сорбції на мембрані.
Підвищення чутливості гибридизационных методів за рахунок використання процедури ампліфікації сигналу із зонда.
Активні розробки по третьому напряму стали можливими лише з моменту появи і впровадження в практику методів ампліфікації нуклеїнових кислот.
Клонування фрагментів нуклеїнових кислот in vitro. Полімеразная ланцюгова реакція (ПЦР). В більшості випадків для успішної діагностики хвороби або гетерозиготного стану досить досліджувати лише невеликий фрагмент генома, тому для проведення аналізу необхідно отримати достатню кількість таких фрагментів, тобто амплифицировать (помножити) їх. Раніше це завдання вирішувалося за допомогою трудомісткого підходу: створення рекомбинантной плазмиды - введення плазмиды в бактерійну клітку - розмноження бактерійних кліток - виділення заданих фрагментів ДНК. Тепер це завдання - накопичення потрібних фрагментів ДНК - вирішується за допомогою ПЦР. Відкриття даної реакції зробило справжню революцію у вивченні генома людини і в молекулярно-генетичній діагностиці спадкових хвороб.
Полімеразная ланцюгова реакція (ПЦР) — метод ампліфікації ДНК in vitro. Протягом декількох годинників можна розмножити певну послідовність ДНК в кількості, що перевищує початкове в мільйон разів і більш. Отже, початково потрібна дуже незначна кількість матеріалу. Необхідною умовою для проведення ПЦР є знання нуклеотидной послідовності амплифицируемого фрагмента або, принаймні, цього фрагмента (рис.50).
Відповідно до нуклеотидной послідовності кінців досліджуваної ділянки синтезується два олигонуклеотидных праймера (приманки). Довжина праймеров складає 20—30 пар нуклеотидов.
Процес ампліфікації полягає в здійсненні циклів, що повторюються. Кожен цикл включає 3 стадії: температурна денатурація ДНК (розділення двухцепочечной ДНК на одноцепочечные молекули) - приєднання праймеров до комплементарних послідовностей одноцепочечных молекул (відпал) - синтез полинуклеотидных ланцюгів на одноцепочечных молекулах у межах приєднаних праймеров за допомогою полимеразы.
Вперше склад інгредієнтів, що входять в реакційну суміш для постановки полимеразной ланцюгової реакції, і основні принципи використання праймеров для отримання копій ДНК були описані Kleppe з соавт. у 1971 році. Проте тоді ще не була продемонстрована основна межа ПЦР - експоненціальне збільшення кількості копій фрагмента початкової ДНК як результат реакції. Це було здійснено в 1985 р. Подальше використання в ПЦР термостабільної ДНК-полимеразы істотно розширило можливості її застосування, як в наукових цілях, так і в клініці. Метод став настільки популярний, що сьогодні вже важко представити роботу в області молекулярної біології без його використання. Особливо бурхливий розвиток метод полимеразной ланцюгової реакції отримав завдяки міжнародній програмі «Геном людини». Були створені сучасні лазерні технології сиквенирования (розшифровки нуклеотидных послідовностей ДНК). Якщо в недавньому минулому для розшифровки послідовності ДНК розміром в 250 пар нуклеотидов (п.н.) був потрібний тиждень, то сучасні лазерні секвенаторы дозволяють визначати
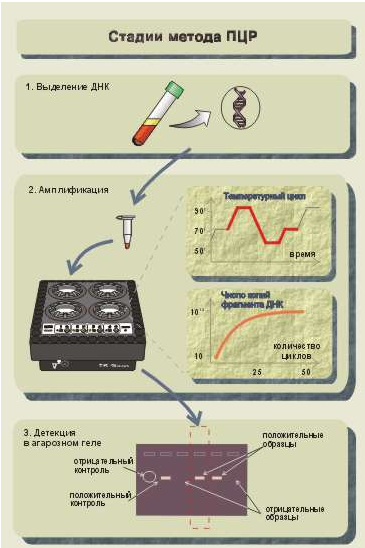
Ріс.50. Три етапи ПЦР-анализа
до 5000 п.н. у день. Це у свою чергу сприяє значному зростанню інформаційних баз даних, що містять послідовності ДНК. В даний час запропоновані всілякі модифікації ПЦР, показана можливість створення тест-систем для виявлення мікроорганізмів, виявлення точкових мутацій, описані десятки різних застосувань методу. В даний час ПЦР використовується при діагностиці: генетичних, інфекційних і онкологічних захворювань; патогенов в їжі; ідентифікації особи; у судовій медицині, криміналістиці; при трансплантації органів і тканин; визначенні батьківства. На відміну від иммуноферментного аналізу, який широко використовується для діагностики інфекційних захворювань, ДНК-діагностика дозволяє визначати безпосередньо збудника захворювання. За допомогою вдосконалених схем постановки ПЦР можна виявляти патогенні мікроорганізми в дуже низькій концентрації.
ДНК-діагностика раки обмежується невеликою, але активно зростаючою кількістю відомостей про гени, що асоціюються з раком. В рамках проекту «Геном людини» учені продовжують пошуки мутацій, що асоціюються з цим типом захворювань.
Полімеразная ланцюгова реакція - це здійснювана in vitro специфічна ампліфікація нуклеїнових кислот, що ініціюється синтетичними олигонуклеотидными праймерами; її основні етапи представлені на мал. ПЦР-цикл складається з теплової денатурації ДНК, її відпалу з праймером і подовженнями ланцюга (элонгации); зміна цих етапів відбувається в результаті простої зміни температури. Праймери при цьому орієнтуються на матриці так, що число раундів реплікації росте експоненціально, відповідно збільшується і число копій специфічної нуклеотидной послідовності.
Застосування молекулярних методів для цілей клінічної діагностики обмежується їх невисокою чутливістю і тривалістю аналізу. Так, для виявлення нуклеїнової кислоти-мішені методом гібридизації in situ з присутня в препараті в декількох тисячах копій. Нерідко число аномальних послідовностей в клінічному препараті диагностически- значущо, але менше цієї величини і гібридизація може дати ложноотрицательный результат. На відміну від цього ПЦР дозволяє виявити унікальну нуклеотидную послідовність. Для цього в реакційну суміш додають у великому надлишку специфічні для даної послідовності олигонуклеотидные праймеры («амплимеры»), які утворюють з нею комплекс, і проводять реплікацію ДНК in vitro. Оскільки амплимеры гибридизуются з обома ланцюгами ДНК, то і нативная послідовність, і ПЦР-продукты, що синтезуються, можуть служити матрицями в подальших раундах реплікації, внаслідок чого число копій унікальної послідовності експоненціально збільшується. Завдяки цьому послідовності, присутні в клінічному препараті у мінімальній кількості (одна або декілька копій) і що не виявляються ніякими іншими методами, легко виявляються за допомогою ПЦР. ПЦР дозволяє знайти всього одну аномальну послідовність на 100000-1000000 нормальних кліток.
Експоненціальне збільшення числа копій молекули-мішені не тільки забезпечує високу чутливість методу, але і полегшує їх виявлення. Кожен раунд ПЦР займає від 2 до 5 мін, і зазвичай для досягнення необхідної чутливості достатні 25-50 раундів, тобто 2-4 ч (рис.51). Крім того, оскільки зміст ПЦР-продуктов достатньо великий, можна використовувати неізотопні методи детекции.
Ампліфікація РНК. Можливість використання РНК як мішень для ПЦР істотно розширює спектр застосування цього методу. Наприклад, геноми багатьох вірусів (гепатиту З, вірус інфлуенци, пикорнавирусы і так далі) представлені саме РНК. При цьому в їх життєвих циклах відсутня проміжна фаза перетворення в ДНК. Для детекции РНК необхідно в першу чергу перевести її у форму ДНК. Для цього використовують зворотну транскриптазу, яку виділяють з двох різних вірусів: avian myeloblastosis virus і Moloney murine leukemia virus. Використання цих ферментів пов'язане з деякими труднощами. Перш за все, вони термолабильны і тому можуть бути використані при температурі не вище 42° С. Так як при такій

Ріс.51. Полімеразная ланцюгова реакція
температурі молекули РНК легко утворюють вторинні структури, то ефективність реакції помітно знижується і по різних оцінках приблизно рівна 5%. Робляться спроби обійти цей недолік використовуючи як зворотної транскриптазы термостабільну полимеразу, отриману з термофильного мікроорганізму Thermus thermophilus, що проявляє транскриптазную активність у присутності Mn2+. Це єдиний відомий фермент, здатний проявляти як полимеразную, так і транскриптазную активність.
Для проведення реакції зворотної транскрипції в реакційній суміші також як і в ПЦР повинні бути присутніми праймеры як приманка і суміш 4-х дНТФ, як будівельний матеріал.
Після проведення реакції зворотної транскрипції, отримані молекули кДНК можуть служити мішенню для проведення ПЦР.
Підбір праймеров. Пцр-праймери, або амплимеры, зазвичай мають розмір від 18 до 25 нуклеотидов. Їх можна синтезувати за допомогою автоматичних синтезаторів ДНК, наявної в більшості крупних дослідницьких центрів. Кількості отримуваних таким чином олигонуклеотидов (0,2—1 мкмолей) зазвичай достатньо для проведення декількох сотень або тисяч ПЦР-реакций. Часто в 5’-концевой ділянку праймеров для спрощення клонування Пцр-ампліфіцированной ДНК вводять сайти пізнавання для рестриктирующих эндонуклеаз.
Підбір праймеров - ключова ланка ПЦР, оскільки саме ними визначається можливість ампліфікації і виявлення потрібної послідовності, а також надзвичайна гнучкість методу. Просте варіювання праймеров дозволяє виявляти багато патогенних мікроорганізмів і генетичні порушення при мінімальних змінах в методиці.
Пцр-ампліфіцированниє фрагменти ДНК мають різний розмір. Він визначається сумою розміру праймеров і відстані між їх 3’-концами і в більшості випадків лежить в діапазоні 100—300 нуклеотидов. Можлива ампліфікація (але зазвичай менш успішна) послідовностей-мішеней завдовжки більше 1000 п.н. Швидкість реплікації за допомогою ДНК-полимеразы Tag складає 35—100 нуклеотидов в секунду.
Таg-полимераза. У 1980 році полимеразная активність була відкрита у деяких форм термофильных бактерій. Таg-полимераза була виділена з бактерій виду Thermus aquaticus, здатних рости при температурі 70-75°С. Молекулярна вага очищеного протеїну 94 кД і оптимальна температура полимеразной активності 70-80°С. Активність ферменту зменшується, але полимераза не денатурується при 90°С, при зниженні температури до 70-80°С рівень активності відновлюється.
Tag-полимераза має дуже високу швидкість синтезу. За оптимальних умов фермент може добудовувати до 150 основ на секунду. При низькій температурі активність падає до 2 основ на секунду. Час напівжиття Таg-полімеразі при 95°С складає 40 хвилин.
Секвенірованіє ДНК — визначення нуклеотидной послідовності. В даний час розроблені методи визначення повної нуклеотидной послідовності будь-якої молекули ДНК. При рішенні цієї задачі необхідно мати велику кількість ідентичних фрагментів молекул ДНК. Напрацювання послідовностей, що цікавлять, можна здійснити клонуванням відповідного фрагмента, наприклад, методом ПЦР. Метод секвенирования по Максаму — Гілберту заснований на хімічному розщеплюванні ДНК по певній підставі. Інший ферментативный метод (метод Сенгера) базується на застосуванні аналогів нуклеотидов, що переривають синтез комплементарного ланцюга ДНК по одноцепочечной матриці в місці вбудовування в ланцюг відповідного аналога. Секвенірованіє дозволяє визначити повну нуклеотидную послідовність всіх хромосом, всього ДНК будь-якого генома, будь-якого організму. Це вже майже повністю зроблено для деяких бактерій, мухи дрозофилы, миші і людини. Крім того, цей метод дозволяє визначити послідовність нуклеотидов будь-яких генів, що дає можливість їх синтезу.
Методи ДНК-діагностики. Прямі і непрямі методи ДНК-діагностики. Види ДНК-діагностики: підтверджуюча, пресимптоматическая, носійства, пренатальна.
Принципово розрізняють пряму і непряму ДНК-діагностику моногенних спадкових хвороб. Прямі методи можливі лише за умови, що ген захворювання клонований, відома його экзон-интронная організація або нуклеотидная послідовність повнорозмірної комплементарної ДНК. При прямій діагностиці предметом аналізу є мутації гена. Головною перевагою прямих методів діагностики є майже 100% ефективність.
Проте в більшості випадків спадкових захворювань ген не клонований або захворювання є генетично гетерогенним, тобто обумовлено пошкодженнями в різних генах, або молекулярна організація гена не дозволяє використовувати прямі методи. Ці труднощі можуть бути подолані за допомогою непрямих методів ДНК-діагностики, заснованих на використанні зчеплених з геном поліморфних маркерів. В цьому випадку визначається гаплотип хромосоми, що несе ген мутанта в сім'ях високої риски, тобто у батьків хворого і його найближчих родичів. Такий підхід можливий практично для всіх моногенних захворювань з відомою локалізацією гена.
Прямі методи пошуку мутацій. У ДНК-діагностиці в даний час використовуються різноманітні прямі методи. Найпростіше виявляються мутації, що змінюють довжину амплифицированных фрагментів ДНК, яка виявляється при электрофоретическом аналізі.
Для виявлення точковых мутацій, невеликих делеций і инсерций в досліджуваних генах використовується безліч різних підходів, заснованих на методі ПЦР, завдяки якому можна багато разів збільшити унікальну послідовність ДНК, а потім проаналізувати її на предмет мутації. За допомогою специфічних олигонуклеотидных праймеров проводять ампліфікацію кодуючих ділянок ДНК генома у випадку, якщо відома экзон-ннтронная структура досліджуваного гена.
Якщо структура гена не відома, то отримують кДНК-продукты шляхом зворотної транскрипції мРНК, виділеною з кліток хворих. Продукти ампліфікації є об'єктами подальшого пошуку мутацій за допомогою ряду методів, що дозволяють виявляти невеликі структурні зміни.
Методи, засновані на технології ПЦР. У загальному випадку секвенирование повнорозмірної кДНК, або всіх экзонов, для визначення мутацій у окремих пацієнтів достатньо трудомістко, дорого і вимагає великих витрат часу. Тому на практиці частіше проводять попередній відбір простішими методами ампліфікації фрагментів ДНК, що імовірно містить мутації, а потім секвенируют тільки ці ділянки ДНК. Методи пошуку фрагментів ДНК, що містить мутації, засновані на порівняльному аналізі послідовностей мутантів і нормальних по цілому ряду фізичних і хімічних характеристик, які в значній мірі варіюють залежно від типу мутаційного пошкодження. Слід підкреслити, що незалежно від методу детекции мутації точні молекулярні характеристики кожної мутації можуть бути отримані тільки шляхом прямого секвенирования.
Найпростіше виявляються мутації, що змінюють довжину амплифицированных фрагментів, оскільки подібні порушення легко виявляються при электрофоретическом аналізі. Протяжні делеции, захоплюючі цілі экзоны в генах, зчеплених з підлогою, можуть успішно виявлятися при використанні так званого мультиплексного варіанту ПЦР. Різниця в розмірах і числі амплифицированных фрагментів дозволяє легко ідентифікувати такі мутації при электрофорезе. Даний підхід застосовний до аналізу делеций в аутосомных генах тільки в тих випадках, коли можливо доповнити ПЦР кількісною оцінкою результатів ампліфікації. Оригінальний метод ідентифікації подібних делеций у гетерозигот заснований на використанні як матрична ДНК для ПЦР кДНК, отриманою шляхом зворотної транскрипції мРНК, ізольованою з экспрессирующих даний ген тканин пацієнта. На відміну від нормального гомолога, в молекулі мутанта кДНК экзоны граничать з делецией зближують. Для виявлення гетерозигот по протяжних внугригенным делециям проводять мультиплексну ПЦР з використанням системи олигопраймеров, що повністю перекривають всю молекулу кДНК. Наявність делеций реєструють по появі продуктів ампліфікації незвичайного розміру.
Після виявлення відмінностей між нормальною і мутантом ДНК по довжині амплифицированного фрагмента необхідно провести секвенирование незвичайного фрагмента з метою визначення змін в нуклеотидной послідовності імовірно ДНК мутанта.
При мутаціях гена, що є заміною одного або декількох нуклеотидов, довжини амплифицированных фрагментів залишаються постійними, проте деякі физико-хімічні властивості молекул мутантів міняються. З урахуванням цих особливостей розроблені різні варіанти пошуку фрагментів мутантів ДНК і ідентифікації в них точковых мутацій. Ведучими з цих методів є: метод аналізу інформаційного поліморфізму однонитевой ДНК (SSCP), метод аналізу гетеродуплексов (НА), денатуруючий градієнтний гель-электрофорез (DGGE) і метод хімічного розщеплювання некомплементарних сайтів (ССМ).
SSCP (Single Strand Conformation Polymorphism) — метод аналізу конформа-ционного поліморфізму однонитевой ДНК — заснований на реєстрації відмінностей в электрофоретической рухливості однонитевых ДНК, однакової по величині, але що розрізняються унаслідок нуклеотидных замін по просторовій організації молекул. Конформація невеликої однонитевых ДНК залежить від нуклеотидной послідовності, тому заміна навіть одного нуклеотида приводить до зміни просторової структури. Метод включає ампліфікацію фрагментів ДНК розміром до 300 пар нуклеотидов, денатурацію продуктів ПЦР і высокоразрешающий электрофорез в полиакриламидном гелі.
Конформаційний метод виявлення точковых мутацій набув широкого поширення унаслідок відносної простоти і можливості виявляти будь-які типи замін. Проте обмеженням застосування цього методу є розмір досліджуваного фрагмента ДНК, оскільки висока ефективність детекции мутацій, що становить 80—95%, показана при довжині фрагментів менше 200 пар нуклеотидов, тоді як для фрагментів більше 400 пар нуклеотидов вірогідність виявлення мутацій зменшується до 50%.
В даний час роздільна здатність методу значно підвищена. Зокрема, розроблені підходи для ідентифікації точковых мутацій методом SSCP-анализа в амплифицированных фрагментах ДНК розміром до 800 пар нуклеотидов. Для цього використовується полиакриламидный гель з низьким значенням рН.
НА (Heteroduplex Analysis) дозволяє виявляти мутації, що знаходяться в гетерозиготном стані, а також инсерции і делеции. Принцип цього методу полягає в наступному.
При ампліфікації фрагментів генів гетерозигот, подальшій денатурації і повільній ренатурации отриманих продуктів ПЦР в амплификационной суміші разом з двома типами гомодуплексов утворюються гетеродуплексы між нормальним і мутантом ланцюгами ДНК. Такі гетеродуплексные молекули відрізняються по электрофоретической рухливості від гомодуплексов за рахунок конформаційних особливостей в місцях неспівпадання нуклеотидов, оскільки электрофоретическая рухливість гетеродуплексов значно нижча, ніж гомодуплексов. Ці відмінності виявляються при электрофорезе в звичайному полиакриламидном гелі.
На сьогоднішній момент найбільш поширеним способом скринінгу мутацій є комбінація аналізу гетеродуплексов і методу однонитевого конформаційного поліморфізму, що дозволяє виявити точковые мутації майже в 100% випадків і що не вимагає великих витрат часу.
DGGE — денатуруючий градієнтний гель-электрофорез. У цьому методі ДНК-дуплекс піддається міграції в гелі з градієнтом денатуруючих умов (може бути використаний і температурний градієнт). Міграція продовжується до тих пір, поки ДНК-дуплекс не досягає в гелі точки плавлення і не розділяється, після чого міграція фрагментів зупиняється. Однонуклеотідниє відмінності в нормальній і тестованій ДНК виявляються по різній электрофоретической рухливості в гелі. Висока чутливість методу (95%) досягається завдяки специфічним праймерам з так званим GC-зажимом, представленим чергуванням гуанина і цитозина в кількості до 20 нуклеотидов. За рахунок цього температура плавлення продукту ампліфікації сильно збільшується, що підвищує ефективність визначення мутації. Проте праймеры з GC-зажимом достатньо дорогі, тому метод використовується обмежено.
ССМ (chemical cleavage of mismatch) — метод хімічного розщеплювання неспарених підстав. Метод заснований на гібридизації радіоактивно міченої ДНК-проби з тестованою ДНК. Місця помилок потім виявляють за допомогою серії хімічних реакцій (модифікація з використанням тетрахлорида осмію), які відбуваються з однонитевой ДНК в сайтах неправильного спаровування. Цей метод може бути застосований для тестування фрагментів ДНК розміром до 1 тис. пар нуклеотидов, виявляє локалізацію помилки і є досить чутливим. Проте він не знайшов широкого розповсюдження унаслідок токсичності вживаних хімічних реагентів і методичної складності. Подібне розщеплювання неспарених нуклеотидов може бути і энзиматическим, що дозволяє уникнути токсичних хімікатів. Метод заснований на розщеплюванні неспарених підстав в гетеро-дуплексе, що утворюється між тестованою ДНК і нормальною послідовністю за допомогою таких ферментів, як резолваза фага Т4 або эндонуклеаза VII. Проте цей метод ще «капризніший», ніж ССМ.
Завершальним етапом аналізу мутацій є їх секвенирование, тобто визначення нуклеотидной послідовності фрагмента ДНК, що показав аномальну электрофоретическую рухливість. Послідовність нуклеотидов цього фрагмента порівнюється з нормою, внаслідок чого патологія набуває своєї остаточної характеристики.
Метод секвенирования. Будь-які типи мутацій можуть бути виявлені шляхом прямого секвенирования мутанта кДНК або окремих экзонов, і часто первинний пошук порушень в кодуючих областях гена здійснюють саме таким чином. Для деяких генів, що мають невеликі розміри, метод прямого секвенирования з успіхом застосовується як основний метод сканування мутацій. Так, зокрема, особливо зручним виявилося його застосування для детекции мутацій в порівняно невеликих за розміром генах, таких, як ген чинника IX згортання крові (гемофілія В).
Розроблені останніми роками модифікації методів ПЦР значно полегшили секвенирование амплифицированных фрагментів і підвищили його ефективність. Так, зокрема, запропонований варіант асиметричної ПЦР, коли при ампліфікації концентрація одного з олигопраймеров в декілька десятків разів перевершує концентрацію іншого праймера, внаслідок чого синтезується переважно тільки одна, потрібний для секвенирования ланцюжок ДНК.
Лікар лаборант-генетик заздалегідь визначає стратегію пошуку виходячи з оснащеності лабораторії.
Багато мутацій переривають синтез білкового продукту. У цих випадках утворюються укорочені полипептидные ланцюги, функціонально незначущі. Для діагностики таких мутацій можна застосовувати метод «трансляції білкового продукту». Він проводиться в системі in vitro на основі отриманої специфічною мРНК з додаванням лизата ретикулоцитов (у нім містяться всі необхідні компоненти для синтезу білка). У цій системі синтезується білковий продукт відповідного гена. Продукт трансляції аналізують за допомогою электрофореза. Зміна электрофоретической рухливості білка свідчить про наявність мутації (нонсенс-мутація, порушення сплайсинга РНК, зрушення рамки прочитування), що приводить до «обриву» синтезу полипептидной ланцюжка.
Непряме виявлення мутацій. Непряме виявлення мутацій застосовується в тих випадках, коли нуклеотидная послідовність гена ще не відома і разом з тим є інформація про відносне положення гена на генетичній карті. Фактично це відповідає діагностиці за допомогою методу зчеплення генів.
Непряма ДНК-діагностика по суті зводиться до аналізу поліморфних генетичних маркерів у хворих і здорових членів сім'ї. Маркери повинні бути розташовані в тому хромосомному регіоні, де і ген хвороби, тобто вони зчеплені. Такими маркерами можуть бути ділянки ДНК, що існує в популяції в декількох аллельных варіантах. Відмінності можуть бути по складу нуклеотидов, по числу динуклеотидных повторів. На основі вариабельности складу маркерних ділянок ДНК можна диференціювати материнське або батьківське походження конкретного варіанту маркера, зчепленого з геном хвороби. Зчеплення означає, що маркер і ген хвороби розташовуються близько один від одного; вони передаються у складі одного хромосомного сегменту. Завдяки аналізу поліморфних генетичних маркерів можна прослідкувати у ряді поколінь спадкоємство кожній з батьківських хромосом.
Технічні прийоми в непрямій діагностиці ті ж самі, що і в прямій діагностиці (отримання ДНК, рестрикція, электрофорез і так далі). Природно, до цього додається математичний аналіз зчеплення ознак.
Використання непрямих підходів виявилося можливим завдяки існуванню в геномі поліморфних ділянок (локусов) ДНК. Нуклеотідниє заміни достатнє часто зустрічаються в некодуючих ділянках ДНК. Значне число нуклеотидных замін приводить до зміни місць рестрикції. Ці зміни можна виявити за допомогою блот-гибридизации по Саузерну, оскільки змінюється довжина рестриктных фрагментів. Цей різновид поліморфізму ДНК отримав назву поліморфізму по довжині рестриктных фрагментів.
Розташований поблизу гена, що вивчається, або усередині нього поліморфний сайт може служити маркером аллельных варіантів цього гена, зокрема маркером патологічних мутацій.
Поліморфізм, обумовлений нуклеотидными замінами або делециями, як правило, диаллелен, а значить, його інформаційна цінність обмежена. Більш інформативними є кластери тандемних повторів, які обумовлюють поліморфізм по кількості копій (VNTR — variable number of tandem repeates), так званий поліморфізм міні- і послідовностей мікросателітів.
Мікросателіти — короткі тандемні повтори, зазвичай дву-гексануклеотидные. Найпоширенішим з них є СА-повтор. Показано, що кластери СА-повторов зустрічаються в середньому 1 на 30 тис. пар нуклеотидов. Вони локалізовані, як правило, в некодуючих районах ДНК. Блоки СА-повторов демонструють спадкоємство Менделя в сім'ях і не виявляють нових мутацій. Важливим позитивним чинником є відносна простота виявлення таких повторів в геномі людини. Окрім СА-повторов, достатньо поширені GA-повторы і інші кластери тандемних повторів (ТТТА) п; (ТСТА)п; (ТТТС)п, також виявляючі вариабельность по числу повторів. Широка поширеність в геномі (частота різних мікросателітів, узятих разом, складає 1 на 6 тис. пар нуклеотидов), високий рівень поліморфізму роблять мікро- і мінісателіти ідеальними поліморфними маркерами для картирования генів спадкових захворювань і проведення непрямої ДНК-діагностики.
Поліморфна ДНК-маркер і інтегральна карта їх розташування дозволяють визначити і прослідкувати в поколіннях хромосому, що несе патологічний ген, а також докладним чином охарактеризувати певний хромосомний район, виявити субмікроскопічні перебудови, визначити найменший район їх перекриття і локалізувати ген-кандидат, відповідальний за захворювання.
Основний недолік непрямих методів діагностики — обов'язкове попереднє вивчення генотипу (гаплотипа) хоч би одного ураженого родича. У разі відсутності уражених родичів, «доступних» для обстеження, проведення діагностики (за рідкісним виключенням) стає неможливим.
Отже, навіть з схематичного опису неважко зрозуміти, що існує достатньо багато молекулярно-генетичних методів діагностики спадкових хвороб. Ці методи виявилися настільки універсальними, що знайшли застосування не тільки в медичній генетиці, але і в діагностиці інфекційних захворювань. Для кожного з методів є багато варіантів. Одні і ті ж хвороби можна діагностувати різними методами. Звідси неважко укласти, що є великі можливості для діагностики хвороби навіть у важких випадках (неможливість обстеження батьків, мала кількість біологічного матеріалу, відсутність відомостей про ген і так далі).
Автоматизація тих, що існують і розробка принципово нових підходів до вивчення структури нуклеїнових кислот разом з прискореними темпами вивчення генома людини і клонування генів, відповідальних за розвиток моногенної патології, дозволяють прогнозувати появу в недалекому майбутньому засобів діагностики більшості відомих спадкових хвороб людини.
Мікрочіпи. ДНК-мікрочіп дозволяє здійснювати автоматизований і високопродуктивний аналіз складних геномів. Ця технологія в її різних варіантах розвивається дуже інтенсивно. Коротко розглянемо принципи технології і її застосування до медичних проблем. Простий принцип мікрочіпа: у різні квадрати твердої підкладки поміщаються олигонуклеотиды, відповідні різним аллелям одного гена. Наприклад, представлене 3 аллельных олигонуклеотида, що розрізняються однією заміною, які ковалентно прикріплені до підкладки. Ці олигонуклеотиды відповідають трем варіантам мононуклеотидного поліморфізму (SNP, single nucleotide polymorphism). Таким чином, кожному аллелю відведений на підкладці свій квадрат. Задамося питанням, які аллель або які аллели даного локуса представлені в ДНК пацієнта. Це питання вирішується за допомогою гібридизації міченою радіоактивно або флюоресцентні проби ДНК від пацієнта з мікрочіпом. Якщо в цій пробі представлений, наприклад, тільки аллель 1, то гібридизація відбуватиметься тільки з тим квадратом, де иммобилизован олигонуклеотид 1. Якщо в пробі представлено 2 аллеля (1 і 2), то гібридизація відбуватиметься з двома квадратами (1 і 2) і так далі Мікрочіпи, пов'язані, що містять, з підкладкою олигонуклеотиды, далі визначатимемо як олигонуклеотидные мікрочіпи. ДНК-ОЛІГОНУКЛЕОТІДНИЙ чіп, що містить тисячі олигонуклеотидов, створюється сучасними методами протягом 1 дня. Може бути приготована серія мікрочіпів, що містить сотні тисяч олигонуклеотидов із заданою послідовністю. Як і в приведеному вище схематичному прикладі, техніка аналізу заснована на фізичній гібридизації досліджуваної ДНК з безліччю олигонуклеотидов, иммобилизованных на твердій підкладці. Такий підхід припускає явне знання структур аллелей. Його визначають як «придбання проби» (gain of probe). Негайним застосуванням такого підходу може стати аналіз зчеплень. Якщо в сім'ї з хворобою зчеплений один з аллелей маркера, тоді як інший аллель (аллели) зчеплений із здоровим геном, то аналіз зчеплень може бути виконаний таким чином:
амплифицируйте у кожного члена сім'ї поліморфний аллель за допомогою праймеров Р1 і Р2
помітьте амплифицированные продукти за допомогою радіоактивної або флюоресцентної мітки
гибридизуйте кожен продукт з мікрочіпом і виявите квадрат, в якому відбулося пов'язання з міченою пробою. Цей квадрат показуватиме, який аллель присутній у даного члена сім'ї.
Технологія може бути використана для аналізу поліморфізму генома. Зокрема, 149 мікрочіпів, кожен з яких містив 150 000— 300 000 олигонуклеотидов, було використано для скринінгу 263 млн п. о. послідовності генома людини, і в результаті було виявлено 3241 поліморфний сайт. Слід звернути увагу на те, що у всіх випадках досліджувалася визначена, невелика в порівнянні з повним геномом, область.
Не дивлячись на вражаючі результати і простоту описаної вище технології, що використовує олигонуклеотидные мікрочіпи, що здається, існує безліч проблем, пов'язаних з її практичним використанням. Мікрочіпи можуть давати високий рівень ложнопозитивных відповідей при виявленні SNP. Інсерциі, вставки, делеции і перегруповування важко піддаються аналізу цим методом. Елементи генома, що повторюються, також здатні вносити серйозні ускладнення до аналізу.
Крім детекции мутацій і полиморфизмов, олигонуклеотидные мікрочіпи припускають використовувати для створення генетичної карти третього покоління. Зокрема, олигонуклеотиды, відповідні SNP, легко можна помістити на мікрочіпи. Оскільки SNP в основному диаллельны, для створення карти їх потрібно разу в 3 більше, ніж мультиаллельных маркерів. Можна передбачати безліч інших застосувань олигонуклеотидных мікрочіпів, включаючи аналіз зчеплень і асоціацій, втрату гетерозиготности і ДНК-дактилоскопію.
Інший важливий аспект використання олигонуклеотидных мікрочіпів — аналіз експресії генів. Аналіз особливостей експресії генів — один з необхідних елементів для розуміння їх функцій. 20-звенный олигонуклеотид, що представляє певний ген, мабуть, достатній для надійного виявлення продукту цього гена серед клітинних РНК. Зміст транскриптов може бути зміряне аж до декількох копій на клітку. Вдається простежувати експресію 10 000 генів на 1 чіп. Ця система вже використана для вивчення змін в експресії генів в ракових клітках. Порівняння експресії 900 генів в 2 клітинних лініях показало, що при пухлинній трансформації 1,7% генів знижувало рівень експресії, тоді як 7% — підвищувало.
Для аналізу експресії генів використовують також інший варіант мікрочіпів, не олигонуклеотиды, що містять. а иммобилизованные кДНК. У випадків кДНК-микрочипов Ппр-ампліфіцированниє фрагменти індивідуальних кДНК наносять в різні квадрати мікрочіпа, так що кожен квадрат ставиться у відповідність з певним геном. ДНК фіксує в цих квадратах і денатурує, щоб зробити її одноцепочечной. Чіп з иммобилизованной ДНК гибридизуют з сумішшю різний флюоресцентний мічених кДНК, отриманих з порівнюваних тканин, точно так, як і це робилося у разі олигонуклеотидных мікрочіпів.
Недавно кДНК-микрочипы використовували також для аналізу відмінностей близькоспоріднених геномів. В цьому випадку технологія була використана для аналізу ДНК з клітинних ліній і пухлин з відомими хромосомними аномаліями, щоб оцінити перспективність методу. Показана можливість виявлення делеции в одній з хромосом і відмінності в числі копій хромосом в анеуплоидных клітках.
Хоча початковою ідеєю використання мікрочіпів було швидке секвенирование ДНК, зараз ця ідея відійшла на задній план. Проте чіпи можуть бути використані для повторного секвенирования вже відомих послідовностей. Зокрема, був ресеквенирован повний митохондриапьный геном довжиною 16,6 килобаз, мітохондріальний чіп містив 13600025-меров. Повна послідовність була прочитана з 99% точністю, що дозволяє здійснити однозначне визначення мітохондріальних мутацій. Швидкість така, що повна мітохондріальна послідовність генома може бути отримана за 12 мин. В даний час цей чіп використовується для вивчення вариабельности мітохондріальної ДНК в популяціях. Досліджується можлива роль мітохондріальних мутацій в нервологических захворюваннях. Зрозуміло, що можливі і інші застосування ресеквенирования для аналізу відомих ділянок генома.
Зокрема, мікрочіпи у вдосконаленому варіанті використовуватимуться в майбутньому для аналізу природи складних хвороб, який вимагає підходу повногенома.
Мікрочіпи принципово відкривають можливість порівняльного аналізу експресії практично всіх генів в різних клітках. З'являється шлях до дослідження впливу величезної різноманітності генетичних чинників і чинників навколишнього середовища на зміни експресії. Створюються передумови для аналізу тотальних змін експресії генома в різних типах кліток при хворобах. Це у свою чергу створює нові можливості для функціонального аналізу і діагностики.
У виробах, які промисловість випускає для нашого повсякденного ужитку, використовується близько 80 тисяч різних хімічних речовин. І, як не дивно, переважна більшість з них ніколи повністю не перевірялося на шкідливість. Відвіку всяку нову речовину перевіряють на тварин. Але справа ця морочлива, довга і дорога, та і захисники тварин, трапляється, сунуть палиці в колеса. Але найголовніше: дані, отримані на тварин, не завжди годяться для людей. Отже, стовідсоткової упевненості в нешкідливості тих або інших ліків, харчової добавки, косметичного засобу і інших речовин, за всього бажання, не виходить.
Вихід з положення обіцяє застосування методу, який пропонує новий науковий напрям, - токсикогеномика. Тваринні клітки в спеціальній пробірці входять в зіткнення з речовиною, що перевіряється. Власне, це навіть не клітки, а так звана ДНК-чіп. Вхідні в ДНК гени реагують на речовину: одні гени активізуються, інші, навпаки, вимикаються, і по цій генній реакції неважко визначити, нешкідлива речовина, чи ні.
Переваги нового методу очевидні - говорять його творці. Традиційні випробування речовин на тварин, можуть показати, що саме в них діє руйнівно на печінку, що викликає рак або приводить до природжених фізичних недоліків. Але чому це відбувається - залишиться загадкою. Вирішить її лише аналіз генної активності.
Новий метод може значно зменшити кількість піддослідних тварин - адже він, в основному, орієнтується на клітки. Правда, в окремих випадках генна активність перевіряється і на живих тваринах, буває також необхідно доповнити новий метод традиційним. Але, в цілому, тенденція тут клітинна. Ще один плюс в тому, що генна активність може сигналізувати про небезпеку задовго до появи її видимих симптомів, наприклад, до появи пухлини. Генетичний рівень чутливіше фізіологічного. Про швидкість методу порівняно з традиційною перевіркою на тварин, на думку його прихильників, і говорити не доводиться: ця перевага не потребує доказів.
Проте фармацевтичні і хімічні фірми відносяться до новинки із змішаним відчуттям. Їх представники говорять, що результати випробувань, проведених по генетичній методиці, можуть, як це ні парадоксально, бути тлумачать невірно або упереджено, ніж тут же скористаються захисники навколишнього середовища і почнуть добиватися введення заборони на цілком безневинний продукт. «Впровадження в практику ДНК-чіпа відкриє собою епоху нескінченних судових процесів, на яких творці нових речовин терпітимуть поразку за поразкою», - передбачають фахівці.
«Прискіпатися можна до всього, особливо, в наший області, - говорить Джозеф Сайна, токсиколог однієї з фармацевтичних фірм і редактор журналу «Молекулярна токсикологія». - Аби новий метод не поквапилися використовувати до того, як він буде доведений до досконалості - тоді помилок не уникнути. Помилкові тривоги поведуть до невиправданих заборон, а тривоги, що запізнилися, і зовсім скомпрометують нововведення».
З'ясувати, які гени активізуються від контакту з новою речовиною, за допомогою ДНК-чіпа нескладно. Коли ген, що складається з ДНК, стає активним, він створює молекулу РНК, яка повідомляє клітку, який саме білок їй належить виробити. Фіксуючи цю інформаційну РНК, учені бачать, які гени активізувалися.
ДНК-чіп є мікроскопічною пластинкою з скла або пластика, що містить тисячі генів. Як розрізнити, що на ній відбувається? Зазвичай інформаційна РНК з клітки знову перетворюється на ДНК, після чого забарвлюється фарбою, що світиться. Кожен шматочок цієї ДНК приліплюється до відповідної ДНК на чіпі, ця крапка світиться, як світяться і сотні інших. Так на чіпі виникає патерн, або малюнок генної активності.
Подібні чіпи вже широко застосовуються. Наприклад, в Боулдере розробляють спеціалізовані чіпи для онкології, де порівнюють генну активність в ракових і здорових клітках. Про генну активність як і раніше свідчитиме мозаїка крапок, що світяться.
Але чи можна тлумачити цю мозаїку однозначно? Адже гени в процесі роботи організму можуть включатися і вимикатися по найрізноманітніших причинах. У одному випадку на генній активності відіб'ється природна загибель кліток, в іншому - це буде реакція на нейтральну речовину. І так далі. «Безліч змін в активності генів не пов'язана з токсичністю, - указує Кріс Кортон з Інституту токсикології в Північній Кароліні. - Пригадаємо хоч би ген, що відає ферментом, що руйнує багато ліків і хімічні речовини. Цей ген включається від вуглекислого газу, від брюссельської капусти і ще, Бог знає від чого. Фармацевтичні фірми завжди побоюються його несподіваних реакцій».
Незважаючи на ці складнощі, учені випробовують новим методом сотні речовин з явною токсичністю, щоб поповнити базу генетичних даних, з якими можна буде порівнювати картину, що отримується від речовин з невідомими властивостями. У США почав працювати недавно організований Центр токсикогеномики, в завдання якого входять як фундаментальні дослідження, так і створення такої бази даних, якою могли б безоплатно користуватися всі, хто побажає.
Усвідомлюючи багато недосконалості нового методу, учені говорять, що, в принципі, він працює. Їм вдалося знайти цілком певні патерни для таких токсичних з'єднань, як руйнівники гормонів, канцерогени і небезпечні для печінки отрути. Фірма «Джонсон энд Джонсон» встановила, як поводилися гени, коли клітки печінки входили в контакт з сотнею різних токсичних речовин. Не знаючи, що це за речовини, комп'ютер зумів згрупувати їх за типом токсичності. Результати цієї роботи опубліковані в останньому випуску журналу «Токсикологічні науки». Інша фірма - «Беррінген Інгельхайм» - використовувала ДНК-чіп для визначення таких типів токсичності, які в звичайних умовах зажадали б тривалих досліджень кліток за допомогою електронного мікроскопа.
Цікаве і корисне дослідження провела фірма «Phase 1», з якою, до речі, співробітничає багато хто із згаданих фармацевтичних компаній. Вона виявила 260 генів, що проявляють специфічну активність у людей з алергією на Пеніцилін. Нерідко буває так, що при клінічних випробуваннях нових ліків, що пройшли перед цим перевірку на тварин, пацієнти страждають від побічних ефектів. Тепер, як говорить Спенсер Фар - розділ фірми «Phase 1», можна буде передбачати генетичну відповідь пацієнтів на нові ліки і не витрачати мільйони даремно. Фар переконаний, що у нового методу блискучі перспективи.
Розробляються і інші методи, що дозволяють кардинально поліпшити перевірку речовин тварин. Один з них, зокрема, пропонує генна інженерія. Крім того, токсикогеномика поки що дорога. Один ДНК-чіп коштує 1000 доларів. Правда, чіпи постійно дешевшатимуть.
Чіпи можуть і не відмітити небезпеку. Наприклад, побічний ефект від нових ліків може виникнути із-за його взаємодії з іншими ліками. Складні взаємодії речовин чіпи поки не уловлюють. Приводів для сумнівів в новому методі майже стільки ж, скільки і приводів для упевненості в його перевагах. Отже, обговорення перспектив токсикогеномики поки в самому розпалі.
Молекулярно – генетичні методи досліджень в судовій медицині. Прогрес молекулярно-біологічної науки відкрив нові шляхи вирішення проблеми судово-медичної ідентифікації особи, забезпечивши можливість виявлення ознак, що індивідуалізують особу, на рівні не фенотипа, а генетичної матриці - клітинної ДНК. Молекулярно-генетичні маркерні системи засновані на існуванні відмінностей в структурі ДНК (генів) у різних індивідуумів. Гомологичниє гени, тобто ті, що визначають формування однієї і тієї ж ознаки, наприклад, форму носа або колір очей, у різних людей можуть знаходитися в разных аллельных станах. На молекулярному рівні аллельные варіанти одного і того ж гена відрізняються невеликими змінами в структурі їх ДНК, конкретно, в послідовності нуклеотидов в полинуклеотидной ланцюзі. Можливі заміна одиничних нуклеотидов, так звані точковые заміни, або локальні перебудови, іменовані делециями і инсерциями - відповідно втрата або додавання невеликих ділянок ланцюгу. Такі незначні відмінності зрештою і визначають те, чим різні люди відрізняються один від одного: унікальне поєднання аллельных варіантів всіх генів забезпечує біологічну індивідуальність кожної людини.
Геном людини містить десятки тисяч генів і полягає із понад 3 млрд. нуклеотидных пар, при цьому молекули ДНК будь-яких двох людей (неродственников) відрізняються в середньому тільки одним нуклеотидом з кожних трьохсот-чотирьохсот. Але навіть такі відмінності, як правило, носять характер випадкових відхилень від якоїсь домінуючої норми. Теоретично це означає, що якщо у сотні чоловік проаналізувати фрагмент ДНК довжиною 300-400 нуклеотидов для одного і того ж середньостатистичного гена, то дев'яносто дев'ять чоловік цілком можуть виявитися невідмітними один від одного. Практичне значення для цілей генетичної індивідуалізації особи (як передумови для її ідентифікації) мають зовсім не будь-які гени, а тільки такі, у яких багато аллельных форм.
На практиці як маркери індивідуальності виступають мультиаллельные гипервариабельные гени (гипервариабельные генетичні локусы). Індивідуалізуючими характеристиками служать численні структурні варіанти таких локусов, які в різних поєднаннях присутні в ДНК різних індивідуумів. Відкриття на початку 1980-х років феномена локального генетичного гіперполіморфізму в лабораторії Р. Уайта в США і пізніше розробка А. Джеффрісом високоефективних молекулярних зондів типу ДНК мінісателіта надали нові, недосяжні раніше можливості для вирішення проблеми індивідуалізації людини і встановлення кровноспоріднених зв'язків.
Технології молекулярно – генетичній індивідуалізації. У судово-експертній практиці базовими молекулярно-генетичними технологіями визнані: аналіз поліморфізму (вариабельности) довжини рестриктазных фрагментів ДНК, аналіз поліморфізму довжини амплифицированных фрагментів ДНК і аналіз поліморфізму нуклеотидных послідовностей (сайт-полиморфизма) ДНК.
Аналіз поліморфізму довжини рестриктазных фрагментів ДНК. Велика частина варіацій в полинуклеотидной ланцюзі ДНК генома викликана точковыми нуклеотидными замінами і деякими іншими варіантами реорганізації нуклеотидных послідовностей - інверсіями, делециями і инсерциями. В результаті в молекулах ДНК з'являються нові або втрачаються ділянки дії (сайти) особливих ферментів, що існували раніше, - рестрикционных эндонуклеаз (рестриктаз), в яких вони розщеплюють полинуклеотидные ланцюги ДНК.

Ріс.52. Схема блот-гибридизациии фрагментів ДНК
Зліва - схема розташування на гомологичных хромосомах сусідніх ділянок пізнавання (аі і ai+i; bi і bi+i) два рестриктаз (I і II), зачорнена ділянка - область гомологии зонда; справа - схематична картина результату блот-гибридизации з даним зондом сумарної ДНК, гидролизованной рестриктазами I і II, обумовлює зміна довжини рестриктазных фрагментів ДНК, що виходять.
Фрагменти ДНК, що цікавлять, можна візуалізувати шляхом молекулярної гібридизації з відповідним зондом; даний метод добре відомий в молекулярній біології нуклеїнових кислот як блот-гибридизационный аналіз (мал. 52). З його допомогою поліморфні ділянки генома виявляються у вигляді тих, що мають різну довжину гомологичных фрагментів ДНК, яка утворюється після гідролізу ДНК генома рестриктазами. Цей феномен отримав назву поліморфізму довжини рестриктазных фрагментів (ПДРФ) ДНК.
Індивідуальний поліморфізм довжини рестриктазных фрагментів створює передумови для вирішення завдань, пов'язаних з індивідуалізацією організму і встановленням його біологічних споріднених зв'язків з іншими індивідуумами. Проте більшість поліморфних геномах локусов - потенційних генетичних маркерів - має тільки два варіанти: дикий тип/мутація, тобто є диморфними або диаллельными. Цінність диморфних маркерів невелика, тому що у багатьох людей може опинитися один і той же варіант такого гена. Тому, як вже указувалося, що індивідуалізує значення мають не будь-які, а тільки гипервариабельные поліморфні фрагменти.
Оскільки гипервариабельные локусы мультиаллельны, то інформативність маркерних систем на їх основі набагато вища, ніж інформативність систем (як правило, диаллельных), що базуються на одиничних нуклеотидных замінах. Теоретично можна припускати, що висока локальна генетична вариабельность викликана не стільки точковыми нуклеотидными мутаціями або микроделециями/инсерциями, скільки іншими механізмами, що приводять до істотнішої реорганізації послідовностей геномів: транспозиціями, нерівними або незаконними рекомбінаціями, прослизанням репликативного комплексу і тому подібне Як виявилось, такі локусы достатньо поширені в геномі людини.
Найбільш примітна з них ДНК «мінісателітів», вперше описані Джеффрісом. Це відносно короткі (10-60 нуклеотидных пара), розсіяні по геному, нуклеотидные послідовності, що повторюються, мають тандемну організацію і що демонструють різний ступінь внутрішньогрупової гомологии. Число тандемних повторів в блоках (і отже, довжина самих блоків) мінісателітів варіює в широких межах - від трьох-чотирьох до декількох тисяч; такі блоки представляють разные аллельные варіанти мультиаллельных генетичних локусов.
У 1987 р. І. Накамура запропонував називати такого роду генетичні елементи локусами з числом тандемних повторів (рис.53), що варіюється, або просто тандемними повторами із змінним числом ланок (загальноприйнята англійська абревіатура VNTR - Variable Number Tandem Repeat).
Варіації числа елементів, що повторюються, в VNTR-блоках якраз і обумовлюють структурний поліморфізм цих локусов, що виявляється у формі ПДРФ. Річ у тому, що довжина відповідних рестриктазных фрагментів, якщо відсутні ділянки розщеплювання усередині самих повторів, залежить від числа одиниць, що повторюються.
Мабуть, найбільш значуща властивість відкритих мінісателітів Джеффрісом - їх існування у вигляді сімейств, диспергированных по геному. Всі локусы кожного сімейства містять набори тандемних олигонуклеотидных послідовностей, що об'єднуються одним нуклеотидным «мотивом», або кор-последовательностью. Таким чином, крім мультиаллельности, тобто поліморфізму, обумовленого змінним числом елементів, що повторюються, в самих локусах, маркери мінісателітів

Ріс.53. Послідовності ДНК з числом тандемних повторів, що варіюється: вгорі - варіанти таких локусов А, Би, В і Г розрізняються по ширині на один сегмент, що повторюється, сайти рестрикції - мічені стрілками; внизу - схематична картина блот- гібридизації з молекулярним зондом, гомологичным ідейному повтору, деяких гетерозиготных по даному локусу ДНК.
характеризуються ще і «системним» поліморфізмом - можливістю одночасного виявлення аллельных варіантів відразу декілька (часто генетично не зчеплених між собою) локусов, що представляють одне сімейство. В результаті інформативність таких гіперполіморфних мультилокусных систем виявляється гранично високою, в принципі, достатньою для доказової індивідуалізації людини. В даний час невідоме загальне число сімейств гипервариабельных локусов в геномі людини, але, мабуть, воно достатньо велике; кожне з них потенційно є мультилокусную гипервариабельную системою з дуже високим індивідуалізуючим потенціалом.
Аналіз поліморфізму довжини амплифицированных фрагментів ДНК. Що не вимагає використання рестрикционных ферментів і що відрізняється надзвичайно високою чутливістю, подібний аналіз став можливим в результаті впровадження в практику методу так званої энзиматической ампліфікації гипервариабельных генетичних локусов за допомогою полимеразной ланцюгової реакції (ПЦР). Зараз області застосування цієї реакції, як у фундаментальній науці, так і в біотехнології такі різноманітні і численні, що важко їх навіть перерахувати. Головний же сенс цього відкриття в тому, що вдалося подолати всі обмеження молекулярно-генетичних методів дослідження, які були пов'язані з недостатньою для аналізу кількістю ДНК.
Полімерна ланцюгова реакція дозволяє виділити і розмножити будь-яку необхідну для аналізу послідовність ДНК в кількості, що перевищує початкове в десятки і навіть сотні мільйонів разів. Такий високий ступінь направленого збагачення теоретично дозволяє працювати з одиничними молекулами ДНК, отже, відкривається можливість молекулярно-генетичного типирования навіть у разі зникаюче малих кількостей доступного для експертизи біологічного матеріалу. Дійсно, ще в 1986 р. Джеффріс експериментально довів, що за допомогою ПЦР реальним стає завдання ідентифікації генома на рівні декількох або навіть однієї клітки. Крім того, ПЦР вельми ефективна при аналізі сильно зруйнованої ДНК, що піддалася високому ступеню деградації.
Метод энзиматической ампліфікації ДНК покладений в основу створення високоспецифічних діагностичних і індивідуалізуючих тест-систем. Всі вони розробляються за єдиним принципом, який полягає в підборі праймеров на відомій послідовності нуклеотидов ДНК (як правило, це олигонуклеотиды довжиною 20-25 нуклеотидов, які розташовуються по флангах високополіморфних мультиаллельных локусов) і оптимізації умов энзиматической ампліфікації вибраних генетичних локусов.
Як ми вже знаємо, гипервариабельные локусы VNTR-типа містять різне число елементарних ланок, що повторюються. При ампліфікації з праймерами, розташованими по краях такого локуса, утворюються фрагменти ДНК різної довжини, причому довжина фрагмента буде пропорційна числу повторів. Таким чином, в даній аналітичній системі будь-який індивідуальний зразок ДНК людини характеризується наявністю два амплифицированных фрагментів різної або однакової довжини (відповідно, гетерозиготное і гомозиготное стан), оскільки кожна з двох гомологичных хромосом несе свій варіант гипервариабельного локуса, який може відрізнятися від інших числом тандемних повторів, що містяться в нім. Цей феномен отримав назву поліморфізму довжини амплифицированных фрагментів (ПДАФ) ДНК.
Молекулярні копії амплифицируемого локуса ДНК накопичуються в реакційній суміші, унаслідок чого кількісно виявляються доступними для порівняльного аналізу. Далі отримані амплификационные продукти фракціонують за допомогою электрофореза в гелі агарозы або полиакриламида, фрагменти ДНК, амплифицированные в ході реакції, виявляють, використовуючи різні методи детекции. Власне ідентифікаційний аналіз ПДАФ хромосомної ДНК в цілому аналогічний монолокусному аналізу ПДРФ: поліморфні по довжині фрагменти, що представляють (як і у разі рестриктазных фрагментів в аналізі ПДРФ) разные аллельные варіанти гипервариабельных локусов, виступають як ознаки, що індивідуалізують особу.
Аналіз поліморфізму нуклеотидных послідовностей ДНК. Ми вже відзначали, що істотна частина варіацій в полинуклеотидных ланцюгах ДНК генома обумовлена точковыми нуклеотидными замінами: дуже багато локусы, у тому числі і високополіморфні, мають варіанти (аллели), які на молекулярному рівні однакові по довжині, але в тому або іншому ступені розрізняються послідовністю нуклеотидов. Це так званий сайт-поліморфізм (від англ. «site» - ділянка), який умовно можна позначити ППАФ, - поліморфізм послідовності амплифицированных фрагментів ДНК. Зрозуміло, що ампліфікація локусов ДНК, що володіє властивістю сайт-полиморфизма, приведе до утворення невиразних по довжині фрагментів. Диференціювати такі фрагменти за допомогою звичайних методів электрофореза неможливо, тому в індивідуалізуючих системах ППАФ-типа використовуються інші принципи диференціації аллельных варіантів.
Найбільш радикальний шлях - секвенирование амплифицированных фрагментів ДНК, тобто визначення первинної структури полинуклеотидной ланцюга. Теоретично це найточніший і доказовий метод аналізу індивідуальних генетичних варіацій, оскільки за своєю суттю секвенирование означає розшифровку генетичного коду, який в принципі унікальний для кожного організму. В даний час єдиною молекулярно-генетичною індивідуалізуючою системою, заснованою на секвенировании сайт-полиморфных амплифицированных фрагментів ДНК, є поліморфні локусы мітохондріальної ДНК (мтДНК).
Мітохондріальна ДНК людини (см.1.4) є кільцевою молекулою, яка має розмір 16 569 пар нуклеотидов і налічує всього 37 генів. Вона характеризується поряд унікальних біологічних властивостей: швидким темпом мутації і, як наслідок, високим рівнем мінливості, великим числом копій в кожній клітці, материнським характером спадкоємства і відсутністю рекомбінації. Ці властивості, що стали причиною широкого використання мтДНК в дослідженнях популяцій і еволюційних, роблять її високоінформативним, а в деяких випадках єдино застосовним інструментом і в судово-медичній практиці.
Можна використовувати мтДНК як генетичний маркер материнської лінії спадкоємства, і особливо успішно при встановленні спорідненості в тих випадках, коли генетична дистанція, що розділяє родичів, більше, ніж одне покоління. Тут аутосомные маркери не дають доказового результату, оскільки практично неможливо проаналізувати дуже велику кількість варіантів їх спадкоємства у ряді поколінь. Нуклеотідная ж послідовність мтДНК ідентична у всіх родичів, зв'язаних материнською лінією спорідненості (за винятком рідкісних мутаційних подій). З цієї причини для встановлення приналежності індивіда до конкретної генетичної лінії, а, отже, для його непрямої ідентифікації, можна використовувати порівняльний аналіз мтДНК будь-яких родичів індивіда по материнській лінії (сестра, бабця, дядько, племінник і так далі).
Аналіз мтДНК можливий, якщо для експертного дослідження доступні украй малі кількості біологічного матеріалу або ДНК, що міститься в зразку, сильно деградована і хромосомна ДНК не може бути амплифицирована. Мітохондріальна ДНК багато разів використовувалася для аналізу кісткових останків, вік яких обчислюється десятками, сотнями і навіть десятками тисяч років. Такі результати недосяжні для індивідуалізуючих систем, заснованих на аналізі однокопийных генів хромосомною ДНК.
Високий рівень мінливості мтДНК забезпечує широкий спектр індивідуалізуючих характеристик, а значить, і високий дискримінуючий потенціал даного методу. Оскільки мтДНК не схильна до рекомбінації, вона повинна розглядатися як єдиний локус. Кількість варіантів послідовності контрольного регіону мтДНК істотно перевищує кількість аллелей будь-якого, навіть самого поліморфного хромосомного маркера. Поліморфізм мтДНК такий високий, що іноді один лише його аналіз може забезпечити достатньо надійне підтвердження спорідненості.
Варіації в полинуклеотидных ланцюгах мтДНК обумовлені в основному точковыми нуклеотидными замінами - типовий поліморфізм послідовності ДНК. При типировании мтДНК в судово-експертних ідентифікаційних дослідженнях використовуються аналіз поліморфізму довжини рестриктазных і амплифицированных фрагментів (ПДРФ, ПДАФ), аналіз поліморфізму нуклеотидных послідовностей (ППАФ, SSO, гибридизационные мікроматриці) і аналіз конформаційного поліморфізму (SSCP, DGGE). Проте, слід зазначити, що з них практичне значення має тільки індивідуалізуюча система ППАФ-типа, в основі якої лежить секвенирование амплифицированных фрагментів ДНК, синтезованої на матриці мтДНК. Такий аналіз, що передбачає пряме секвенирование амплифицированного продукту, дає повну інформацію про первинну структуру досліджуваного фрагмента (рис.54).

Ріс.54. Виявлення нуклеотидных замін в мітохондріальній ДНК методом прямого флуоресцентного секвенирования
Ми вже говорили, що стосовно завдань судово-медичної експертизи молекулярно-генетичний ідентифікаційний аналіз найбільш ефективний в двох випадках: ідентифікація особи і встановлення біологічної спорідненості (у найбільш поширеному варіанті - експертиза спірного батьківства). Під ідентифікацією розуміється, по-перше, завдання експертизи у конкретній кримінальній або цивільній справі, і по-друге, власне процес і результат експертизи, який полягає у встановленні тотожності досліджуваних об'єктів (а у разі негативного результату - їх диференціації). Передумовою для ідентифікації об'єкту є його індивідуалізація: процес виявлення і оцінки ознак об'єкту, що володіють максимальною значущістю з погляду його неповторності, тобто відмінності від інших об'єктів. Ототожнення або диференціація здійснюються на підставі порівняльного аналізу сукупності індивідуалізуючих ознак ДНК, виявленої в ході ідентифікаційного дослідження.
Індивідуалізуючі системи на основі аналізу ПДАФ хромосомної ДНК. В даний час в світовій судово-експертній практиці застосовується декілька десятків молекулярно-генетичних ПДАФ-систем на основі поліморфних локусов.
Спадкоємство аллельных варіантів кожного поліморфного локуса відбувається за ядерним типом, тобто приблизно половина всіх маркерних елементів, складових локальний профіль генома кожної людини, веде початок від його отця, а інша половина - від матери. Такий характер спадкоємства обумовлений аутосомной локалізацією гипервариабельных локусов: кожен аллельный варіант успадковується як простій кодоминантный ознака Менделя.
Експертиза спірного батьківства, по суті, також є ідентифікаційним тестом. Проте на відміну від прямої судово-медичної ідентифікації особи ототожнення тут носить опосередкований характер. Якщо користуватися криміналістською термінологією, ознаки «створюючого» об'єкту (в даному випадку - батьківського індивідуума), використовувані з метою ідентифікації, відбиваються в «сприймаючому» об'єкті - дитині - не безпосередньо, як в біологічних слідах, а заломлюються через призму складних генетичних закономірностей. Знання і правильна оцінка цих закономірностей необхідні для адекватної інтерпретації результатів експертного дослідження.
Ідентифікаційний тест, направлений на дозвіл випадків оспорюваного батьківства, припускає порівняльний аналіз профілів геномів дитини, матери і передбачуваного отця. При цьому спочатку реєструють ті смуги у відбитку генома дитини, позиції яких співпадають з материнськими смугами, а смуги, що залишилися, у дитини зіставляють з профілем генома чоловіка. Якщо досліджуване тріо є дійсним біологічним сім'ю, всі нематеринські смуги дитини виявляться в профілі генома отця. У осоружному ж випадку частина смуг в локальних профілях геномів дитини виявиться «зайвою», тобто не знайде відповідності в профілях геномів заявлених батьків. Цей стандартний алгоритм рішення даної експертної задачі базується на закономірностях спадкоємства гипервариабельных локусов. Зокрема, спираючись на кодоминантный характер Менделя спадкоємства, можна вважати, що всі смуги, складові профіль генома дитини, повинні мати або батьківське, або материнське походження. Присутність у дитини сторонніх фрагментів служить підставою для виключення заявленого батьківства (за умови, що материнство розглядається як безперечне). У свою чергу, повну комплементарну відповідність профілів геномів дитини і заявлених батьків означає невиключення заявленої спорідненості.
Індивідуалізуюча система на основі аналізу ПДАФ мітохондріальної ДНК. Особлива цінність даного методичного підходу обумовлена тією обставиною, що у цілому ряді випадків для експертизи можуть бути недоступні ідентифікуючі об'єкти, які дозволили б прямо встановити індивідуалізуючі ознаки загиблих на рівні їх хромосомної ДНК. Залишається можливість тільки непрямій ідентифікації, наприклад, шляхом використання як ідентифікуючі об'єкти біологічних зразків, отриманих від родичів встановлюваних осіб. Проте в цих умовах рішення судово-медичної задачі ідентифікації за допомогою стандартного молекулярно-генетичного аналізу хромосомних маркерів стикається з серйозними труднощами.
Проблема в тому, що єдино можлива в таких обставинах схема непрямої, тобто опосередкованою через родичів, ідентифікації дає доказовий результат, якщо тільки як індивідуалізуючі елементи використовується достатньо велике число поліморфних хромосомних локусов. Крім того, часто доводиться аналізувати не близькоспоріднену вертикальну схему «батьки-діти», а дальшу, наприклад, «дед/бабка-внук» або «дядя/тетка-племянник» або ж горизонтальні схеми типу «брат-сестра» (у відсутність батьків). У цих випадках мова йде про достатньо віддаленій спорідненості і про більш варіантні схеми спадкоємства ядерних генів-ознак. Коли генетична дистанція, що розділяє родичів по вертикалі, перевищує одне покоління, або аналізуються горизонтальні схеми спорідненості, верифікація споріднених зв'язків за допомогою аналізу однієї лише хромосомної ДНК виявляється проблематичною.
Навпаки, типирование мітохондріальної ДНК, по суті, дозволяє виявляти споріднені зв'язки не близькоспоріднених, а так би мовити, трасуючих родовідних маркерів. Одним з перших і найбільш яскравих прикладів використання мітохондріальної ДНК в експертному дослідженні стала ідентифікація останків членів російської імператорської сім'ї. Дана експертиза поклала початок серії робіт, що заснованих на аналізі мтДНК і проливають світло на історичні події минулого.
Така, наприклад, експертиза передбачуваних останків нацистського злочинця Мартіна Бормана. Впродовж багатьох років була поширена легенда про те, що Борману вдалося залишитися в живих і після закінчення війни покинути Німеччину. У 1972 р. в ході будівельних робіт були виявлені кісткові останки, які по ряду непрямих ознак могли належати Борману. Для остаточного припинення спекуляцій було проведено дослідження мтДНК кісткових останків, яке виявило повний збіг з мтДНК матрилинейных родичів Бормана, що нині живуть. Такий збіг з великою вірогідністю підтвердив приналежність кісткових останків історичній фігурі.
До подій дальшого минулого відноситься експертиза передбачуваних останків принца Луї XVII. Згідно офіційної історії, 10-річний син Луї XVI і Марії-Антуанети помер в паризькій в'язниці в 1795 р. Проте численні чутки свідчили про чудовий порятунок принца. Виявилися навіть люди, що оголосили себе врятованим Луї XVII. Одним з них був Карл Вільгельм Наундорф, похований в 1845 р. в Нідерландах як Луї XVII. Для з'ясування історичної істини був проведений порівняльний аналіз мтДНК останків Наундорфа і родичів Марії-Антуанети, що нині живуть, і паралельно - аналіз мтДНК серця хлопчика, що помер в 1795 р. в паризькій в'язниці, що збереглося. Дослідження виключила спорідненість Наундорфа з родичами Марії-Антуанети (а, отже, і його права спадкоємця), оскільки виявило відмінності в їх мтДНК, і встановило збіг нуклеотидных послідовностей мтДНК серця і матрилинейных родичів Луї XVII, тим самим підтвердивши офіційну версію історичних подій.
