
- •Передмова
- •Частина 1. Молекулярні основи спадковості
- •Введення в молекулярну біологію.
- •1.2. Макромолекули як обьекты вивчення молекулярної біології
- •1.2.2. Будова, функції і властивості днк.
- •Молекулярна організація генів.
- •Рнк і її роль в збереженні і реалізації спадкової інформації.
- •Лікарські засоби, що впливають на синтез нуклеїнових кислот і білків.
- •1.3. Експресія генів і її регуляція
- •1.4. Організація геномів неклітинних і клітинних організмів
- •Геном бактерій
- •Організація генома эукариот.
- •Частина 2. Молекулярні основи спадкових захворювань
- •2.1. Молекулярні механізми генних, хромосомних і геномів мутацій
- •2.2. Регуляція клітинного циклу. Апоптоз. Онкогенетика.
- •Частина 3. Сучасні питання генних технологій
- •3.1 Дослідження нуклеїнових кислот. Методи днк-діагностики
- •3.2 Методи генної інженерії
- •3.3 Клонування організмів і кліток.
- •Додатки контрольно-повчальні питання
- •Відповіді на контрольному – повчальні питання
- •Термінологічний словник
- •Література
Геном бактерій
Генетична система бактерій має, принаймні, чотири особливості, властиві тільки цим організмам.
1. Хромосоми бактерій (і, відповідно, плазмид) розташовуються вільно в цитоплазмі, не відмежовані від неї ніякими мембранами, але пов'язані з певними рецепторами на мембрані цитоплазми. Оскільки довжина хромосоми (у Е.соli біля 1мм) у багато разів перевищує довжину бактерійної клітки (1,5—3,0 мкм в середньому), хромосома особливим компактним чином в ній упакована; молекула хромосомної ДНК знаходиться у формі, що суперспіралізує, і згорнута у вигляді петель, число яких складає 12—80 на хромосому. Петлі в центрі нуклеоида об'єднуються за рахунок пов'язання ДНК з серцевинною структурою, представленою молекулами особливого класу РНК, — 4,5S РНК. Така впорядкована упаковка забезпечує постійну транскрипцію окремих оперонів хромосоми і не перешкоджає її реплікації. Можливо, що петлі упакованої хромосоми сприяють компартментализации рибосом.
2. Хоча бактерії є гаплоидными організмами, тобто мають один набір генів, зміст ДНК у них непостійно, воно може за сприятливих умов досягати значень, еквівалентних по масі 2, 4, 6 і навіть 8 хромосомам. У всіх інших живих істот зміст ДНК постійний, і воно подвоюється (окрім вірусів і плазмид) перед діленням.
3. У бактерій в природних умовах передача генетичній інформації відбувається не тільки по вертикалі, тобто від батьківської клітки дочерним, але і по горизонталі за допомогою різних механізмів: кон'югації, сексдукции, трансдукции, трансформації.
4. У бактерій дуже часто крім хромосомного генома є додатковий плазмидный геном, що наділяє їх важливими біологічними властивостями, нерідко — специфічним (придбаним) імунітетом до різних антибіотиків і інших хіміопрепаратів.
Зміст ДНК у бактерій залежить від умов їх зростання: за сприятливих умов воно зростає до величин, відповідних масі декількох хромосом. Це унікальна властивість бактерійного генома. Біологічне значення його полягає в тому, що, регулюючи зміст копій своїх генів (а воно визначатиметься кількістю копій хромосом, що синтезуються), бактерії одночасно пристосовують швидкість свого розмноження стосовно умов зростання. Разом із збільшенням змісту ДНК у бактерій в цьому випадку істотно зростає і кількість рибосом.
Завдяки цьому створюються необхідні умови для транскрипції і трансляції (а у бактерій вони відбуваються одночасно) декількох копій генів одночасно, зростає сумарна швидкість біосинтезу всіх субклітинних і клітинних структур і, відповідно, швидкість розмноження бактерій. Час клітинного циклу бактерій скорочується від декількох годинників до 20-30 мин. Швидкість розмноження визначає можливість накопичення в навколишньому середовищі великого запасу кліток даного вигляду. Це і є причиною того, що бактерії існують в природі багато мільйонів років. Можливість регулювати швидкість власного розмноження — одна з головних умов, що забезпечують виживання бактерій в навколишньому середовищі, а, отже, і збереження вигляду в природі.
Найменша вільноживуча клітка – Mycoplasma, складається з цитоплазми, оточеною елементарною мембраною, завтовшки 75 А. Клетка містить менше 109 атомів (не рахуючи води), генома (ДНК завдовжки 2,28мм), 400 рибосом. Маса білка біля 5,10-15гр., що еквівалентне 60 000 білкових молекул з молекулярною вагою 50 000 кожна.
Табл.5. Мінімальний (256) набір генів, необхідний живій клітині
-
Функція білків
Число білків
Перетворення енергії
28
Транспорт і метаболізм амінокислот
11
Транспорт і метаболізм нуклеотидов
20
Транспорт і метаболізм вуглеводів
5
Метаболізм ліпідів
6
Метаболізм кофакторов
8
Біогенез рибосом і трансляція
94
Реплікація, рекомбінація, репарація, транскрипція
35
Структурна функція
7
Секреція і адгезія
5
Шаперони
13
Транспорт неорганічних іонів
4
Передбачена гіпотетична функція
15
Функція невідома
4
Порівняння наборів генів M. genitalium і H. Influenzae дозволило встановити мінімальний набір генів, необхідний живій клітині (табл. 5).
Все, що бактерія уміє робити кодується її генетичним апаратом. Тобто сприйняття сигналів із зовнішнього середовища залежить від того, які рецептори знаходяться на мембрані клітки, а рецептори кодуються бактерійній ДНК. На прикладі кишкової палички розглянемо, як влаштований геном бактерії. У кишкової палички двуцепочечная ДНК замкнута в кільце. Це кільцева молекула пар нуклеотидов, що складаються з 4,6 млн., що відповідає молекулярній масі 3 х 106 Так. Довжина молекули складає порядка 1.5 мм. Час реплікації цієї молекули 20 мин. Є бактерії, які розмножуються повільніше, ніж кишкова паличка.
Структура бактерійної ДНК як кільце була запропонована в 1956 році Жакобом і Вольманом. Це було революційне припущення, оскільки до цього вважалася, що ДНК лінійна. Але революція в поглядах відбулася ще раз, коли з'ясувалося, що геном бактерії може бути представлений як кільцевою, так і лінійною молекулою ДНК (табл.6). Окрім основної молекули ДНК у неї можуть зустрічатися (а можуть бути і відсутніми) плазмиды – невелика (3-5 тисяч нуклеотидов) кільцева або лінійна ДНК, що часто несе гени стійкості до антибіотиків і інші необов'язкові системи. Саме із-за наявності плазмид (а вони здатні передаватися горизонтально від клітки до клітки, навіть між бактеріями різних видів), розповсюдження стійкості до антибіотиків відбувається дуже швидко між всіма бактеріями, що живуть в одному місці.
Таким чином, до складу генома бактерій можуть входити як кільцеві, так і лінійні молекули ДНК. І геном може складатися з однієї або з декількох молекул ДНК, званої хромосомами або плазмидами. Якщо гени, які міститися на додатковій молекулі, необхідні клітці, то ця молекула називається мініхромосомою, а якщо без них клітка може обійтися – те плазмидой.
Розміри молекул ДНК указують в парах підстав, п.н. або bp (base pairs). Для великих фрагментів використовують т.п.н. або kb (kilo base)=103 bp і Mb (mega base)= 106 bp. Геноми бактерій - від 0.58 Mb у Micoplasma genitalium до 9.5 Mb у Myxococcus xanthus

Табл.6. Геноми деяких бактерій
Метод визначення послідовності нуклеотидов, або секвенирование, був розроблений в 70-х роках. Дві групи учених незалежно один від одного розробляли ці методи. Один з них був розроблений Сенгером, другий, – Максамом і Гілбертом, і всі вони отримали в 1980 році Нобелівську премію. До цих пір створені ними принципи використовуються при секвенировании, що зараз вже проводиться не уручну, а автоматами.
У 1995 році був прочитаний перший відносно невеликий геном бактерії Haemophilus influenzae. Це було величезним досягненням, дуже великою сенсацією. До цього вдавалося визначити повністю тільки геноми вірусів, які на порядок менше геномів бактерій. На справжній момент повністю прочитані геноми більше 100 видів бактерій, серед яких представники таких пологів патогенних бактерій, як Streptococcus, Staphylococcus, Corynebacterium, Yersinia і ін. У табл.7 приведені деякі приклади розшифрованих геномів бактерій.
Як показали дослідження геномів, патогенні бактерії вельми різноманітні по комбінаториці генів, що визначають патогенність. У них є специфічні гени, контролюючі синтез чинників вірулентності (адгезины, инвазины, порины, токсини, гемолизины). Більшість таких генів зібрана в кластери («острівці патогенності»). Вони можуть бути локалізовані в хромосомі бактерії або в плазмидах.
«Острівці патогенності» беруть участь в перебудовах геномів, що і визначає пристосовність і широку внутрішньовидову вариабельность бактерій. Оскільки геноми бактерій невеликі (від 100 000 до 4 млн пар нуклеотидов), багато що вдалося вже зробити в області функціональної геномики. І структурні, і функціональні дослідження геномів патогенних бактерій
Табл.7. Деякі патогенні бактерії, геноми яких секвенированы
Бактерія (штам) |
Хвороба |
Розмір генома п.н. |
Mycoplasma pneumoniae |
Пневмонія |
816 |
Mycobacterium tuberculosis |
Туберкульоз |
4411 |
Neisseria meningitidis |
Менінгіт |
2272 |
Vibrio cholerae (El-Tor) |
Холера |
4033 |
Helicobacter pylori |
Гастрит, виразкова хвороба |
1667 |
Treponema pallidum |
Сифіліс |
1138 |
Chlamidia trachomatis |
Трахома |
106 |
Hemophilus influenzae |
Отити, ОРЗ |
1830 |
показують їх високу пластичність. Ці уявлення мають безпосереднє практичне значення, по-перше, для розробки експрес-методів типирования бактерій і оцінки риски бактерійної контамінації; по-друге, для створення ліків, націлених на специфічні мішені, блокуючі роботу генів патогенності; по-третє, для більш цілеспрямованого створення вакцин.
Зараз можна дуже багато що дізнатися про невідому бактерію, якщо прочитати її геном. По тому, які гени входять до складу генома, можна визначити, який спосіб життя веде бактерія. Це важливо для збудників різних захворювань – по складу їх генів можна встановити, до яких речовин вони чутливі, і точно підібрати ліки або створити новий ефективний препарат для лікування. Наприклад, розмір генома паразитичної бактерії мікоплазми (Mycoplasma genitalium) – 580000 пар нуклеотидов. 90% її генома кодує білки, 10% містять регуляторні послідовності білків, тобто білки не кодує. У неї 468 генів (це можна з точністю визначити по нуклеотидной послідовності генома) і найвищий відсоток кодуючих послідовностей. Вона живе в постійних умовах усередині клітки, їй мало, що потрібно регулювати. У інших бактерій велику частку займають кодуючі білки, а у людини, в порівнянні з бактеріями, що кодують білки займають набагато меншу частину генома (2%). В принципі, це відповідає розвитку суспільства: все меншу частину займає виробництво, і все велику частину займає сервіс і інформаційні технології. Різна кількість генів відповідає за разные клітинні фукнции (рис.28).
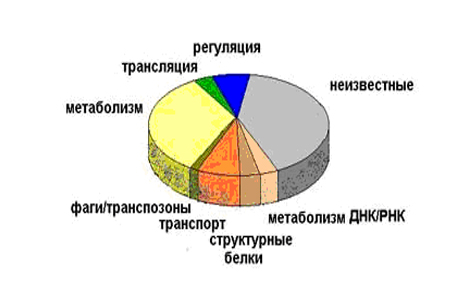
Ріс.28. Розподіл функцій генів Е.cоli, виявлене по повній нуклеотидной послідовності генома
Що означають відмінності в кількості кластерів рибосомной РНК? Кишкова паличка ділиться раз в двадцять хвилин, туберкульозна мікобактерія ділиться раз на добу. До речі, це представляє труднощі в діагности туберкульозу (для того, щоб виділити з мокроти хворого цю бактерію, необхідно її вирощувати тижнями, щоб там щось можна було проаналізувати). Через те, що вона так поволі росте, їй не потрібно активно синтезувати рибосомы, тому у неї менше генів, потрібних для синтезу рибосом (у 10 разів менше, ніж у що вільно живе і активно Bacillius subtilis, що росте).
У геномі бактерій можуть бути присутніми гени, схожі по нуклеотидной послідовності. Такі гени називаються гомологичными (гомо - однаковий). Гомологичниє гени можуть з'явитися в геномі в результаті подвоєння (дупликации) одного гена. В цьому випадку їх називають паралоги. За наявності в геномі декілька гомологичных генів вони можуть придбати різні функції.
Деякі гени, схожі по будові, але що трохи відрізняються по функціях, мають великі копийность в геномі. Копійность генів пов'язана із способом життя бактерій. Це можна порівняти, наприклад, з мовою. Так, у народів, що займаються скотарством, кінь має безліч назв (не як у нас: кінь, лоша, мерин, а безліч назв для коней різного призначення і різного віку); у ескімосів багато слів, що позначають сніг. Також, в геномі бактерій многокопийны ті гени, які важливі для життя бактерій. Говорять, це ті гени, які обуславливают екологічну специфічність.
Яким же чином, геноми бактерій міняються в процесі еволюції? Всі зміни можна класифікувати на п'ять груп: точкові заміни (заміни однієї «букви» на іншу), дупликации і ампліфікація (копіювання ділянок генома), делеции (випадання ділянок генома), інверсії і транслокации (перестановка ділянки гена в іншу частину генома або зміну його орієнтації в геномі), горизонтальне перенесення генів (фрагмент ДНК переноситься з однієї бактерії в іншу).
Плазміди. Вперше виявлені у E.coli генетичні елементи, які передавалися у неї по спадку у внехромосомном стані, отримали назву просто генетичних чинників. Раніше всього були виявлені Со1-фактор (чинник, контролюючий у E.coli синтез бактерицидних білків, А. Грациа, 1925) і F-фактор (чинник, контролюючий примітивний статевий процес у бактерій, — кон'югацію, У. Хейс, 1953). Інтерес до цих чинників сильно зріс після того, як в 1963г. японський учений Т. Ватанабе повідомив, що передача множинній лікарській стійкості у дизентерійних бактерій відбувається також за участю незалежних від хромосоми генетичних елементів, названих R-факторами (від англ. resistanсе — стійкість). У 1976г. всім подібного роду генетичним елементам було дано назву плазмид і наступне визначення: «Плазміда (екстрахромосомний генетичний елемент) є репликон, який стабільно успадковується в екстрахромосомному стані».
Особливості плазмид.
Геном плазмид представлений тільки двунитевой ДНК.
Розмноження плазмид відбувається шляхом саморепликации їх ДНК і не вимагає синтезу структурних білків і процесів самосборки.
Місцем існування плазмид є тільки бактерії.
Плазміди володіють системами генів, які наділяють їх здібністю до самопереносу або до мобілізації на перенесення з клітки в клітку.
Плазміди проникаючи в бактерійну клітку, не розмножуються в ній безконтрольно і не пригнічують функції бактерійної хромосоми, а співіснують з нею і самі контролюють утворення числа можливих своїх копій на хромосому клітки. На відміну від вірусів, плазмиды не тільки не викликають загибелі кліток, які є для них природним місцем існування, а, навпаки, дуже часто наділяють їх важливими додатковими (селективними) властивостями. Це основне принципове важлива біологічна відмінність між плазмидами і вірусами. Плазміди своєю присутністю забезпечують розмноження бактерій в несприятливих для них умовах (наприклад, у присутності хіміопрепаратів) і, рятуючи від загибелі бактерії, забезпечують власне існування.
Відповідно до тих властивостей, якими плазмиды наділяють своїх носіїв, їх підрозділяють на різні категорії (табл.8):
У бактерій дуже часто виявляють криптические плазмиды, тобто плазмиды, функції яких ще не встановлені. Тому класифікація їх, поза сумнівом, уточнюватиметься. Вже зараз відомі плазмиды, контролюючі різні чинники патогенності бактерій (чинники адгезії, інвазії і т. п.).
Табліца.8. Класифікація плазмид по властивостях, якими вони наділяють своїх носіїв
-
Категорії
Властивості
F - плазмиды
Донорниє функції
R - плазмиды
Стійкість до лікарських препаратів
Сol - плазмиды
Синтез колицинов
Ent - плазмиды
Синтез ентеротоксинів
Hly - плазмиды
Синтез гемолизинов
Біодеградатівниє плазмиды
Руйнування різних органічних і неорганічних сполук, зокрема що містять важкі метали
Кріптічеськие плазмиды
Не відомі
Плазміди розповсюджуються серед бактерій двома способами: шляхом передачі від батьківської клітки дочерним кліткам в процесі клітинного ділення, тобто по вертикалі, і шляхом перенесення між клітками в популяції бактерій незалежно від клітинного ділення, тобто по горизонталі. Існує декілька генетичних механізмів перенесення плазмид між бактерійними клітками:
а) шляхом трансформації;
б) за допомогою трансдуцирующих фагов;
в) шляхом мобілізації на перенесення за допомогою конъюгативных плазмид.
Медичне і загальнобіологічне значення плазмид. Значення плазмид для медицини полягає в тому, що вони контролюють синтез різних чинників патогенності у багатьох видів бактерій, зокрема у збудників чуми, сибірської виразки, иерсиниозов. дизентерія, эшерихиозов і ін. Не викликає сумніву, що виникнення диареегенных кишкових паличок (энтеротоксигенных, энтеропатогенных, энтероинвазивных і ін.) є наслідком придбання ними плазмид, які наділяють їх чинниками адгезії, інвазії і здатністю синтезувати термолабільні і термостабільні ентеротоксини. Наявність в природі таких плазмид (особливо з широким довкола господарів) може стати реальною причиною утворення нових варіантів патогенних бактерій.
Не менш важливу роль грають R-плазмиды. В умовах широкого застосування антибіотиків і інших хіміопрепаратів відбувається природний відбір тих штамів патогенних бактерій, які є носіями R-плазмид. Серед них формуються нові епідемічні клони патогенних бактерій. В даний час вони грають провідну роль в епідеміології інфекційних хвороб, і від їх розповсюдження багато в чому залежить ефективність антибиотикo- і хіміотерапії, а у результаті — здоров'я і життя людей.
Загальнобіологічне значення плазмид полягає в тому, що вони виконують, принаймні, три найважливіші функції для бактерій, забезпечуючи одночасно існування, як бактерій, так і власне. По-перше, вони контролюють у бактерій обмін генетичним матеріалом. По-друге, контролюючи синтез чинників патогенності, вони обумовлюють сприятливі можливості для розмноження патогенних бактерій в природних для них умовах (у організмі тварини і людини), а, отже, для збереження цих видів в природі. По-третє, плазмиды є унікальним біологічним засобом самозахисту бактерій, оскільки вони забезпечують їх придбаним і успадкованим специфічним імунітетом проти різних хімічних (лікарських і інших речовин) і інших агентів.
Таким чином, плазмиды зберігаються в природі завдяки взаємовигідним відносинам, що склалися між ними і бактеріями. Бактерії для них — природне місце існування, а вони для бактерій — додаткові вільно циркулюючі між ними геноми з наборами таких генів, які сприяють збереженню бактерій в природі.
У бактерій виявлено три типи генів, що здійснюють контроль синтезу чинників патогенності: гени власної хромосоми; гени, привнесені плазмидами; гени, привнесені помірними конвертуючими фагами. Наприклад, синтез холерогена у Vibrio cholerae здійснюється генами tох-оперона власної хромосоми. Синтез екзотоксинів і чинників адгезії у энтеротоксигенных штамів Esherichia coli здійснюється генами, привнесеними Еnt-плазмидами. Синтез эксфолиативного токсину типу А у стафілококів контролюється хромосомним геном, а типу В — плазмидным геном; синтез екзотоксину у Corynebacterium diphtheriae — привнесеними tох-генами коринефага.
Наявність в світі мікробів додаткових джерел генів патогенності, носіями яких виявилися віруси і плазмиды, поза сумнівом, з'явилася одним з чинників виникнення бактерій патогенних для людини і тварин.
Лікарська стійкість бактерій. Існують два типи лікарської стійкості бактерій: природна, або природна, і придбана.
Природна лікарська стійкість є видовою ознакою. Вона властива всім представникам даного вигляду і не залежить від первинного контакту (контактів) з даним антибіотиком, в її основі немає ніяких специфічних механізмів. Найчастіше ця резистентність пов'язана з недоступністю мішеней для даного антибіотика, обумовленою дуже слабкою проникністю клітинної стінки і мембрани цитоплазми, або якими-небудь іншими причинами. Якщо низька проникність існує до декількох антибіотиків, то вона обумовлюватиме полирезистентность таких бактерій. Придбана лікарська стійкість виникає у окремих представників даного виду бактерій тільки в результаті зміни її генома. Можливі два варіанти генетичних змін. Один з них пов'язаний з мутаціями в тих або інших генах бактерійної хромосоми, унаслідок яких продукт гена, що атакується, перестає бути мішенню для даного антибіотика. Це відбувається або унаслідок зміни структури білка, або тому, що він стає недоступним для антибіотика.
У іншому випадку бактерії стають стійкими до антибіотика або навіть відразу до декількох антибіотиків завдяки придбанню додаткових генів, носіями яких є R-плазмиды. Ніяких інших механізмів придбаної лікарської стійкості не існує. Проте, набуваючи стійкості до антибіотика, а тим більше відразу до декількох антибіотиків, такі бактерії отримують наивыгоднейшие переваги: завдяки селективному тиску антибіотиків відбувається витіснення чутливих до них штамів даного вигляду, а антибиотикоустойчивые варіанти виживають і починають грати головну роль в епідеміології даного захворювання. Саме вони і стають джерелами формування тих клонів бактерій, які забезпечують епідемічне розповсюдження збудника. Вирішальну роль в розповсюдженні лікарської стійкості, зокрема множинною, грають R-плазмиды завдяки здатності їх до самопереносу.
Біохімічні основи антибиотикорезистентности. Можна виділити наступні п'ять біохімічних механізмів формування резистентності.
Руйнування молекули антибіотика. Такий механізм лежить, головним чином, в основі формування стійкості до бета-лактамным антибіотиків.
Модифікація структури молекули антибіотика, в результаті якої втрачається її біологічна активність. Гени, що містяться в R-плазмидах, кодують білки, які викликають різні модифікації молекул антибіотика шляхом їх ацетилювання, фосфорилування або аденилирования. Саме таким шляхом инактивируются аминогликозиды, макроліди, хлорамфеникол, клиндамицин і інші антибіотики.
Зміна структури чутливих до дії антибіотиків мішеней. Зміна структури білків рибосом 70S лежить в основі стійкості до стрептоміцину, аминогликозидам, макролідам, тетрацикліну і іншим антибіотикам. Зміна структури бактерійних гираз в результаті мутації приводить до формування стійкості до хінолонів; РНК-полімераз — до рифампицину; пенициллинсвязывающих білків (транспептидаз) — до бета-лактамам і тому подібне
Освіта бактеріями «обхідного» шляху метаболізму для біосинтезу білка-мішені, який виявляється нечутливим до даного хіміопрепарату, — механізм, який лежить в основі резистентності до сульфаниламидным препаратів.
Формування механізму активного виведення з клітки антибіотика, внаслідок чого він не встигає досягти своєї мішені (один з варіантів стійкості до тетрацикліну).
Незвичайний механізм стійкості до изониазиду виявлений у M.tuberculosis. Дія изониазида на туберкульозну паличку залежить від наявності у останньої плазмиды, у складі якої є особливий ген. Продукт цього гена перетворює неактивний изониазид в активну форму, яка руйнує бактерійну клітку. Втрата цього гена обумовлює стійкість M.tuberculosis до изониазиду.
В деяких випадках инактивацию антибіотиків, яка лежить в основі резистентності до них, бактерії можуть здійснювати різними механізмами. Так, наприклад, існує три механізми, відповідальних за формування стійкості до бета-лактамным антибіотиків: слабка проникність зовнішньої мембрани клітинної стінки грамотрицательных бактерій, що забезпечує природну стійкість; зміна структури пенициллинсвязывающих білків в результаті мутацій, яке приводить до втрати їх спорідненості до антибіотика; продукція бета-лактамаз, що руйнують антибіотик.
Існує три типи стійкості і до тетрацикліну: 1) стійкість, визначувана винесенням тетрацикліну з клітки білком мембрани цитоплазми; 2) стійкість, визначувана зміною структури білка-мішені рибосом; 3) стійкість, визначувана модифікацією тетрацикліну в неактивну форму.
Можливо, у бактерій існують і інші механізми формування стійкості до лікарських препаратів.
Таким чином, у відповідь на могутній натиск, який зробив чоловік на бактерії за допомогою антибіотиків, вони відповіли унікальними біологічними реакціями, сила яких не поступається силі атаки. На кожен новий антибіотик бактерії давали адекватну відповідь: з'являлися резистентні до нього штами, які і зводили нанівець біологічну активність цього препарату. Так було і так буде завжди. З цим не можна не вважатися і цього не можна не враховувати. Тому слід передбачати шляхи постійного подолання цієї перешкоди, бо поки існують інфекційні хвороби, їх треба уміти ефективно лікувати.
Виникає питання: які можливості і шляхи утворення лікарської стійкості у бактерій? Оскільки вони опосередкують тільки на генетичному рівні, то виникає і інше питання: звідки з'являються нові гени лікарської стійкості? Стійкість, що виникає як наслідок мутації, з'ясовна і зрозуміла, але не вона грає основну роль. Основна роль належить генам, які містяться в R-плазмидах. Адже вони не можуть виникати відразу, de novo, це виключено. Отже, в природі повинен існувати своєрідний фонд генів лікарської стійкості, звідки бактерії можуть постійно «захоплювати» ті гени, які необхідні для них в даній ситуації. Найймовірніше, що такий генофонд утворюється за рахунок генів, що є у продуцентів антибіотиків. Кожен з них захищений від антибіотика, що синтезується ним. Цей самозахист контролюється відповідним геном. Отже, скільки б ні було в природі антибіотиків, проти кожного з них повинен бути і ген самозахисту, ген стійкості до цього антибіотика. У природі, особливо в грунті, а також в кишечнику людини і тварин мікроорганізми співіснують в таких тісних взаєминах, що це забезпечує ним постійну можливість обміну генетичним матеріалом за допомогою різних механізмів, зокрема за допомогою кон'югації. Оскільки багато генів лікарської стійкості несуть в собі елементи, що транспонуються, то це забезпечує ним можливість до великої мобільності. Вони можуть переміщатися усередині хромосоми, переходити з хромосом в плазмиды, формувати нові варіанти плазмид і піддаватися іншим перетворенням.
Таким чином, обмін генами лікарської стійкості між мікроорганізмами в природних умовах, очевидно, цілком можливий. Вирішальну роль в їх розповсюдженні серед збудників інфекційних захворювань людини і тварин починає грати вже сам антибіотик. Життя показало, що раніше всього гени лікарської стійкості до кожного нового антибіотика з'являються у клінічних штамів, а потім починається їх подальша циркуляція в природі. Володіючи певною мобільністю, ці гени самі піддаються модифікації, мутаціям, а в результаті утворюють групи, сімейства генів, що визначають стійкість до різних варіантів модифікованого антибіотика. Хоча багато що ще доведеться вивчити в цьому плані, але загальна тенденція і масштаби розвитку у бактерій лікарської стійкості вже цілком з'ясовні.
