
- •Ответы на билеты по ксе.
- •Естествознание как отрасль научного познания
- •Понятие науки и критерии научности.
- •Классификации наук
- •Роль естествознания в современной культуре.
- •Естественнонаучные знания Древнего Востока
- •Первые цивилизации и предпосылки возникновения научных знаний.
- •Характерные черты восточной преднауки.
- •Достижения народов Древнего Египта, Месопотамии, Индии, Китая в математике, астрономии, химии, медицине.
- •Античное естествознание. Физика
- •Ранняя греческая натурфилософия: милетская школа, пифагорейцы, атомистика Демокрита.
- •Учение о материи и теория движения Аристотеля.
- •Статика и гидростатика Архимеда (понятия центра тяжести, теория рычага, закон плавания тел).
- •Оптика Евклида
- •Античное естествознание. Астрономия
- •Работы Гиппарха: теория движения Солнца и Луны, открытие прецессии, метод параллакса, классификация и каталогизация звезд.
- •Геоцентрическая теория движения планет Птолемея: постулаты, математический аппарат, историческое значение.
- •Естествознание в эпоху Средневековья
- •Достижения арабов в математике, астрономии, оптике, медицине (Аль-Бируни, Авиценна и другие).
- •Университетская наука Западной Европы.
- •Зарождение экспериментального метода (Оксфордская школа).
- •Анализ механического движения (Парижская школа).
- •Арабская и европейская алхимия: теория и практика.
- •Естествознание в эпоху Возрождения
- •Ренессансный переворот в мировоззрении.
- •Великие географические открытия и развитие наук о Земле.
- •Революция в астрономии: гелиоцентрическая теория Коперника и её историческое значение.
- •Математика и механика (Тарталья и другие).
- •Науки о живом: анатомия, медицина, биология (Везалий, Парацельс и другие).
- •Естествознание XVII века. Механика
- •Понятие инерциальной системы отсчета. Принципы инерции, относительности и суперпозиции.
- •Законы падения тел и колебания маятника.
- •Работы Ньютона: 1-й, 2-й, 3-й законы динамики.
- •Закон всемирного тяготения и принцип дальнодействия.
- •Естествознание XVII века. Астрономия
- •Возникновение оптической астрономии и открытия Галилея.
- •Борьба за утверждение гелиоцентризма
- •Небесная механика Ньютона: анализ центростремительного ускорения Луны, 1-я и 2-я космические скорости, траектории движения спутников.
- •Естествознание XVIII века. Физика и астрономия
- •Развитие принципов механицизма: флюидные теории теплоты, электричества, магнетизма.
- •Оптика: корпускулярная и волновая теории света.
- •Электростатика и гальваника (Франклин, Кулон, Вольта).
- •Звездная и галактическая астрономия (Гершель).
- •Небулярная теория Канта-Лапласа.
- •Естествознание XVII-XVIII веков. Химия и биология
- •Становление научной химии в работах Бойля и Лавуазье.
- •Проблема горения: флогистонная и кислородная теории.
- •Естествознание XIX века. Термодинамика
- •Теория тепловых машин Карно, понятие кпд.
- •Открытие закона сохранения и превращения энергии (Майер, Джоуль, Гельмгольц).
- •Гипотеза тепловой смерти Вселенной.
- •Электромагнитная индукция и теория поля Фарадея-Максвелла.
- •Принцип близкодействия.
- •Эксперименты Герца и открытие электромагнитных волн.
- •Концепция мирового эфира.
- •Естествознание XIX века. Химия и биология
- •14. Специальная (сто) и общая (ото) теории относительности
- •15. Квантовая механика (физика атома)
- •16. Физика атомного ядра
- •17. Физика элементарных частиц
- •18. Планетология
- •19. Астрофизика
- •20. Галактическая астрономия и космология
- •21. Молекулярная биология
- •22.Генетика
- •23. Биоэволюция
- •24. Антропология
- •25. Постнеклассическое естествознание XXI века
15. Квантовая механика (физика атома)
Планетарная модель атома Резерфорда.
1911 г. – была разработана планетарная модель атома.
Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома положительно заряженного ядра.

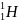
Размеры ядра ничтожно малы по сравнению с размерами атома.
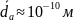
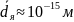
Ядро в 10 тысяч раз меньше атома.
Однако эта теория оказалась несовместимой с законами электродинамики Максвелла.
ve=2,2∙106 м/с (2200 км/с).
По Максвеллу, электрон должен моментально потерять энергию и упасть на ядро в микромире (внутри атома) не работают ни законы классической механики, ни законы электродинамики.
Выходом стало создание квантовой теории атома – Нильс Бор.
Идеи Планка и квантовая модель Бора (1-й и 2-й постулаты).
Н. Бор разработал квантовую модель на основе идей Макса Планка.
Планк занимался изучением электромагнитного излучения: любое тело излучает все диапазоны волн.

Закон смещения Ви́на.
Чем выше t˚ тела, тем выше частота, на которой тело излучается.
Кролик, человек – ИК лучи.
Стальная болванка – максимум излучения красного спектра.
«Ультрафиолетовая катастрофа»: при высокой t˚ излучение на практике расходилось с теорией.
Т еория
Планка
– электромагнитное излучение носило
дискретный характер (черное тело излучает
энергию порциями)
еория
Планка
– электромагнитное излучение носило
дискретный характер (черное тело излучает
энергию порциями)
Порции электромагнитной энергии Планк назвал квантами действия.
1910-1911 г. – квантовая теория излучения: свет распадается на отдельные порции.
Eγ=hν, где h – постоянная Планка (h=6.62∙10-34 Дж∙сек), ν – частота излучения.
Опираясь на идеи Планка, Эйнштейн выдвинул гипотезу о двойственной природе света (свет обладает и свойствами частицы, и свойствами волны) и получил за эту идею (теорию фотоэффекта) Нобелевскую премию.
Самые энергетичные – γ-лучи (опасны для живых организмов, разрушают ткани).
Фотон – частица света.
Боровская модель атома: справедлива для легких атомов (водород).
Первый постулат Бора: электрон в атоме может двигаться в атоме только по определенным (стационарным) орбитам, при этом атом не излучает и не поглощает электромагнитную энергию.
Э лектрон
в атоме энергию не теряет, остается
долго стабильным
лектрон
в атоме энергию не теряет, остается
долго стабильным
Суммарный заряд атома равен нулю (он нейтрален).
Электрон может двигаться только по определенным орбитам.
Следствия:
- на стационарной орбите момент импульса электрона квантуется (он кратен постоянной Планка)
момент импульса (L)
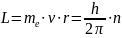
r – радиус орбиты (радиус поворота)
n – номер боровской орбиты (n=1,2,3,…)
- радиусы стационарных орбит электрона также квантованы (приобретают дискретные значения пропорционально квадрату главного квантового числа – числа n) = n2
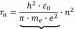
a (1-я орбита Бора)
Начала́ быстро развиваться квантовая механика.
«Боровский кружок»: Н. Бор, В. Гейзенберг (делал атомные бомбы для Гитлера), Э. Шрёдингер, В. Паули, П. Дирак, М. Борн.
В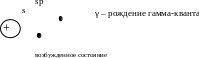 торой
постулат Бора
(правило частот): при переходе электрона
с одной стационарной орбиты на другую
атом излучат (поглощает) квант
электромагнитной энергии.
торой
постулат Бора
(правило частот): при переходе электрона
с одной стационарной орбиты на другую
атом излучат (поглощает) квант
электромагнитной энергии.
Атом переходит с 1-го уровня на 2-ой, но это ненадолго, потом он возвращается на 1-ый.
E2-E1=ΔE=h∙v21
Возвращается назад выделяется энергия (в виде гамма-кванта).
А если с 3-го вернулся – E3-E1=ΔE=hν31
hν31 > hν21 м.б. красный фотон
больше
м.б. фиолетовый (ультрафиол., рентген.)
Почему раскаленное тело излучает свет? – при нагревании электроны переходят в возбужденное состояние выделяется энергия.
Корпускулярно-волновой дуализм де Бройля, волновая механика Шрёдингера.
Дуализм двойственности Луи де Бройля: любые микрообъекты обладают и свойствами частицы, и свойствами волны; чем меньше размер объекта, тем свойства проявляются отчетливее (у крупных тел волновые свойства практически не обнаруживаются), у фотона волновые свойства обнаруживаются достаточно ясно.
Любой частице, обладающей импульсом p, соответствует длина волны де Бройля:
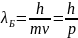
Волновая механика Шрёдингера.
Электрон – сгусток электромагнитной энергии, которая размазана по орбите
Вводит понятие плотность вероятности (ψ-функция): в одних точках пространства электрон находится чаще, чем в других.
 ,
справа – длина орбиты электрона
,
справа – длина орбиты электрона
На одной орбите должно уложиться целое значение волн де Бройля.
Принцип соотношения неопределенностей Гейзенберга (1926-1927 г)
В микромире невозможно одновременно точно определить координаты частиц и их импульсы (а в классической механике можно: зная начальную координату и импульс (скорость) частицы, можно найти ее положение в определенный момент времени).
Δx→0, Δp→∞ - неопределенность координаты; и наоборот - Δp→0, Δx→∞
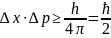
ħ – новая постоянная Планка, ħ=1,05∙10-34 Дж∙сек
Вывод: в микромире понятие определенной траектории теряет конкретный смысл (нельзя сказать точно, где находится электрон).
Принцип запрета Паули: в атоме не может быть двух и более электронов, находящихся в одинаковом квантовом состоянии, т.е. имеющих одинаковый набор квантовых чисел.
Принцип запрета Паули объяснил порядок застройки электронных оболочек.
Электроны заполняют последовательно квантовые состояния с наименьшей суммарной энергией (т.е. электроны заполняют энергетические уровни последовательно, начиная с 1-го).
Пример:
атом лития:
 - 2e-
- на 1s
орбитали (самой низкой по энергии), при
этом у них отличаются собственные
моменты импульса и третий e-
не может занимать 1s
орбиталь, т.к. будет нарушен запрет
Паули; поэтому он занимает 2s
орбиталь (более высокая по энергии
орбиталь после 1S).
- 2e-
- на 1s
орбитали (самой низкой по энергии), при
этом у них отличаются собственные
моменты импульса и третий e-
не может занимать 1s
орбиталь, т.к. будет нарушен запрет
Паули; поэтому он занимает 2s
орбиталь (более высокая по энергии
орбиталь после 1S).
К вантовые
числа и порядок застройки электронных
оболочек атома.
вантовые
числа и порядок застройки электронных
оболочек атома.
Квантовые числа:
1) главное (n) – определяет удаленность от ядра
n=1,2,3,...,7
2) орбитальное (l): 0,1,2…(n-1); форма орбитали (по сути – это подуровни): s, p, d, f-подуровни;
3) магнитное (m): ориентация магнитного момента (электрон создает магнитное поле); m=-1,0,+1;
4) спиновое (ms): направление вращения электрона в поле (спин – собственный момент импульса); ms=+1/2, -1/2.
Порядок застройки электронных оболочек атома.
По принципу наименьшей энергии электроны заполняют орбитали и уровни в порядке возрастания их энергий: уровни от 1 до 7, орбитали от s до f.
Необходимые понятия:
Электронная оболочка – совокупность всех электронов в атоме.
Электронное облако – часть атомного пространства, где вероятность нахождения электрона наибольшая. Формы эл.облаков: s (шар, сфера), p (правильная восьмерка, гантелеобразная), d (4-х лепестковое).
Энергетический уровень – часть электронной оболочки, образованной равноудаленными от ядра электронами (имеют одинаковый запас энергии). Число эн.уровней равно номеру периода.
Каждый уровень делится на подуровни (их число на уровне равно номеру уровня).
Электронная орбиталь – часть электронного облака, где вероятность нахождения электрона максимальная (90%). Каждый подуровень делится на орбитали, где и расположены электроны. Число орбиталей на подуровне равно нечетному числу по возрастающей (s - 1 орбиталь, p – 3, d – 5, f – 7)
Ряд последовательного заполнения подуровней электронами: 1s2s2p3s4s3d4p5s4d5p6s5d…
Число электронов на внешнем уровне равно номеру группы для элементов главных подгрупп. Внешний уровень считается завершенным, если содержит 8 электронов, за исключением 1-го уровня (2 электрона).
Начиная с 3-го элемента четного ряда в больших периодах и заканчивая 2-ым элементом нечетного ряда, заполняется d-подуровень предпоследнего уровня, а на внешнем уровне 2 электрона (это элементы побочных подгрупп) т.к. по принципу наименьшей энергии электроны заполняют орбитали и уровни в порядке возрастания их энергий, то из орбиталей 4s и 3d раньше заполнится орбиталь 3 уровня, т.е. 3d, а из орбиталей 5s и 4p раньше заполнится орбиталь 4 уровня, т.е. 4p.
Сколько степеней свободы на первом энергетическом уровне? (как характеристики меняются?): l не меняется, m – тоже, ms может иметь 2 значения может размещаться 2 электрона.

n |
l |
орбиталь |
m |
ms |
1 |
0 |
1s |
0 |
+1/2, -1/2 |
2 |
0 |
2s |
0 |
+1/2, -1/2 |
2 |
1 |
2p |
-1, 0, 1 |
+1/2, -1/2 |
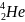
- на 1-ом энерг. уровне (s) может размещаться 2 электрона
При n=2: l может принимать 2 значения (0, 1), m – 4 значения (0; -1, 0, 1)
4х2=8 может размещаться 8 электронов.
Z – зарядовое число (число протонов).
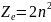
n=1, z=2
n=2, z=8
n=3, z=18
n=4, z=32
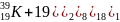
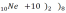 -
на внешней электронной орбите – 1
электрон; это самые активные химические
элементы (на O2
окисляются); 1 свободный электрон
легко вступают в химические реакции
(принимают электроны);
-
на внешней электронной орбите – 1
электрон; это самые активные химические
элементы (на O2
окисляются); 1 свободный электрон
легко вступают в химические реакции
(принимают электроны);
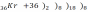
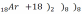

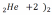
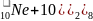
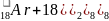
- на внешней электронной оболочке 8 (у гелия – 2) электронов – они полностью заполнены; они химически малоактивны (т.к. заполнен внешний уровень и они не принимают электроны).
