
- •Список вопросов
- •Расчет магнитных полей соленоида и тороида с использованием теоремы о циркуляции вектора h.
- •Вопрос 1. Электрический заряд. Закон Кулона. Напряженность электростатического поля. Силовые линии. Принцип суперпозиции и его применение к расчету поля бесконечно длинной равномерно заряженной нити.
- •Вопрос 2. Понятие потенциала электростатического поля. Работа поля по перемещению зарядов. Циркуляция вектора е по замкнутому контору.
- •Вопрос 3. Понятие градиента. Связь вектора е и потенциала . Поток вектора напряженности электростатического поля. Дивергенция е.
- •Вопрос 4. Теорема Гаусса в интегральной и дифференциальной форме.
- •Вопрос 5. Теорема Гаусса в дифференциальной форме. Уравнение Пуассона.
- •Вопрос 6. Применение теоремы Гаусса для расчета полей равномерно заряженной плоскости и цилиндра.
- •Вопрос 7. Электрическое поле равномерно заряженное на поверхности сферы. Графики для напряженности и потенциала электростатического поля.
- •Вопрос 8. Расчет вектора напряженности электростатического поля равномерно заряженного по объему шара.
- •Вопрос 9. Проводник в электростатическом поле. Электростатическая индукция. Поле вблизи поверхности заряженного проводника. Результирующее поле и потенциал заряженного проводника.
- •Вопрос 10. Электрический диполь: его характеристики и собственное поле. Поведение диполя в однородном и неоднородном электростатических полях.
- •Вопрос 12. Т-ма Гаусса для диэлектриков. Обобщённая т-ма Гаусса. Вектор электрического смещения. Сторонние и связанные заряды. Связь векторов e, р и d.
- •Вопрос 13
- •Вопрос 14. Электроемкость. Емкость плоского, цилиндрического и сферического конденсаторов.
- •Вопрос 15. Энергия системы неподвижных зарядов. Энергия заряженного проводника и заряженного конденсатора. Энергия электростатического поля. Объемная плотность энергии.
- •Вопрос 16. Носители электрического тока в средах. Дрейф заряженных частиц. Сила и плотность тока. Уравнение непрерывности.
- •Вопрос 17. Электрическое поле в проводнике с током. Силовые линии поля и линии тока. Однородные и неоднородные электрические цепи. Сторонние силы. Эдс цепи.
- •Вопрос 18. Закон Ома в интегральной и дифферинциальной форме. Удельное сопротивление и электропроводность среды.
- •Вопрос 19. Закон Ома для неоднородного участка цепи. Закон Ома для замкнутой цепи.
- •Вопрос 20. Закон Джоуля-Ленца в интегральной и дифференциальной форме.
- •Вопрос 21. Обобщенная сила Лоренца. Движение заряженной частицы в однородных электрическом и магнитном полях. Определение удельного заряда частицы.
- •Вопрос 22. Магнитное поле тока в вакууме. Закон Био-Савара. Принцип суперпозиции для магнитных полей и его применение для расчета поле кругового тока.
- •Принцип суперпозиции
- •Р асчет кругового тока.
- •Вопрос 23. Закон Ампера. Магнитный момент контура с током. Контур с током в магнитном поле. Силы и момент сил, действующих на контур, в однородном и неоднородном магнитном поле.
- •Магнитный момент контура с током.
- •Вопрос 24. Работа по перемещению проводника с током в магнитном поле. Понятие магнитного потока. Потокосцепление.
- •Потокосцепление.
- •Работа по перемещению проводника с током в магнитном поле.
- •Вопрос 25. Циркуляция и ротор вектора индукции магнитного поля. Теорема Гаусса для магнитного поля.
- •Вопрос 26. Расчет магнитных полей соленоида и тороида с использованием теоремы о циркуляции вектора h.
- •Вопрос 27. Намагниченность вещества. Циркуляция вектора намагниченности. Магнитная восприимчивость и магнитная проницаемость. Связь векторов магнитного поля: b, j, h.
- •Вопрос 28. Магнитное поле в веществе. Диамагнетики, парамагнетики, ферромагнетики и особенности в их намагниченности.
- •Вопрос 29. Поле на границе раздела двух однородных магнетиков. Условия преломления для векторов b и h.
- •Вопрос 33. Обобщение максвеллом закона электромагнитной индукции. Понятие Вихревого электрического поля. Циркуляция вектора е.
- •Вопрос 34. Циркуляция вектора н с позиции Максвелла. Ток смещения. Закон полного тока.
- •Вопрос 35. Системы уравнений Максвелла в интегральных и дифференциальных формах.
- •Вопрос 38. Излучение электромагнитных волн ускоренно движущимися зарядами и диполем.
- •Вопрос 40. История взглядов на природу света. Волновая и корпускулярная теории света. Шкала электромагнитных излучений.
- •Вопрос 41. Амплитуда и интенсивность электромагнитной волны. Световой вектор. Показатель преломления среды. Длина электромагнитной волны в разных средах.
- •Вопрос 42. Электромагнитная волна на границе раздела двух диэлектрических сред. Коэффициенты отражения и пропускания.
- •Вопрос 43. Принцип суперпозиции электромагнитных волн. Интерференция света. Интерференционное уравнение. Взаимная когерентность световых волн.
- •Вопрос 44. Интерференция от двух когерентных источников. Условия наблюдения на экране интерференционных максимумов и минимумов. Интерференционная зона, ширина интерференционной полосы.
- •Вопрос 45. Временная когерентность электромагнитных волн: время и длина когерентности (на примере опыта Юнга).
- •Вопрос 46. Пространственная когерентность электромагнитных волн (на примере опыта Юнга), ширина когерентности.
- •Вопрос 47. Интерференция в тонких пленках. Полосы равного наклона и равной толщины. Кольца Ньютона.
- •Вопрос 53. Дифракционная решетка как спектральный прибор. Главные максимумы и интерференционные минимумы. Общая дифракционная картина от решетки.
- •Вопрос 54. Спектральные характеристики дифракционной решетки. Угловая дисперсия (определение и расчет). Область дисперсии.
- •Вопрос 55. Спектральные характеристики дифракционной решетки. Разрешающая способность (определение и вывод из критерия Рэлея).
- •24. Разрешающая способность дифракционной решетки.
- •Вопрос 56. Поляризация света. Естественный и поляризованный свет. Виды поляризации. Графический способ представления поляризации.
- •Вопрос 57. Частично поляризованный свет. Степень поляризации.
- •Вопрос 58. П оляризаторы и анализаторы. З-н Малюса.
- •Вопрос 59. П оляризация света при отражении и преломлении. З-н Брюстера.
- •Вопрос 60. П оляризация при двойном лучепреломлении. Обыкновенный и необыкновенный лучи. Распостранение света в одноосных кристаллах. Поляризационная призма и поляроид. Призма Николя.
- •Вопрос 61. Тепловое излучение и его свойство. Основные характеристики теплового излучения. Понятие: абсолютно чёрное тело (ачт), серое тело. Тепловое излучение
- •Спектральная поглощательная способность
- •Вопрос 62. Закон Кирхгофа для теплового излучения. Расчёт испускательной способности реальных излучений.
- •Вопрос 63. Закон Стефана-Больцмана и закон смещения Вина для ачт. Спектр теплового излучения.
- •Спектр теплового излучения
- •Вопрос 64. Гипотеза и универсальная формула Планка для спектральной плотности энергетической светимости ачт. Гипотеза Планка
- •Формула Планка
- •Вопрос 65. Внешний фотоэффект и его законы. Формула Эйнштейна.
- •Вопрос 66. Корпускулярные свойства света. Эффект Комптона. Комптоновская длина волны.
- •Эффект комптона
- •Вопрос 67. Корпускулярно-волновой дуализм материи. Волновые св-ва микрочастиц. Гипотеза де Бройля. Волны де Бройля. Опыты Девиссона – Джермера по дифракции электронов.
- •Вопрос 68. Соотношение неопределённостей Гейзенберга, их применение и следствия.
- •Вопрос 69. Волновая ф-ция, ее назначение и физический смысл. Пл-ть вер-ти обнаружения частицы. Требования (условия) для волновой ф-ции. Принцип суперпозиции состояний
- •Вопрос 70. Стационарные состояния и стационарное ур-ие Шредингера. Собственные значения энергии и собственные ф-ции.
- •Вопрос 71. Микрочастица в одномерной потенциальной яме с бесконечно высокими стенками. Уравнение Шредингера, собственные ф-ции состояния, условие нормировки, квантование энергии частицы.
- •Вопрос 72. Прохождение частицы через высокий потенциальный барьер (туннельный эффект). Коэффициент прохождения (прозрачности) барьера.
- •Вопрос 73. Спектр излучения атома водорода. Ф-ла Бальмера. Постулаты Бора. Элементарная боровская теория водородоподобного атома. Квантование радиусов орбит и энергии электрона.
- •Вопрос 74. Стационарное ур-ие Шредингера для атома водорода. Квантование энергии. Энергия связи электрона. Энергия ионизации.
- •Вопрос 75. Спин, собственные механический и магнитный моменты электрона. Опыты Штерна – Герлаха.
- •Вопрос 76. Квантовые системы из одинаковых микрочастиц. Принцип неразличимости тождественных частиц. Бозоны и фермионы Принцип Паули.
Вопрос 74. Стационарное ур-ие Шредингера для атома водорода. Квантование энергии. Энергия связи электрона. Энергия ионизации.
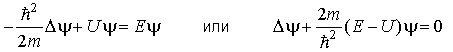 - уравнение Шредингера для стационарных
состояний. Здесь: ћ=h/2π;
m – масса частицы,
- уравнение Шредингера для стационарных
состояний. Здесь: ћ=h/2π;
m – масса частицы,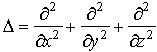 - оператор Лапласа; U(x,y,z)
– потенциальная функция частицы в
силовом поле, в котором она движется;
ψ(x,y,z)
–искомая волновая функция частицы; E
– полная энергия частицы.
- оператор Лапласа; U(x,y,z)
– потенциальная функция частицы в
силовом поле, в котором она движется;
ψ(x,y,z)
–искомая волновая функция частицы; E
– полная энергия частицы.
Атом водорода в квантовой механике. На примере водородоподобных атомов – простейших атомов, содержащих единственный внешний электрон, - рассмотрим основы систематики квантовых состояний атомов. Поле водородоподобного атома – это пример центрального поля. В таком поле удобно использовать сверическую систему координат: r, θ,φ. Потенциальная энергия кулоновского взаимодействия электрона с атомным ядром, обладающим зарядом Ze (для атома водорода Z=1)
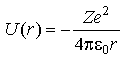 ,
где r – расстояние между
электроном и ядром. Стационарное
уравнение Шредингера:
,
где r – расстояние между
электроном и ядром. Стационарное
уравнение Шредингера:
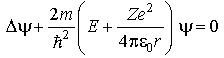 ,
только при собственных значениях энергии
,
только при собственных значениях энергии
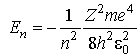 (n=1,2,3,…) имеет решения,
удовлетворяющие требованиям однозначности,
конечности и непрерывности волновой
функции ψ(r,θ,φ). Нижайший
уровень E1 – основной,
все остальные – возбужденные. При E<0
движение электрона – связанное, при
E>0 – свободное (атом
ионизуется). Энергия E=E∞=0
достигается при n=∞.
(n=1,2,3,…) имеет решения,
удовлетворяющие требованиям однозначности,
конечности и непрерывности волновой
функции ψ(r,θ,φ). Нижайший
уровень E1 – основной,
все остальные – возбужденные. При E<0
движение электрона – связанное, при
E>0 – свободное (атом
ионизуется). Энергия E=E∞=0
достигается при n=∞.
Энергия ионизации атома водорода
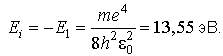 .
Эта же энергия (по модулю) является
энергией связи электрона в основном
состоянии. Именно такую энергию надо
сообщить электрону в основном состоянии
(n=1), чтобы удалить его из
атома водорода. Собственные волновые
функции ψ=ψnlm(r,θ,φ)
определяются тремя квантовыми числами:
главным n, орбитальным l
и магнитным m.
.
Эта же энергия (по модулю) является
энергией связи электрона в основном
состоянии. Именно такую энергию надо
сообщить электрону в основном состоянии
(n=1), чтобы удалить его из
атома водорода. Собственные волновые
функции ψ=ψnlm(r,θ,φ)
определяются тремя квантовыми числами:
главным n, орбитальным l
и магнитным m.
Квантование энергии электрона в атоме
Некоторые физические величины, относящиеся к микрообъектам, изменяются не непрерывно, а скачкообразно. О величинах, которые могут принимать только вполне определенные, то есть дискретные значения (латинское "дискретус" означает разделенный, прерывистый), говорят, что они квантуются.
В 1900 г. немецкий физик М. Планк, изучавший тепловое излучение твердых тел, пришел к выводу, что электромагнитное излучение испускается в виде отдельных порций - квантов - энергии. Значение одного кванта энергии равно
ΔE = hν,
где ΔE - энергия кванта, Дж; ν - частота, с-1; h - постоянная Планка (одна из фундаментальных постоянных природы), равная 6,626·10−34 Дж·с.
Кванты энергии впоследствии назвали фотонами.
Идея о квантовании энергии позволила объяснить происхождение линейчатых атомных спектров, состоящих из набора линий, объединенных в серии.

Первая квантовая теория строения атома была предложена Н. Бором. Он считал, что в изолированном атоме электроны двигаются по круговым стационарным орбитам, находясь на которых, они не излучают и не поглощают энергию. Каждой такой орбите отвечает дискретное значение энергии.
Переход электрона из одного стационарного состояния в другое сопровождается излучением кванта электромагнитного излучения, частота которого равна
ν = ΔE / h,
где ΔE - разность энергий начального и конечного состояний электрона, h - постоянная Планка.
Дискретность энергии электрона является важнейшим принципом квантовой механики. Электроны в атоме могут иметь лишь строго определенные значения энергии. Им разрешен переход с одного уровня энергии на другой, а промежуточные состояния запрещены.

