
- •Заняття №16
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина
- •1.1.3. Мірний посуд
- •1.2. Аналітичні терези та методи зважування на них
- •1.2.1. Будова аналітичних терезів
- •1.2.2. Вимоги, які висуваються до аналітичних терез
- •1.2.3. Правила роботи з терезами
- •1.2.4. Техніка зважування
- •2.1.2. Встановлення молярної концентрації еквіваленту розчину хлоридної кислоти
- •2.1.3. Встановлення концентрації хлоридної кислоти за бурою
- •2.1.4. Встановлення молярної концентрації еквіваленту розчину хлоридної кислоти за натрію карбонатом
- •2.1.5. Приготування стандартних розчинів хлоридної кислоти різних концентрацій із концентрованих розчинів
- •2.1.6. Приготування розчину хлоридної кислоти із фіксаналу
- •2.2. Приготування робочого титрованого розчину лугу
- •2.2.1. Робочі розчини лугів
- •2.2.2. Вихідні речовини
- •2.2.3. Встановлення концентрації розчину натрію гідроксиду за оксалатною кислотою
- •2.2.4. Встановлення концентрації розчину NaОн за оксалатною кислотою
- •2.2.5. Встановлення концентрації розчину NaOh за робочим титрованим розчином хлоридної кислоти
- •2.2.6.Приготування стандартних розчинів лугу різних концентрацій
- •Літературa
- •Заняття №17
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина Завдання 1. Визначення вмісту хлоридної кислоти в розчині
- •Приготування робочого титрованого розчину NaOh
- •1.2. Приготування 500 см3 приблизно 0,1м розчину NaOh
- •1.3. Приготування стандартного розчину оксалатної кислоти
- •1.4. Встановлення концентрації розчину NaOh за оксалатною кислотою
- •1.5. Титрування досліджуваного розчину hCl розчином NaOh
- •Літературa
- •Заняття №18
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна робота на занятті
- •Експериментальна частина Завдання 1. Визначення ацетатної кислоти
- •Хід аналізу
- •Завдання 2. Визначення ортоборатної кислоти
- •Хід аналізу
- •Завдання 3. Визначення аміаку
- •Хід аналізу
- •Літературa
- •Заняття №19
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна робота на занятті
- •Експериментальна частина Завдання 1. Визначення вмісту багатоосновних кислот
- •1.1. Визначення вмісту h2so4 в технічній кислоті
- •Однак, оскільки h2so4 і hso4- досить сильні кислоти, то при титруванні водних розчинів сульфатної кислоти спостерігається тільки одна точка еквівалентності. Хід аналізу
- •1.2. Визначення вмісту ортофосфатної кислоти
- •Хід аналізу
- •Літературa
- •Заняття №20
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина Завдання 1. Визначення натрію карбонату та натрію гідрокарбонату при їх одночасній присутності в розчині
- •Хід аналізу
- •Завдання 2. Визначення ортофосфатної і сульфатної кислот при їх одночасній присутності в розчині
- •Хід аналізу
- •Літературa
- •Заняття №21
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Літературa
- •Заняття №22
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина Завдання 1. Приготування приблизно 0,1н розчину калію перманганату
- •Завдання 2. Приготування вихідного розчину оксалатної кислоти
- •Завдання 3. Титрування розчину оксалатної кислоти (або натрію оксалату) розчином калію перманганату
- •Завдання 4. Визначення калію дихромату перманаганатометричним методом
- •Хід аналізу
- •Завдання 5. Визначення феруму в розчині солі Мора
- •Завдання 6. Визначення процентного складу гідрогену пероксиду в розчині
- •30 Г н2о2 міститься в 100 г 30%-го розчину н2о2
- •0,17 Г н2о2 міститься в х г 30%-го розчину н2о2.
- •Літературa
- •Заняття №23
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина Завдання 1. Приготування розчину натрію тіосульфату
- •1.Натрію тіосульфат реагує з карбонатною кислотою, розчиненою у воді:
- •2.Натрію тіосульфат оксидується киснем повітря:
- •3.Натрію тіосульфат розкладається тіобактеріями.
- •Завдання 2. Приготування розчину калію дихромату
- •Завдання 3. Встановлення концентрації розчину натрію тіосульфату за калію дихроматом
- •Завдання 4. Приготування вихідного розчину йоду
- •Завдання 5. Приготування розчину крохмалю
- •Завдання 6. Йодометричне визначення відновників методом прямого титрування
- •Завдання 7. Визначення сульфітів методом зворотнього титрування
- •Завдання 8. Визначення формаальдегіду у формаліні
- •Завдання 9. Визначення аскорбінової кислоти
- •Літературa
- •Заняття №24
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина
- •Завдання 1. Приготування 0,1н розчину калію бромату(калію йодату). Стандартизація розчинів за натрію тіосульфатом
- •Завдання 2. Визначення фенолу та його похідних
- •Хід аналізу
- •Завдання 3. Визначення Магнію реакцією
- •Завдання 4. Визначення масової частки стрептоциду у препараті
- •Завдання 5. Титрування калію йодатом
- •Хід аналізу
- •Літературa
- •Заняття №25
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина Завдання 1. Приготування 0,1м розчину аргентуму нітрату
- •Завдання 2. Приготування 0,01м розчину натрію хлориду
- •Завдання 3. Стандартизація 0,1м розчину аргентуму нітрату за натрію хлоридом
- •Завдання 4. Визначення процентного вмісту Хлору в зразку кухонної солі за методом Мора
- •Завдання 5. Визначення масової частки натрію хлориду в препараті за методом Фаянса-Ходакова
- •Завдання 6. Визначення масової частки калію йодиду в препараті за методом Фаянса-Ходакова
- •Літературa
- •Заняття №26
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина Завдання 1. Приготування 0,1м розчину амонію роданіду
- •Завдання 2. Стандартизація 0,1м розчину амонію роданіду за стандартним розчином аргентуму нітрату
- •Завдання 3. Визначення вмісту хлоридної кислоти в розчині за методом Фольгарда
- •Завдання 4. Визначення вмісту NaBr в сухій солі за методом Фольгарда
- •Літературa
- •Заняття №27
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина Завдання 1. Приготування 0,05н розчину трилону б
- •Завдання 2. Стандартизація 0,05н розчину трилону б за цинком металічним
- •Завдання 3. Методика визначення катіонів комплексонометричним методом
- •3.1. Алюміній
- •3.2. Бісмут
- •3.3. Кальцій
- •Розрахунки:
- •Завдання 5. Визначення загальної твердості води.
- •Літературa
- •Заняття №28
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина Завдання 1. Визначення масової частки гігроскопічної вологи в природних технічних продуктах
- •Результати аналізу вологи в речовині
- •Літературa
- •Заняття №29
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Експериментальна частина Завдання1. Визначення сульфатів у природних і стічних водах.
- •Чистота осаду
- •Форма осаду
- •Характеристика вагової форми
- •Хід роботи
- •Осадження
- •Фільтрування
- •Висушування та прожарювання
- •Розрахунок результатів аналізу:
- •Завдання 2. Визначення вмісту Барію в технічному зразку BaCl2•2h2o
- •Розрахунок наважки
- •Зважування наважки та її розчинення
- •Розрахунок кількості осаджувача
- •Осаджування
- •Фільтрування і промивання осаду
- •Висушування і прожарювання осаду
- •Завдання 3. Визначення вмісту Феруму в солі Мора
- •Виконання аналізу
- •Літературa
- •Заняття №30
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Літературa
Однак, оскільки h2so4 і hso4- досить сильні кислоти, то при титруванні водних розчинів сульфатної кислоти спостерігається тільки одна точка еквівалентності. Хід аналізу
Перш за все вимірюють густину розчину H2SO4. Якщо вихідна кислота дуже концентрована, то її наважку розраховують за формулою:
![]() .
.
Якщо кислота розведена, то наважку її збільшують у відповідності з концентрацією.
При зважуванні кислот дотримуються певних правил обережності. Спочатку зважують кислоту в бюксі, в який попередньо наливають 10 см3 води, потім точно зважують на аналітичних терезах, стараючись, щоб сульфатна кислота не попала ні на терези, ні на зовнішню сторону бюкса. Якщо вихідна кислота не концентрована, то воду в бюкс не наливають.
Для того, щоб взяти точну наважку, бюкс з водою ставлять на ліву чашку технічних терезів і тарують. Після цього на праву частину терезів ставлять різноважки, а потім у бюкс краплями додають обережно сульфатну кислоту до тих пір, поки чашки терезів не зрівноважаться. Зважену кислоту переносять за допомогою лійки в мірну колбу на 250 см3, в яку попередньо налито 100-150 см3 води. Бюкс і лійку декілька раз ополіскують водою і нею ж доводять об’єм у мірній колбі до мітки. Піпеткою відбирають із колби 25 см3 розчину в конічну колбу, додають 2-3 краплі розчину фенолфталеїну і титрують 0,1М розчином лугу.
Масову частку сульфатної кислоти визначають за формулою:
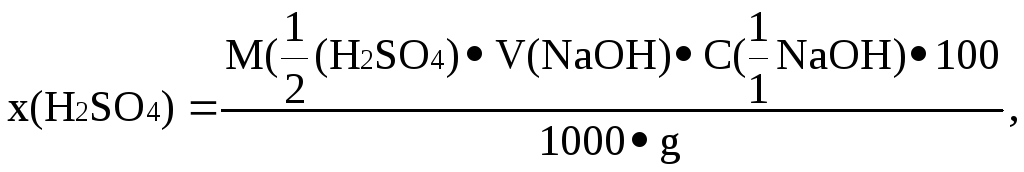
де
![]() – молярна маса еквіваленту H2SO4;
– молярна маса еквіваленту H2SO4;
![]() –
об’єм
лугу, що пішов на титрування;
–
об’єм
лугу, що пішов на титрування;
![]() –
молярна
концентрація еквіваленту NaOH;
–
молярна
концентрація еквіваленту NaOH;
g – наважка кислоти, г.
1.2. Визначення вмісту ортофосфатної кислоти
Титрування H3PO4 відзначається певними особливостями. Її визначення основане на титруванні стандартними розчинами NaOH.
Перша константа дисоціації H3PO4 досить велика (К1= 1,1•10-2; рК=1,96), тому ортофосфатну кислоту можна титрувати в присутності метилового оранжевого.
При титруванні в присутності цього індикатору ортофосфатна кислота титрується як одноосновна:
H3PO4 + NaOH = NaH2PO4 + H2O.
Молярна
маса еквіваленту H3PO4
для цього випадку дорівнює її молекулярній
масі
![]() .
.
Друга константа дисоціації H3PO4 в 100 раз менша константи дисоціації ацетатної кислоти (К2= 2,0•10-7; рК= 6,7), тому H3PO4 як двоосновну кислоту можна титрувати в присутності фенолфталеїну. Для зменшення процесу гідролізу до титрованого розчину додають натрію хлорид:
H3PO4 + 2NaOH = Na2HPO4 + 2H2O.
В
цьому випадку молярна маса еквіваленту
H3PO4
дорівнює половині її молекулярної маси.
![]() .
.
Третя константа дисоціації H3PO4 дуже мала (К3= 3,6•10-12; рК= 11,44) і тому неможливо відтитрувати у водному розчині H3PO4 як триосновну кислоту згідно з рівнянням:
H3PO4 + 3NaOH Na3PO4 + 3H2O.
Протіканню цієї реакції зліва направо перешкоджає гідроліз Na3PO4 – солі, утвореної катіоном сильної основи і аніоном дуже слабкої кислоти. Гідроліз обумовлюється взаємодією PO43- з йонами гідрогену. Якщо PO43- осадити у вигляді якої-небудь малорозчинної солі (наприклад, Ca3(PO4)2), то тоді можна відтитрувати H3PO4, як триосновну кислоту.
-
H3PO4 + ОН– H2PO4– + H2O (метиловий оранжевий)
-
H2PO4– + ОН– HPO42– + H2O (фенолфталеїн)
-
2HPO42– + 3Са2+ + 2ОН– Са3(РO4)2 + 2H2O (в присутності CaСl2 – фенолфталеїн)
У цьому випадку молярна маса еквіваленту дорівнює:

