
- •Работа 1 окислительно-восстановительные реакции
- •Основные теоретические положения
- •Порядок выполнения работы
- •Контрольные задания Вариант 1
- •Вариант 2
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Работа 2 гальванические элементы
- •Основные теоретические положения
- •Порядок выполнения работы
- •Экспериментальные и расчетные данные
- •Контрольные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •1. Никелевый и кобальтовый электроды помещены в растворы их солей. В каком соотношении должны быть взяты концентрации ионов данных металлов, чтобы их потенциалы были одинаковыми?
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Электролиз
- •Основные теоретические положения
- •Порядок выполнения работы
- •Часть 1. Определение электрохимического эквивалента меди
- •Часть 2. Газометрический метод определения выхода продуктов электролиза по току
- •Экспериментальные и расчетные данные для определения электрохимического эквивалента меди
- •Экспериментальные и расчетные данные для процесса электролиза раствора гидроксида натрия
- •Часть 3. Электрохимическое цинкование
- •Экспериментальные и расчетные данные для процесса цинкования
- •Часть 1. Определение электрохимического эквивалента меди
- •Часть 2. Газометрический метод определения выхода продуктов электролиза по току
- •Часть 3. Электрохимическое цинкование
- •Контрольные задания
- •Коррозия металлов
- •Основные теоретические положения
- •Порядок выполнения работы
- •Контрольные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Определение электропроводимости раствора уксусной кислоты
- •Основные теоретические положения
- •Порядок выполнения работы
- •Контрольные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Библиографический список
- •Третьяков ю.Д. Практикум по неорганической химии: Учеб. Пособие. – м.: Академия, 2004.
- •Стандартные электродные потенциалы окислительно-восстановительных систем в водных растворах
- •Приложение 2 Метрологическая карта средств измерения
- •Давление насыщенного водяного пара при различных температурах
- •Подвижности ионов при 25°с и бесконечном разведении
- •Часть 3
- •162600, Г. Череповец, пр. Луначарского, 5
-
Ахметов Н.С. Общая и неорганическая химия. – М.: Высш. шк., 2005.
-
Ахметов Н.С., Азизова М.К., Бадыгина Л.И. Лабораторные и семинарские занятия по общей и неорганической химии. – М.: Высш. шк., 2003.
-
Задачи и упражнения по общей химии: Учеб. пособие / Под ред. Н.В. Коровина. – М.: Высш. шк., 2003.
-
Задачи по общей и неорганической химии: Учеб. пособие для студ. высш. учеб. завед. / Под ред. Р.А. Лидина. – М.: ВЛАДОС, 2004.
-
Князев Д.А., Смарыгин С.Н. Неорганическая химия. – М.: Дрофа, 2004.
-
Лидин Р.А. и др. Неорганическая химия в реакциях: Справочник. – М.: Дрофа, 2007.
-
Литвинова Т.Н. Сборник задач по общей химии: Учеб. пособие для студ. вузов. – 3-е изд., перераб. – М., 2007.
-
Третьяков ю.Д. Практикум по неорганической химии: Учеб. Пособие. – м.: Академия, 2004.
9. Краткий справочник физико-химических величин / Под ред. А.А. Равделя и А.М. Пономаревой. – СПб.: «Иван Федоров», 2003. – 240 с.
ПРИЛОЖЕНИЯ
Приложение 1
Стандартные электродные потенциалы окислительно-восстановительных систем в водных растворах
-
Элемент
Электродный процесс
Е0, В
Ag
Ag+ + 1ē = Ag
+ 0,80
AgCl + 1ē = Ag + Cl–
+ 0,22
Ag2+ + 1ē = Ag+
+ 1,98
Ag2О + Н2О + 2ē = 2Ag + 2ОН–
+ 0,34
2AgО + Н2О + 2ē = Ag2О + 2ОН–
+ 0,607
Ag2S + 2ē = 2Ag + S2–
– 0,691
Ag2S + 2Н+ + 2ē = 2Ag + Н2S
– 0,0366
AgI + 1ē = Ag + I–
– 0,15
Al
Al3+ + 3ē = Al0
– 1,662
AlO
 + 2H2O
+ 3 ē
= Al + 4OH–
+ 2H2O
+ 3 ē
= Al + 4OH–– 2,35
Al(OH)3 + 3ē = Al + 3OH–
– 2,328
As
H3AsO4 + 2H+ + 2ē = HAsO2 + 2H2O
+ 0,56
AsO
 + 2H2O
+ 2ē
= AsO
+ 2H2O
+ 2ē
= AsO +
4OH–
+
4OH–– 0,71
Аu
Au3+ + 3ē = Au0
+ 1,498
Au+ + 1ē = Au0
+ 1,691
Ва
Ва2+ + 2ē = Ва0
– 2,912
Be
Ве2+ + 2ē = Ве0
– 1,847
Be2O
 +
3H2O
+ 4ē
= 2Be + 6OH–
+
3H2O
+ 4ē
= 2Be + 6OH–– 2,63
Bi
Вi3+ + 2ē = Ві0
+ 0,308
NaBiO3 + 6H+ + 2ē = Bi3+ + 3H2O + Na+
+ 1,81
Br
BrO
 + 3H2O
+ 6ē
= Br –+
6OH–
+ 3H2O
+ 6ē
= Br –+
6OH–+ 0,61
Br2 + 2ē = 2Br –
+ 1,09
HBrO + H+ + 2ē = Br – + H2O
+ 1,34
BrO
 + 6H+
+ 6ē
= Br – + 3H2O
+ 6H+
+ 6ē
= Br – + 3H2O+ 1,423
Са
Cа2+ + 2ē = Cа0
– 2,866
Cd
Cd2+ + 2ē = Cd0
– 0,403
CdSO4 + 2ē = Cd + SO

– 0,246
Cd(ОН)
 +
2ē = Cd + 4ОН–
+
2ē = Cd + 4ОН–– 0,658
CdО + Н2О + 2ē = Cd + 2ОН–
– 0,783
Се
Се3+ + 3ē = Се0
– 2,336
Се4+ + 1ē = Се3+
+ 1,743
Со
Со2+ + 2ē = Со0
– 0,277
Со(ОН)2 + 2ē = Со + 2ОН–
– 0,73
Со(ОН)3 + 1ē = Со(ОН)2 + ОН–
+ 0,17
Со3+ + 1ē = Со2+
+ 1,808
Cl
Cl2 + 2ē = 2Cl–
+ 1,36
ClO
 + 6H+
+ 6ē
= Cl– + 3H2O
+ 6H+
+ 6ē
= Cl– + 3H2O+ 1,46
ClO– + H2O + 2ē = Cl– + 2OH–
+ 0,92
2ClO– + 2H2O + 2ē = Cl2 + 4OH–
+ 1,56
ClO
 + 2H2O
+ 4ē
= Cl–
+ 4OH–
+ 2H2O
+ 4ē
= Cl–
+ 4OH–+ 0,76
ClO
 + H2O
+ 2ē
= ClO–
+ 2OH–
+ H2O
+ 2ē
= ClO–
+ 2OH–+ 0,66
ClO
 + 8H+
+ 8ē
= Cl– + 4H2O
+ 8H+
+ 8ē
= Cl– + 4H2O+ 1,389
ClO
 + H2O
+ 2ē
= ClO
+ H2O
+ 2ē
= ClO + 2OH–
+ 2OH–+ 0,36
HClO2 + 2H+ + 2ē = HClO + H2O
+ 1,645
Cr
Cr3+ + 3ē = Cr0
– 0,744
Cr2+ + 2ē = Cr0
– 0,913
Cr2O
 + 14H+ +
6ē
= 2Cr3+
+ 7H2O
+ 14H+ +
6ē
= 2Cr3+
+ 7H2O+ 1,33
CrO
 +2H2O
+ 3ē
= CrO
+2H2O
+ 3ē
= CrO + 4OH–
+ 4OH–– 0,21
CrO
 + 4H2O
+ 3ē
= Cr3+
+ 8OH–
+ 4H2O
+ 3ē
= Cr3+
+ 8OH–+ 1,45
CrO
 + 8H+
+ 3ē
= Cr3+
+ 4H2O
+ 8H+
+ 3ē
= Cr3+
+ 4H2O+ 1,47
Cr(OH)3 + 3ē = Cr + 3OH–
– 1,48
CrO3 + 6H+ + 3ē = Cr3+ + 3H2O
– 0,11
CrO
 + 4H2O
+ 3ē
= Cr(OH)3
+ 5OH–
+ 4H2O
+ 3ē
= Cr(OH)3
+ 5OH–– 0,13
Сs
Cs+ + 1ē = Cs0
– 2,923
Сu
Cu+ + 1ē = Cu0
+ 0,521
Cu3+ + 1ē = Cu2+
+ 2,4
Cu2О3 + 6Н+ + 2ē = 2Cu2+ + 3Н2О
+ 2,0
Cu2О + Н2О + 2ē = 2Cu + 2ОН–
– 0,36
Cu2+ + 2ē = Cu0
+ 0,342
Fr
Fr+ + 1ē = Fr
– 2,900
Gа
Gа 3+ + 3ē = Gа
– 0,549
Gе
Gе 2+ + 2ē = Gе
+ 0,40
Gе 4+ + 4ē = Gе
+ 0,124
H
2Н+ + 2ē = Н2
0,00
2H2O + 2ē = H2 + 2OH–
– 0,83
H2O2 + 2H+ + 2ē = 2H2O
+ 1,776
Hf
Hf 4+ + 4ē = Hf
– 1,550
Hg
2Hg 2+ + 2ē = Hg

+ 0,920
Hg
 +
2ē
= 2Hg
+
2ē
= 2Hg+ 0,797
Hg 2+ + 2ē = Hg
+ 0,851
HgО + Н2О + 2ē = Hg + 2ОН–
+ 0,098
Hg2О + Н2О + 2ē = 2Hg + 2ОН–
+ 0,123
I
2IO
 + 12H+
+ 10ē
= I2
+ 6H2O
+ 12H+
+ 10ē
= I2
+ 6H2O+ 1,195
2IO – + 4H+ + 2ē = I2 + 2H2O
+ 1,10
HIO + H+ + 2ē = I– + H2O
+ 0,987
IO – + H2O + 2ē = I– + 2OH–
+ 0,485
IO
 + 6H+
+ 6ē
= I–
+ 3H2O
+ 6H+
+ 6ē
= I–
+ 3H2O+ 1,085
IO
 + 2H2O+
4ē =
IO –
+ 4OH–
+ 2H2O+
4ē =
IO –
+ 4OH–+ 0,15
IO
 + 3H2O+
6ē =
IO –
+ 6OH–
+ 3H2O+
6ē =
IO –
+ 6OH–+ 0,26
I2 + 2ē = 2I–
+ 0,54
2HIO + 2H+ + 2ē = I2 + 2H2O
+ 1,439
In
In 3+ + 3ē = In
– 0,338
Ir
Ir 3+ + 3ē = Ir
+ 1,156
Fe
Fe2+ + 2ē = Fe
– 0,44
Fe3+ + 3ē = Fe
– 0,036
Fe(OH)3 + 1ē = Fe(OH)2 + OH–
– 0,56
Fe2O3 + 4H+ + 2ē = 2FeOH+ + H2O
+ 0,16
К
К+ + 1ē = К0
– 2,924
Lа
Lа3+ + 3ē = Lа0
– 2,379
Li
Li+ + 1ē = Li0
– 3,045
Мg
Mg2+ + 2ē = Mg0
– 2,363
Mn
Mn2+ + 2ē = Mn0
– 1,18
MnO2 + 4H+ + 2ē = Mn2+ + 2H2O
+ 1,24
MnO
 + 8H+
+ 5ē
= Mn2+
+ 4H2O
+ 8H+
+ 5ē
= Mn2+
+ 4H2O+ 1,53
MnO
 + 1ē
= MnO
+ 1ē
= MnO
+ 0,56
MnO
 + 2H2O
+ 2ē
= MnO2
+ 4OH–
+ 2H2O
+ 2ē
= MnO2
+ 4OH–+ 0,60
MnO
 + 4H+ +
3ē =
MnO2
+ 2H2O
+ 4H+ +
3ē =
MnO2
+ 2H2O+ 1,679
MnO
 +
2H2O
+ 3ē
= MnO2
+ 4OH–
+
2H2O
+ 3ē
= MnO2
+ 4OH–+ 0,595
Mn(OH)2 + 2ē = Mn + 2OH–
– 1,56
Mn(OH)3 + 1ē = Mn(OH)2 + OH–
+ 0,15
Mn2O3 + 6H+ + 2ē = 2Mn2+ + 3H2O
+ 1,485
Мо
Mо3+ + 3ē = Mо0
– 0,200
N
NO
 + 2H+
+ 1ē
= NO2
+ H2O
+ 2H+
+ 1ē
= NO2
+ H2O+ 0,77
N2 + 2H2O + 6H+ + 6ē = 2NH4OH
+ 0,092
3N2 + 2H+ + 2ē = 2HN3
– 3,09
N2H
 +
3H+
+ 2ē
= 2NH
+
3H+
+ 2ē
= 2NH
+ 1,275
N2O + 2H+ + 2ē = N2 + H2O
+ 1,766
N2O4 + 2ē = 2NO

+ 0,867
N2O4 + 2H+ + 2ē = 2HNO2
+ 1,065
N2O4 + 4H+ + 4ē = 2NO + 2H2O
+ 1,035
2NO + 2H+ + 2ē = N2O + H2O
+ 1,591
2NO + H2O + 2ē = N2O + 2OH–
+ 0,76
HNO2 + H+ + 1ē = NO + H2O
+ 0,983
NO
 +
3H+
+ 2ē
= HNO2
+ H2O
+
3H+
+ 2ē
= HNO2
+ H2O+ 0,94
NO
 + 2H+
+ 2ē
= NO
+ 2H+
+ 2ē
= NO +
H2O
+
H2O+ 0,84
NO
 + H2O
+ 1ē
= NO + 2OH–
+ H2O
+ 1ē
= NO + 2OH–– 0,46
NO
 + 4H+
+ 3ē
= NO + 2H2O
+ 4H+
+ 3ē
= NO + 2H2O+ 0,96
2NO
 + 2H2O
+ 4ē
= N2O
+ 2H2O
+ 4ē
= N2O + 4OH–
+ 4OH–– 0,18
2NO
 + 3H2O
+ 4ē
= N2O
+ 6OH–
+ 3H2O
+ 4ē
= N2O
+ 6OH–+ 0,15
2NO
 + 2H2O
+ 2ē
= N2O4
+ 4OH–
+ 2H2O
+ 2ē
= N2O4
+ 4OH–– 0,85
2NO
 + 4H+
+ 2ē
= N2O4
+ 2H2O
+ 4H+
+ 2ē
= N2O4
+ 2H2O+ 0,803
NO
 + H2O
+ 2ē
= NO
+ H2O
+ 2ē
= NO + 2OH–
+ 2OH–+ 0,01
Na
Na+ + 1ē = Na
– 2,714
Ni
Ni2+ + 2ē = Ni
– 0,257
О
O2 + 2H2О + 4ē = 4OH–
+ 0,40
O2 + 2H+ + 2ē = H2O2
+ 0,69
O2 + 4H+ + 4ē = 2H2O
+ 1,229
O2 + 2H2O + 2ē = H2O2 + 2OH–
– 0,146
O3 + 2H+ + 2ē = H2O + O2
+ 2,076
O3 + 2H2O + 2ē = O2 + 2OH–
+ 1,24
P
H3PO4 + 2H+ + 2ē = H3PO3 + H2O
– 0,28
H3PO4 + 5H+ + 5ē = P + 4H2O
– 0,41
Р + 3Н2О + 3ē = РН3 + 3ОН–
– 0,87
H3PO2 + H+ + 1ē = P + 2H2O
– 0,508
H3PO3 + 2H+ + 2ē = Н3PО2 + H2O
– 0,499
H3PO3 + 3H+ + 3ē = P + 3H2O
– 0,454
РО
 + 2Н2О + 2ē = НРО
+ 2Н2О + 2ē = НРО + 3ОН–
+ 3ОН–– 1,05
Pd
Pd 2+ + 2ē = Pd
+ 0,951
Pb
[Pb(OH)4]2– + 2ē = Pb + 4OH–
– 0,52
PbO2 + 4H+ + 2ē = Pb2+ + 2H2O
+ 1,46
PbO2 + 2ē = PbO

+ 1,70
Pb2+ + 2ē = Pb
– 0,126
Ро
Pо4+ + 4ē = Pо
+ 0,760
Рt
Рt 2+ + 2ē = Рt
+ 1,190
Ra
Ra 2+ + 2ē = Ra
– 2,800
Rb
Rb+ + 1ē = Rb
– 2,925
Re
Rе 3+ + 3ē = Rе
+ 0,300
Rh
Rh 2+ + 2ē = Rh
+ 0,600
Rh 3+ + 3ē = Rh
+ 0,758
Ru
Ru 2+ + 2ē = Ru
+ 0,455
S
S + 2ē = S2–
– 0,48
S + H2О + 2ē = HS– + ОН–
– 0,478
SO
 + 10H+
+ 8ē
= H2S
+ 4H2O
+ 10H+
+ 8ē
= H2S
+ 4H2O+ 0,30
S + 2H+ + 2ē = H2S
+ 0,142
SO2 + 4H+ + 4ē = S + 2H2O
+ 0,45
SO
 + 4H+
+ 2ē
= SO2
+ 2H2O
+ 4H+
+ 2ē
= SO2
+ 2H2O+ 0,16
SO
 + 8H+
+ 6ē
= S + 4H2O
+ 8H+
+ 6ē
= S + 4H2O+ 0,35
2SO
 +
2Н2О + 2ē
= S2О
+
2Н2О + 2ē
= S2О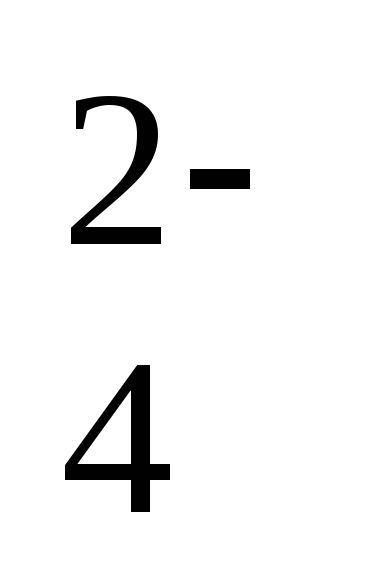 + 4ОН–
+ 4ОН–– 1,12
2 SO
 +
3Н2О + 4ē
= S2О
+
3Н2О + 4ē
= S2О + 6ОН–
+ 6ОН–– 0,571
SO
 + 4Н+ +
2ē
= Н2SО3
+ Н2О
+ 4Н+ +
2ē
= Н2SО3
+ Н2О+ 0,172
2SO
 + 4Н+ +
2ē
= S2О
+ 4Н+ +
2ē
= S2О + 2Н2О
+ 2Н2О– 0,22
SO
 + 8H+
+ Cu2+
+ 8ē
= CuS + 4H2O
+ 8H+
+ Cu2+
+ 8ē
= CuS + 4H2O+ 0,42
SO
 + 2H+
+ 2ē
= SO
+ 2H+
+ 2ē
= SO + H2O
+ H2O– 0,10
Se
SeO
 + 2H+
+ 2ē =
SeO
+ 2H+
+ 2ē =
SeO + H2O
+ H2O+ 1,15
Sn
Sn 2+ + 2ē = Sn
– 0,136
Sn 4+ + 2ē = Sn2+
+ 0,151
SnО2 + 4Н+ + 2ē = Sn2+ + 2Н2О
– 0,094
SnО2 + 4Н+ + 4ē = Sn + 2Н2О
– 0,117
Sr
Sr 2+ + 2ē = Sr
– 2,868
Та
Та3+ + 3ē = Та
– 0,600
Тс
Тс2+ + 2ē = Тс
+ 0,400
Тi
Тi2+ + 2ē = Тi
– 1,630
Тi3+ + 1ē = Тi2+
– 0,900
ТiО2 + 4Н+ + 2ē = Тi2+ + 2Н2О
– 0,502
Тi3+ + 3ē = Тi
– 1,370
ТiОН3+ + Н+ + 1ē = Тi3+ + Н2О
– 0,055
Тl
Тl+ + 1ē = Тl
– 0,336
Тl3+ + 2ē = Тl+
+ 1,252
Тl3+ + 3ē = Тl
+ 0,741
Тl2О3 + 3Н2О + 4ē = 2Тl+ + 6ОН–
+ 0,020
ТlОН + 1ē = Тl + ОН–
– 0,340
Тl(ОН)3 + 2ē = ТlОН + 2ОН–
– 0,050
Y
Y 3+ + 3ē = Y
– 2,372
Zn
Zn 2+ + 2ē = Zn
– 0,762
ZnО + Н2О + 2ē = Zn + 2ОН–
– 1,260
Zn(ОН)2 + 2ē = Zn + 2ОН–
– 1,249
Zr
Zr 4+ + 4ē = Zr
– 1,580
