
- •Работа 1 окислительно-восстановительные реакции
- •Основные теоретические положения
- •Порядок выполнения работы
- •Контрольные задания Вариант 1
- •Вариант 2
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Работа 2 гальванические элементы
- •Основные теоретические положения
- •Порядок выполнения работы
- •Экспериментальные и расчетные данные
- •Контрольные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •1. Никелевый и кобальтовый электроды помещены в растворы их солей. В каком соотношении должны быть взяты концентрации ионов данных металлов, чтобы их потенциалы были одинаковыми?
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Электролиз
- •Основные теоретические положения
- •Порядок выполнения работы
- •Часть 1. Определение электрохимического эквивалента меди
- •Часть 2. Газометрический метод определения выхода продуктов электролиза по току
- •Экспериментальные и расчетные данные для определения электрохимического эквивалента меди
- •Экспериментальные и расчетные данные для процесса электролиза раствора гидроксида натрия
- •Часть 3. Электрохимическое цинкование
- •Экспериментальные и расчетные данные для процесса цинкования
- •Часть 1. Определение электрохимического эквивалента меди
- •Часть 2. Газометрический метод определения выхода продуктов электролиза по току
- •Часть 3. Электрохимическое цинкование
- •Контрольные задания
- •Коррозия металлов
- •Основные теоретические положения
- •Порядок выполнения работы
- •Контрольные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Определение электропроводимости раствора уксусной кислоты
- •Основные теоретические положения
- •Порядок выполнения работы
- •Контрольные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Библиографический список
- •Третьяков ю.Д. Практикум по неорганической химии: Учеб. Пособие. – м.: Академия, 2004.
- •Стандартные электродные потенциалы окислительно-восстановительных систем в водных растворах
- •Приложение 2 Метрологическая карта средств измерения
- •Давление насыщенного водяного пара при различных температурах
- •Подвижности ионов при 25°с и бесконечном разведении
- •Часть 3
- •162600, Г. Череповец, пр. Луначарского, 5
Часть 1. Определение электрохимического эквивалента меди
1. Запишите уравнения процессов, протекающих на аноде и катоде, а также суммарную реакцию.
2. Рассчитайте изменение массы катода в результате эксперимента по формуле
∆mэксп = mкон – mнач , г.
3. Вычислите опытную величину электрохимического эквивалента меди по уравнению
kЭ(опыт)
=
![]() , г/Кл.
, г/Кл.
4. Рассчитайте молярную массу эквивалента меди по формуле (1)
МЭ(Cu) =
![]() ,
г/моль.
,
г/моль.
5. Оцените теоретическую величину электрохимического эквивалента меди по уравнению (13)
kЭ(теор)
=
![]() ,
г/Кл.
,
г/Кл.
6. Вычислите относительную погрешность каждого опыта
П
=
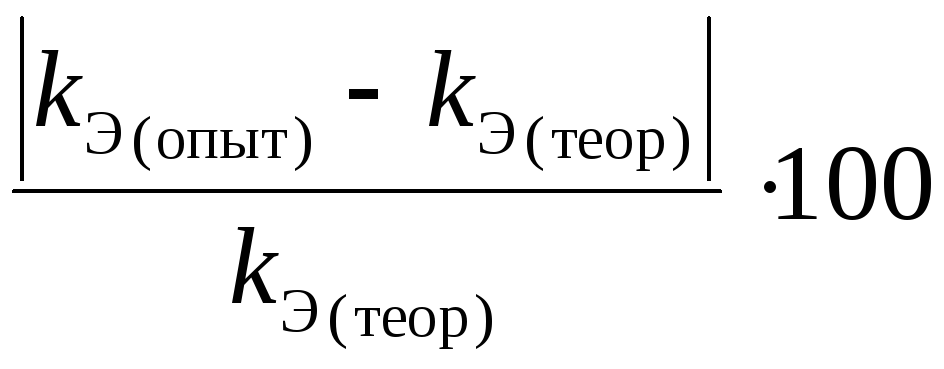 ,
%
,
%
7. Расчетные данные занесите в табл. 2, заполните метрологическую карту средств измерения и сформулируйте выводы.
Часть 2. Газометрический метод определения выхода продуктов электролиза по току
1. Запишите уравнения процессов, протекающих на аноде и катоде, а также суммарную реакцию.
2.
Поскольку водород и кислород в эвдиометрах
собирают над водным раствором, то по
закону Дальтона измеренное при помощи
барометра давление в лаборатории Р
равно сумме давлений чистого водорода
Р![]() или кислорода Р
или кислорода Р![]() и насыщенного водяного пара Р
и насыщенного водяного пара Р![]()
![]() ,
Па
,
Па
![]() ,
Па
,
Па
Тогда расчет парциального давления водорода и кислорода следует вести по формулам
![]() ,
Па
,
Па
![]() ,
Па
,
Па
Значения
![]() при различных температурах приведены
в приложении 3.
при различных температурах приведены
в приложении 3.
3. Определите объемы водорода и кислорода при н.у., используя выражение объединенного газового закона
V![]() (Н2)
=
(Н2)
=![]() ,
см3
,
см3
V![]() (О2)
=
(О2)
=![]() ,
см3
,
см3
где Т ° – температура при н.у., равная 273 К; Р° – парциальное давление при н.у., равное 101325 Па.; Т – температура в лаборатории, К.
4. Вычислите теоретические объёмы газов при н.у. по закону Фарадея [формула (12)]
V![]() (Н2)
=
(Н2)
=
![]() ,
см3
,
см3
V![]() (О2)
=
(О2)
=
![]() ,
см3
,
см3
где
![]() -
эквивалентный объем водорода при н.у.,
который равен 11200 см3/моль;
-
эквивалентный объем водорода при н.у.,
который равен 11200 см3/моль;
![]() -
эквивалентный объем кислорода при н.у.,
который равен 5600 см3/моль.
-
эквивалентный объем кислорода при н.у.,
который равен 5600 см3/моль.
5. Определите коэффициент выхода по току для водорода и кислорода по формуле (10)
 %
%
 %
%
6. Расчетные данные внесити в таблицу 3, заполните метрологическую карту средств измерения и сформулируйте выводы.
Часть 3. Электрохимическое цинкование
1. Запишите уравнения процессов, протекающих на аноде и катоде, а также суммарную реакцию.
2. Рассчитайте изменение массы катода в результате эксперимента по формуле
∆mэксп = mкон – mнач , г.
3. Вычислите опытную величину электрохимического эквивалента цинка по уравнению
kЭ(опыт)
=
![]() , г/Кл.
, г/Кл.
4. Рассчитайте молярную массу эквивалента цинка по формуле (1)
МЭ(Zn) =
![]() ,
г/моль.
,
г/моль.
5. Оцените теоретическую величину электрохимического эквивалента цинка по уравнению (13)
kЭ(теор)
=
![]() ,
г/Кл.
,
г/Кл.
6. Вычислите относительную погрешность каждого опыта
П
=
 ,
%
,
%
7. Вычислите теоретическую массу цинкового покрытия по формуле (11)
∆mтеор
![]() ,
г.
,
г.
8. Коэффициент выхода по току для обоих опытов рассчитайте по уравнению (10)
![]() .
.
9. Расчетные данные внести в табл. 4, заполните метрологическую карту средств измерения и сформулируйте выводы.
