
- •1.Представление о белках как важнейшем классе органичских веществ и структурно-функциональном компоненте организма человка.
- •2.Аминокислоты,входящие в состав белков,их строение и свойства. Пептидная связь. Первичная структура белков. Зависимость биологических свойств от первичной структкры.
- •4. Четвертичная стуктурабелков. Особенности строения и функционирования олигомерных белков на примере гемсодержащих белков и их денатурация.
- •6.Многообразие белков. Глобулярные и фибриллярные белки.
- •4. Соотношение полярных и неполярных групп на поверхности нативных молекул белков
- •5. Растворимость белков
- •22.Строение нуклеиновых кислот. Связи, формирующие структуру днк, рнк. Строение хроматина и рибосом.
- •25 Транскрипция
- •26. Трансляция
- •27. Свойства биологического кода.
- •28. Теория оперона. Функционирование оперонов, регулируемых по механизму индукции и репрессии.
- •29. Молекулярные механизмы генетической изменчивости. Молекулярные мутации: замены,делеции,вставки нуклеотидов
- •30.Основные пищевые вещества-углеводы, жиры, белки,суточная потребность.
- •31. Незаменимые аминокислоты: пищевая ценность разных белков
- •32. Витамины. Классификация витаминов.
- •1. Витамины, растворимые в жирах
- •3. Витаминоподобные в вещества
- •33.Функции витаминов. Алиментарные и вторичные авитаминозы гиповитаминозы. Гипервитаминоз.
- •34. Витаминзависимые и витаминрезистентные состояния.
- •35. Биохимическая характеристика патогенеза рахита
- •36. Биохимическая характеристика гипервитаминозов а и д
- •37. Понятие о метаболизме,метаболических путях. Ферменты и метаболизм. Понятие регуляции метаболизма.
- •39.Основные мембраны клетки и их функции. Общие свойства мембран:жидкостность, поперечная ассиметрия, избирательная проницаемость
- •40. Липидный состав мембран- фосфолипиды, гликолипиды, холестерин.
- •41. Роль липидов в формировании бислоя.
- •42. Участие фосфолипаз в обмене фосфолипидов.
- •43. Белки мембран: интегральные, поверхностные, заякоренные.
- •46. Эндэргонические и экзэргоническиг реакции в живой клетке. Макроэргические соединения.
- •50. Окислительное фосфорилирование, коэффициент p/о.
- •51. Строение митохондрий и структурная организация дыхательной цепи.
- •52. Разобщение тканевого дыхания и окислительного фосфорилирования. Терморегуляторные функции тканевого дыхания.
- •53. Нарушения энергетического обмена: гипоэнергетические состояния как результат гипоксии, гипоавитаминоза и др. Причин.
- •55. Цикл лимонной кислоты.
- •56.Механизмы регуляции цитратного цикла
- •57 Основные углеводы животных,их содержание в тканях, биологическая роль. Основные углеводы пищи. Преваривание углеводов.
- •58.Глюкоза как важн. Метаболит углеводного обмена:общая схема источников и путей расходования глюкозы в организма.
- •59. Катаболизм глюкозы. Аэробный распад
- •60Распространение и физиологическое значение аэробного распада глюкозы.
- •62Аэробный распад глюкозы.Гликолитическая оксидоредукция
- •63. Распространение и физ значение анаэробного распада глюкозы
- •64.Биосинтез глюкозы.
- •65. Цикл Кори
- •66. Представление о пентозофосфатном пути превращения глюкозы
- •70.Роль инсулина ,глюкагона,адреналина в обмене ув
- •73.Важнейшие липиды тканей человека. Резервные липиды и липиды мембран.
- •74.Жирные кислоты липидов тканей человека.
- •75.Эссенциальные жирные кислоты:омега6,3-кислоты как предшественники синтеза эйкозаноидов.
- •76. Биосинтез жирных кислот.
- •78.Биосинтез и использование кетоновых тел в качестве источника энергии
- •80.Ресинтез трацилглицеридов в стенке кишечника. Образование хиломикронов. Транспорт жиров.
- •82.Состав и строение транспортных липопротеидов крови
- •83.Депонирование и мобилизация жиров: регуляция синтеза и мобилизация жиров. Роль инсулина ,глюкагона и адреналина.
- •84.Основные фосфолипиды и гликолипиды тканей человека. Глицерофосфолипиды.
- •85.Обмен стероидов. Холестерин как предшественник ряда других стероидов. Представление о биосинтезе холестерина
- •86. Выведение желчных кислот и холестерина из организма
- •104.Роль гормонов в системе регуляции метаболизма. Клетки-мишени и клеточные рецепторы гормонов.
- •105. Механизмы передачи гормональных сигналов в клетке.
- •1. Передача гормональных сигналов через мембранные рецепторы
- •2. Передача сигналов через внутриклеточные рецепторы
- •106. Классификация гормонов по биологическому строению и биологическим функциям.
- •107.Изменение гормонального статуса и метаболизма при сахарном диабете.
- •108. Патогенез основных симптомов сахарного диабета
- •109. Регуляция водно-солевого обмена. Строение и функции альдостерона и вазопрессина.
- •110.Система ренин-ангиотензин-альдостерон. Биохимические механизмы возникновения почечной гипертонии.
- •111.Роль гормонов в регуляции обменов кальция и фосфатов.
- •112. Причины и проявления рахита, гипо и гиперпаратироидизма.
- •113. Изменение метаболизма при гипо и гипертиреозе.
- •114. Половые гормоны: строение,влияние на обмен веществ.
- •115.Распад гема
- •116.Нарушение обмена билирубина
- •117.Диагностическое значение определения билирубина
- •118.Токсичность кислорода:образование активных форм
- •119. Повреждение мембран в результате перекисного окисления липидов.
- •120.Полиморфные формы гемоглобина
- •122.Распад Гемма.Обезвреживание билирубина
- •Этапы метаболизма билирубина в организме
- •Превращение в кишечнике
- •123.Нарушение обмена билирубина:желтухи
- •124.Основные свойства белковых фракций крови и значение их определения для диагностики заболеваний. Энзимодиагностика.
- •125. Коллаген: особенности аминокислотного состава, первичной и пространственной структуры.
- •127.Гликозаминогликаны и протеогликаны. Строение и функции.
- •128. Особенности энергетического обмена в мышцах. Креатинфосфат.
- •130.Медиаторы:катехоламины,серотонин,гамма-аминомасляная кислота,глутаминовая кислота,глицин,гистамин.
46. Эндэргонические и экзэргоническиг реакции в живой клетке. Макроэргические соединения.
С позиций термодинамики, метаболизм представляет собой совокупность процессов, в которой реакции, потребляющие энергию из внешней среды (эндэргонические), сопрягаются с энергодающими (экзэргоническими) реакциями, что позволяет живым существам оказывать постоянное сопротивление нарастанию энтропии. Экзергонические реакции – химические реакции с высокой константой равновесия и отрицательной величиной G, эндергонические – с низкой константой равновесия и положительной величиной G (они обычно не протекают спонтанно). Для начала и завершения этих реакция необходим приток энергии извне. В живых системах экзергонические процессы обычно сопряжены с эндергоническими реакциями, обеспечивая последние необходимым количеством энергии. - экзэргонические реакции , которые сопровождаются выделением энергии; энергия аккумулируется в виде макроэргических соединений;
- эндэргонические реакции , для протекания которых необходимы затраты энергии (реакции синтеза и восстановления) Макроэргические соединения – это вещества, содержащие богатые энергией связиПонятие макроэргическая
связь довольно условно и применяется для обозначения тех связей, которые гидролизуются в
водной среде с выделением значительной энергии. Так, гидролиз концевой фосфоангидрид-
ной связи АТФ (АТФ + Н2О → АДФ + Фн), ведет к освобождению 34,5 кДж/моль энергии).
Однако, если реакция протекает в неводной среде (например, в липидном слое мембран), то
образование и разрушение АТФ протекает без больших затрат энергии.
Вещества гидролиз которых, приводит к высвобождению более 21 кДж/моль энергии от-
носят к высокоэнергетическим (макроэргам), а вещества освобождающие меньшие количе-
ства энергии - к низкоэнергетическим. К макроэргам относят: АТФ, другие трифосфаты нук-
леозидов (ГТФ, ЦТФ, УТФ, ТТФ), аргининфосфат, креатинфосфат, ацетилфосфат, 1,3-
дифосфоглицерат, фосфоенолпируват и др. К низкоэнергетическим - глюкозо-6-фосфат, глюкозо-1-фосфат, глицерофосфат и другие. Уникальная роль АТФ состоит в том, что она
имеет промежуточное значение энергии гидролиза и выполняет роль связующего звена (раз-
менной монеты) между высоко- и низкоэнергетическими соединениями.
Для протекания эндэргонических реакций необходим внешний источник энергии. Реакции, характеризующиеся высокой константой равновесия К и отрицательной величиной стандартного изменения свободной энергии ΔG, называются экзергоническими. Реакция с очень низкой константой равновесия и, следовательно, с положительной величиной стандартного изменения свободной энергии не протекает спонтанно и не завершается при стандартных условиях без притока энергии извне. Такие процессы называются эндергоническими. В биологических системах эндергонические процессы должны быть сопряжены с экзергоническими таким образом, чтобы эндергонические процессы получали необходимую для своего течения энергию от экзергонических процессов. В подобного рода сопряженных системах эндергонический процесс может осуществляться только при условии, что уменьшение свободной энергии сопряженного с ним экзергонического процесса превышает прирост свободной энергии данного эндергонического процесса.
48.НАД-зависимые и флавиновые дегидрогеназы
Никотинамидзависимые дегидрогеназы содержат в качестве коферментов NAD+ или NADP+ (см. раздел 2). NAD+ и NADP+ - производные витамина PP. Эти коферменты входят в состав активных центров дегидрогеназ, но могут обратимо диссоциировать из комплекса с апоферментами и включаются в состав фермента в ходе реакции. Субстраты NAD- и NADP-зависимых дегидрогеназ находятся в матриксе митохондрий и в цитозоле. Рабочей частью никотинамидных коферментов служит никотинамид (рис. 6-5). Большинство дегидрогеназ, поставляющих электроны в ЦПЭ, содержат NAD+. Они катализируют реакции типа: R-CHOH-R1 + NAD+↔ R-CO-R1 + NADH + Н+.
Таким образом, NAD+, присоединяя протоны и электроны от различных субстратов, служит главным коллектором энергии окисляемых веществ и главным источником электронов, обладающих высоким энергетическим потенциалом, для ЦПЭ.
Флавиновые дегидрогеназы содержат в качестве коферментов FAD или FMN. Эти коферменты образуются в организме человека из витамина В2 (см. раздел 2). Флавиновые коферменты прочно связаны с апоферментами. Рабочей частью FAD и FMN служит изоаллоксазиновая сопряжённая циклическая система (рис. 6-6).
FAD служит акцептором электронов от многих субстратов в реакциях типа: R-CH2-CH2-R1 + Е (FAD) ↔ R-CH=CH-R1 + Е (FADH2), где Е - белковая часть фермента.
Большинство FAD-зависимых дегидрогеназ - растворимые белки, локализованные в матриксе митохондрий. Исключение составляет сукцинат-дегидрогеназа, находящаяся во внутренней мембране митохондрий. К FMN-содержащим ферментам принадлежит NADH-дегидрогеназа, которая также локализована во внутренней мембране митохондрий; она окисляет NADH, образующийся в митохондриальном матриксе.
49.НАДНдегидрогеназа,убихинондегидрогеназа
Перенос электронов от NADH к О2 включает ряд переносчиков, которые локализованы во внутренней мембране митохондрий. За исключением убихинона и цитохрома С, это сложные белковые комплексы. NADH-дегидрогеназа (NADH-Q-редуктаза, комплекс I) состоит из нескольких полипептидных цепей. Роль простетической группы играет FMN. Единственный субстрат фермента - NADH, с которого 2 электрона и протон переносятся на FMN с образованием FMNH2. Второй протон поглощается из матрикса. Реакция протекает по уравнению: NADH + Н+ + Е (FMN) → NAD+ + Е (FMNH2)
С FMNH2 электроны переносятся затем на ряд железо-серных белков (FeS), играющих роль второй простетической группы в молекуле NADH-дегидрогеназы. Атомы железа в этих белках (негемовое железо) собраны в несколько групп, так называемых железо-серных центров. FeS-центры входят в состав многих белков (флавопротеинов, цитохромов), участвующих в окислительно-восстановительных реакциях. Известны 3 типа FeS-центров (FeS, Fe2S2, Fe4S4), в которых атом железа связан с атомом серы остатков цистеина или неорганической серы. Строение железо-серных центров показано на рис. 6-7. NADH-дегидрогеназа содержит несколько центров типа Fe2S2 и Fe4S4 Атомы железа в таких центрах могут принимать и отдавать электроны поочерёдно, переходя в ферро- (Fe2+) и ферри- (Fe3+) состояния. От железо-серных центров электроны переносятся на кофермент Q (убихинон)
Молекулы убихинона в зависимости от источника, из которого они выделены, различаются длиной углеводородной цепи, которая у млекопитающих содержит 10 изопреноидных звеньев и обозначается как Q10. В процессе переноса электронов с NADH-дегидрогеназы через FeS на убихинон он обратимо превращается в гидрохинон. Убихинон выполняет коллекторную функцию, присоединяя электроны от NADH-дегидрогеназы и других флавинзависимых дегидрогеназ, в частности, от сукцинат-дегидрогеназы. Убихинон участвует в реакциях типа:
Е (FMNH2) + Q → Е (FMN) + QH2.

Рис. 6-6. Структурные формулы рабочей части коферментов FAD и FMN. В ходе реакции FAD и FMN присоединяют 2 электрона и, в отличие от NAD+, оба теряемых субстратом протона.
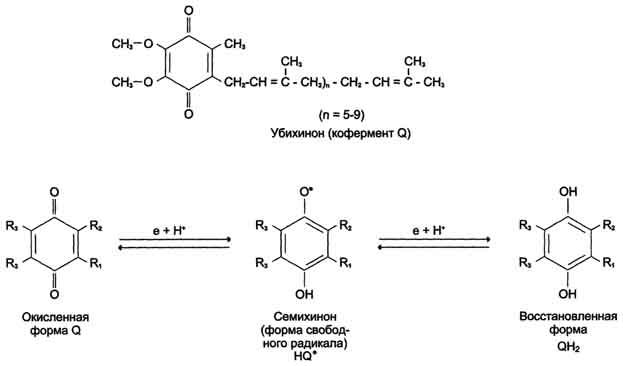
Рис. 6-8. Структура убихинона (кофермента Q). n - число изопреноидных звеньев. Убихинон может принимать один электрон и превращаться в семихинон или 2 электрона и полностью восстанавливаться в гидрохинон (убихинол).
