
- •5.Методи отримання генів
- •Фосфоромідитний метод
- •Синтез на матричної рнк за допомогою зворотної транскрипції.
- •Одержання генів із природного матеріалу (днк) за допомогою рестриктаз.
- •6.Визначення довжини нуклеотидного фрагмента Метод Сенджера ( ферментативне секвенування)
- •8) Вектори на основі фага Лямбда Лямбда
- •9) Адаптери та лінкери
- •10) Методи введення днк в клітину
- •Ферменти які синтезують фрагменти днк на матриці рнк.
- •Ферменти, які застосовуються для приготування гібридизаційних проб.
- •11) Вектори впровадження
- •16) Рестрикційні карти
- •17) Бібліотека генів (клонотека)
- •18) Метод «Прогулянка по хромосомі»
- •19) Дріжджові вектори
- •20) Як поєднати тупі (липкі) кінці
- •21) Як підтвердити ефективність трансляції чужорідного генетичного матеріалу
- •22) Метод вдосконалення векторів
- •23) Ідентифікація клонів
- •24) Типи векторів
- •25) Перспективи використання гі в сучасній селекції.
- •26) Полімеразна ланцюгова реакція
- •27) Метод з’єднання франментів днк в гібридній молекулі.
- •28) Введення в рослинну клітину (без векторів)
- •29) Вектори на основі віруса cb-4o
22) Метод вдосконалення векторів
Щоб з'єднати модифікаційні фрагменти з вектором, використовують 2 види методів:
-
метод, що базується на застосуванні ДНК-лігази;
-
конкретний метод.
1). Наявність липких кінців дозволила застосовувати ДНК-лігазу (E. Coli і фага Т4) для її з'єднання. Для тупих кінців застосовуються лінкери та адаптери.
Лінкер (linker) - коротка дволанцюгова молекула ДНК (олігонуклеотид), що містить який-небудь сайт рестрикції; використовуються в генній інженерії для з'єднання векторної плазмиди та клонованої послідовності ДНК, до кінців якої за методом зшивання тупих кінців приєднані линкери. Сайтів рестрикції в линкері може бути кілька.
Адаптер - це одно- чи дволанцюгові олігонуклеотиди, які призначені для об'єднання молекул з несумісними кінцями.
Рестректази діють тільки на двуланцюговую ДНК.
2). Конкретний метод уперше розроблений Бергом. Його можна застосовувати незалежно від природи і способу одержання фрагментів; високий вихід рекомбінантних молекул; превага – виключається можливість утворення вихідних молекул.
Недоліки: вбудований фрагмент важко вирізати точно (залишаються послідовності по краях), гомополімерні послідовності приводять до нестабільності такої ДНК і можуть впливати на експресію гена, а також змінювати сайти рестрикції.
23) Ідентифікація клонів
Методи ідентифікації
Вибір клонів проводять в дві стадії:
-
відбір клонів, які не несуть необхідний вектор;
-
пошук клітин, які несуть відповідний ген.
Залежно від того експресується ген чи ні, використовують різні методи ідентифікації. Якщо не експресується, то для його пошуку використовують методи секвенування або методи гібридизації колоній. Якщо ген експресується, то використовується візуальний добір, виникнення селективних середовищ, або використовуються імунологічні методи.
-
Метод прямої імуноселекції - на чашки із середовищем висівають рДНК, у середовищі перебувають антитіла до певного білка (продукту рДНК). Після утворення колоній, клітини лізують за допомогою фага або за допомогою лизоцима. Навколо колоній, які продукували цей білок утворяться кільця преципітації.
-
Метод радіоімунодетекції — колонії бактерій з рДНК лізиують на поверхні твердого середовища. До цієї чашки притискають диски зі специфічними АТ. Відповідні АГ зв'язуються з АТ і залишаються на диску. Пластинку обробляють тими ж АТ, але міченими І125. Утвориться комплекс АТ-АГ-АТ, проводять радіоавтографію і визначають.
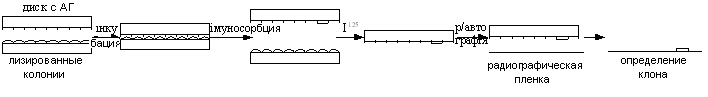
24) Типи векторів
Вектори на основі плазмід
Дають можливість одержувати від декількох десятків до декількох тисяч векторів молекул на клітину. Використовуються плазміди з ослабленим контролем. У плазмідні вектори можна включити фрагменти будь-яких розмірів, але не більше 15000 нукл. (втрачається стабільність).
Фагові вектори
Фагові вектори більш ефективні для клонування великих фрагментів ДНК. Відбір іде безпосередньо за утворенням бляшок на газоні чутливих клітин-хазяїв. Найрозповсюдженими векторами для E. coli є бактеріофаг λ і М13.
Бактеріофаг λ може існувати в 4-х різних формах:
-
лінійна - геном перебуває всередині фагової частки;
2) кільцева - утворюється після введення фага в клітину;
3) інтегрована форма - лінійна ДНК профага є пермутованою відносно ДНК фагової частки.
4) конкатемерна форма - виникає під час реплікації ДНК фага λ по типу колеса, що котиться.
На основі бактеріофага λ були сконструйовані його похідні.
-
Косміди - являють собою невеликі плазміди, в які in vitro введені cos-сайти ДНК фага λ. Звідси відбувається назва всього типу даних векторів (cosmid). В ДНК нормальних фагових часток cos-сайти розташовані на кінцях молекул, вони розділяють мономери фагової ДНК в конкатемерах, що поєднують кілька з'єднаних "голова до хвоста" мономерів, які є попередниками зрілих фагових ДНК перед упакуванням у фагові частки. В таких конкатемерах сусідні cos-сайти розташовуються на відстані 35-45 т.н.п. друг від друга і містять між собою весь фаговий геном. У процесі упаковування cos-сайти впізнаються компонентами ферментативної системи і по них відбувається послідовне відрізання упакованої у фагову частку лямбда-ДНК від іншої із ДНК конкатемера.
-
Фазміди - являють собою векторні молекули ДНК, які містять в собі генетичні елементи плазмід і хромосом бактеріофагів. Вони можуть мати ємність у відношенні до клонованої ДНК, характерної для лямбда-векторів, і існувати в певних умовах в бактеріальних клітинах у вигляді плазміди або ж упаковуватися у фагові частки in vivo при зміні цих умов.
Вектори на основі фага М13
М13 – фаг E.coli (коліфаг), що містить кільцеву одноланцюгову молекулу ДНК. М13 фаги інфікують тільки штами E. coli з F-пілями, що містять F-фактор. Клітини E. coli з фагом не лізують, але ростуть повільно. Після проникнення одноланцюгової ДНК фага в клітину вона перетворюється у двуланцюгову реплікативну форму, що швидко розмножується доти, поки не накопичиться кодуємий фагом специфічний білок, що зв'язується з ДНК та зупиняє синтез комплементарного ланцюга ДНК. Після цього тільки та одноланцюгова ДНК продовжує синтезуватись, що запаковується на клітинній мембрані хазяїна в капсидні білки. Потім зформовані фаги вивільняються з клітини. Численні похідні М13 використовуються в якості клонуючих векторів.
Конструювання човникових векторів
Човниковий вектор - плазмідний клонуючий вектор, що містить послідовності ДНК, які дозволяють його селекцію та автономну реплікацію у двох різних організмах - хазяях різних біологічних видів (напр., S. cerevisiae та E. coli або A.tumefaciens й E. coli).
Вони мають 2 ділянки ori (сайт початку реплікації). Принципи конструювання та функціонування човникових векторів однакові, вони повинні містити в собі реплікони тих генетичних систем, у яких буде відбуватися реплікація човникового вектора. При цьому використовуються області початку реплікації генетичних елементів, які автономно існують у внехромосомному стані в природних умовах.
Вектори на основі дріжджів
Sach. Сеrеvіsіае - один з найбільш вдалих об'єктів серед еукариотичних клітин.
В E. coli можуть функціонувати близько 20 генів дріжджів. Деякі з генів дріжджів комплементують мутації, які проходять в E. coli. У дріжджів є 3 типи плазмід:
-
2- мікронна
-
3- мікронна
-
мітохондріальна (24 мікрона)
2-мікронна плазміда найденна в багатьох штамів, кільцева, існує в кількості 50-60 копій на геном. ДНК її становить 3% від всієї ДНК. У нормі не інтегрує із дріжджовими хромосомами. Містить 2 інвертовані повтори на кінцях близько 600 п.н.
3-мікронна плазмида - розміри близько 9500 п.н., кількість копій у клітині ≈10. Як вектор застосовують рідко.
Мітохондріальна плазміда ~75000 п. н., кількість копій у клітині 1-50. Ділянки, що кодують, разделені більшими, що не кодують. Дріжджові вектори -це гібриди. Дріжджові плазміди - не мають селективних маркерів і їхнє використання як векторів стало можливим після того, як була відкрита можливість вбудовування в них хромосомних генів.
Типи векторів:
-
Вектори інтеграції YIр – бактеріальні вектори, оскільки дріжджова ДНК представлена одним з генів. Не здатні реплікуватись в дріжджових клітинах, але здійснюють їхню трансформацію шляхом інтеграції хромосом.
-
Еписомні вектори YЕр – сконструйовані на базі 2-мікронної ДНК (0-мікронна). Складається із плазмиди pBR322, реплікатора 2-мікронної ДНК і селективного дріжджового маркера. Ці вектори дозволяють клонувати чужорідні гени в клітинах E. сoli і потім досліджувати їхню експресію в дріжджових клітинах, не стабільні.
-
YRp або ARS – вектори, що мають хромосомні репликаторні послідовності (ARS-послідовності).
Будова ARS:
5′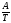 ТТТАТ
ТТТАТ
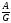 ТТТ
ТТТ
 3′
3′
Цих елементів може бути багато в хромосомі, ARS - вектори мають ділянку ori від дріжджового геному.
-
Мікрохромосома YСр – найбільш перспективний вектор для клонування. Містить ARS і CEN-послідовності (розмір 500 п. н.). CEN-послідовність - це центромери дріжджової хромосоми (регулюють кількість копій). Присутній дріжджовий ген як селективний маркер і дріжджові сайти рестрикції.
-
Лінійна мініхромосома YLр - у попередній вектор вводять додаткові теломерні ділянки (нуклеотидні послідовності на кінцях хромосоми). Це лінеаризована мініхромосома.
-
На основі еписомних векторів YEр були створені спеціальні експресуючі вектори – сендвич-вектори. Вони містять дріжджовий промотор, сайти рестрикції і термінатор транскрипції. Чужорідний ген ставлять під контроль сильного промотору і він починає добре експресуватись в E coli і у дріжджах.
Вектори на основі віруса SV 40
Вірус SV40 і вірус папіломи використовуються як вектори для клонування в клітинах тварин.
Вірус проникає в клітину, направляється до ядра, де відбувається його “роздягання” від капсида. Далі в строгій часовій послідовності починається його експресія. Транскрипція починається із сайта ori і йде в напрямку проти часової стрілки. Спочатку транскрибуються гени двох ранніх білків, малого й великого T-антигену, а потім пізні гени. Пізні гени транскрибуються за годинниковою стрілкою, cпочатку поблизу сайта ori. Далі відбувається зборка вірусу, і він вивільняється із клітини і клітина гине. Загальні принципи конструювання вектора SV40 аналогічні бактеріофагу λ:
-
видалення певних ділянок вірусного геному за допомогою рестриктаз;
-
Заміщення вірусної ДНК чуженородної ДНК.
Типи SV40-векторів:
-
трансдукуючі SV40-вектори - рекомбінанти SV40 і чужорідної ДНК. Їх вводять в клітини, які потім продукують нормальні вібріони;
-
плазмідні SV40-вектори - рекомбінанти, які здатні реплікуватися, але не запаковуватись;
-
пасивні трансформуючі вектори – рекомбінантні молекули, в які включені невеликі фрагменти SV40, які забезпечують експресію чужорідних генів. Вони не здатні не реплікуватись, не запаковуватись.
Вектори, створені на базі ДНК інших вірусів.
1). Вірус папіломи BPV-1. Відноситься до того ж роду, що й SV40, провокують утворення бородавок - доброякісних новотворів шкіри. Найбільш досліджений вірус папіломи бика. Характеризуються високою видоспецифічністью. Є оболонка - капсид. Геном представлений кільцевою двуланцюговою ДНК довжиною 8 т. н. п.
2) Вірус віспи - лінійна молекула з ковалентно замкнутими кінцями. Широко використовується для вакцинації. В геном вірусу вводять гени, які кодують антигенні білки різних хвороботворних вірусів або мікробів і використовують такі рекомбінантні віруси для вакцинації. Таким чином, людина одержує імунітет і проти віспи, і проти ще однієї хвороби.
3) Аденовіруси - дволанцюгова лінійна ДНК довжиною 35 т.н.п. Складна система транскрипції ранніх і пізніх генів. Можуть добре розмножуватися в культурах клітин і потім добре із цих культур виділяти продукти.
4) Ретровируси – РНК-вмісні віруси. Реплікація одноланцюгового РНК-генома включає наступні стадії:
-
утворення дволанцюгової ДНК за допомогою зворотньої транскриптази;
-
вбудовування вірусної ДНК в геном хазяїна;
-
транскрипцію вбудованої ДНК з утворенням мРНК і дочірніх вірусних геномов;
-
синтез вірусних структурних білків і зворотньої транскриптази;
-
зборку нових вірусних часток і вивільнення їх із клітини.
Типовий вектор буде містити:
-
фрагменти плазміди pBR322, необхідні для реплікації в E.coli і відбору;
-
LTR-послідовність вірусного генома, включаючи послідовності, які необхідні для зворотної транскрипції;
-
послідовності, які необхідні для упакування;
-
селективні маркери для відбору;
-
хоча б один унікальний сайт для рестриктази.
Переваги ретровірусних векторів: широке коло хазяїв; при ретровирусній інфекції клітини не гинуть.
Вектори які використовуються в генетичній інженерії рослин
Використання плазмид Agrobacterium tumifaciens . Це грамнегативні бактерії, які, потрапляючи в клітину, утворюють пухлини, які називаються корончасті галли і нагадують ракові клітини тварин. Ці клітини галлових пухлин починають синтезувати опіни - похідні аргініну. Найпоширеніші опіни: актопін, опалін, атропін. Опіни можуть бути використані агробактеріями, як джерело C, N, P, енергії. Виявилося, що здатність индукувати пухлини рослин і синтезувати опіни пов'язана з наявністю в бактеріях pТі-плазмід.
Використання ДНК-вмісних вірусів рослин
Із ДНК-вмісних вірусів рослин найбільш перспективним для генної інженерії є вірус мозаїки кольорової капусти. ДНК повинні бути інфекційні. З ними легше працювати, чим із рТі, в інфікованій рослині накопичується велика кількість копій вірусного геному, експресія вірусних генів перебуває під контролем сильних промоторів (чужорідний ген ефективно експресується).
Використання органел
Це хлоропласти і мітохондрії. Одержання човникових векторів.
Вектори є спеціалізованими, служать для збільшення експресії клонованих генів. Вони містять ефективні промотори і ділянки ініціації й транскрипції.
