
- •5. Задание студентам :
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •1. Тема занятия: Линейные и циклические сопряженные системы. Ароматичность.
- •3. Задачи занятия:
- •5. Задание студентам:
- •5.1.Отчитаться за выполненные домашние задания;
- •6.4. Получить задания бумажного тестового контроля, ответить на тесты, ответы сдать
- •8. Литература для подготовки:.
- •Тюкавкина н.А., Бауков ю.И. Биоорганическая химия: Учебник.-2-е. -м., Медицина, 1991.- 528с. Стр.29 – 49.
- •Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •3. Задачи занятия:
- •5. Задание студентам:
- •5.2 Прослушать объяснения преподавателя, выполнить упражнения
- •Работа № 1. Сравнение основных свойств аммиака и мочевины. Образование нитрата мочевины.
- •К раствору, мочевины добавляют 2 капли конц. Нnо3, встряхивают содержимое. Немедленно образуется белый кристаллический осадок труднорастворимой азотнокислой мочевины.
- •Работа № 2. Сравнение кислотных свойств спиртов и фенолов.
- •8. Литература для подготовки.
- •3.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •3. Задачи занятия :
- •5. Задание студентам:
- •8. Литература для подготовки. Основная:
- •3.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •3. Задачи занятия :
- •5 . Задание студентам :
- •6. Методические указания к выполнению самостоятельной работы на занятии,
- •8. Литература для подготовки. Основная:
- •3.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •Работа № 1. Окисление первичных спиртов раствором перманганата калия.
- •Работа № 2. Окисление альдегидов гидроксидом меди (п).
- •8. Литература для подготовки.
- •2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •2.2. Изучить важнейшие биохимические превращения карбоновых кислот.
- •3. Задачи занятия
- •5. Задание студентам
- •8. Литература для подготовки
- •2 .Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •8. Литература для подготовки
- •2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •5. Задание студентам
- •8. Литература для подготовки
- •2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •5. Задание студентам
- •8. Литература для подготовки
- •2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •3. Задачи занятия :
- •4. Продолжительность занятия : 2 акад. Часа.
- •5. Задание студентам:
- •6. Методические указания к выполнению самостоятельной работы на занятии.
- •8. Литература для подготовки. Основная:
- •3.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •5. Задание студентам
- •Работа № 2. Восстановительные (редуцирующие) свойства моносахаридов - альдоз (окисление глюкозы гидроксидом меди (II) в присутствии щелочи)
- •8. Литература для подготовки
- •2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •5. Задание студентам
- •8. Литература для подготовки
- •2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •5. 5. Задание студентам
- •8. Литература для подготовки
- •2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •5. 5. Задание студентам
- •8. Литература для подготовки
- •2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •3. Задачи занятия :
- •4. Продолжительность занятия : 2 акад. Часа.
- •5. Задание студентам:
- •6. Методические указания к выполнению самостоятельной работы на занятии.
- •8. Литература для подготовки. Основная:
- •2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
3.Сайкс П. Механизмы реакций в органической химии., Пер с англ – М.: Химия, 1991 – С. 448.
4. «Руководство к лабораторным занятиям по биоорганической химии» под ред. Тюкавкиной Н.А. – М.: Медицина, 1985..
9. Обсуждено на заседании кафедры 29. 08. 2008 г.
10. Учебное задание подготовлено. доц.. Каминской Л.А.
ГОУ ВПО УГМА РОСЗДРАВА
кафедра биохимии
Утверждаю
Зав. каф. проф., д.м.н.
Мещанинов В.Н.
_____‘’_____________2008 г
Биоорганическая химия
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ДЛЯ СТУДЕНТОВ
К ПРАКТИЧЕСКОМУ ЗАНЯТИЮ № 7
Факультет: лечебно-профилактический, медико-профилактический, педиатрический
1 Курс. 1 семестр
1. ТЕМА ЗАНЯТИЯ : Карбоновые кислоты.- монокарбоновые, карбоновые. Гетерофункциональные производные карбоновых кислот- гидрокси- и оксокислоты.
2.УЧЕБНАЯ ЦЕЛЬ ЗАНЯТИЯ:
2.1.Сформировать знание о физических. и химических свойствах карбоновых кислот и их функциональных производных, моно-, ди-, гидроки-. оксокарбоновых кислот.
2.2. Изучить важнейшие биохимические превращения карбоновых кислот.
3. Задачи занятия
3.1. Изучить номенклатуру карбоновых кислот, составление названий в соответствии со структурной формулой и составление структурной формулы в соответствии с названием.
3.2. Научиться сравнивать кислотные свойства различных карбоновых кислот.
3.3. Понимать механизм реакций образования функциональных производных карбоновых кислот (сложные эфиры, амиды, галогенангидриды, ангидриды).
3.4. Выявить и изучить особенности химических свойств гетерофункциональных гидрокси – и оксокарбоновых кислот, дикарбоновых кислот.
3.5. Связать химические свойства изученных карбоновых кислот in vitro и направление их биохимических реакций in vivo.
3.6. освоить лабораторно- практические исследования свойств карбоновых кислот, качественные реакции их обнаружения.
4. ПРОДОЛЖИТЕЛЬНОСТЬ ЗАНЯТИЯ 2 акад. часа.
5. Задание студентам
5.1.Отчитаться за выполненные домашние задания;
5.2 Прослушать объяснения преподавателя, выполнить упражнения
5.3. .Провести контроль усвоения знаний( тестовый контроль по теме занятия)
5.4. Выполнить лабораторные практические работы:
а). реакция обнаружения щавелевой кислоты (образование нерастворимой соли оксалата кальция);
б). обнаружение уксусной кислоты;
в). получение сложного эфира.
6. МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ВЫПОЛНЕНИЮ САМОСТОЯТЕЛЬНОЙ РАБОТЫ НА ЗАНЯТИИ
6.1.Составить конспект лабораторного исследования
6.2. Подготовить реактивы и лабораторную посуду
6.3. Провести лабораторное исследование, записать выводы.
6.4. Получить задания бумажного тестового контроля, ответить на тесты, ответы сдать
преподавателю.
Работа № 1. Обнаружение уксусной кислоты
Реактивы и материалы
Ацетат натрия кристаллический;
Вода дистиллированная;
Раствор хлорида железа (III) 0,1 н;
Ход работы
В пробирку помещают несколько крупинок ацетата натрия CH3COONa, добавляют 3–5 капель воды, взбалтывают до полного растворения соли. Затем добавляют 2–3 капли раствора хлорного железа, перемешивают. Опишите наблюдаемые изменения. Полученный желто-красный раствор нагревают до кипения. Опишите наблюдаемые изменения.
Химизм реакций
Уксусную кислоту (и ее растворимые соли – ацетаты) часто обнаруживают по образованию чайно-красной средней железной соли в слабокислой среде. Эта растворимая соль при нагревании частично подвергается гидролизу, давая красно-бурый осадок основной соли-гидроксидиацетата железа (III):
3 CH3COONa + FeCl3 = (CH3COO)3Fe + 3 NaCl
(CH3COO)3Fe + H2O (CH3COO)2FeOH +CH3COOH
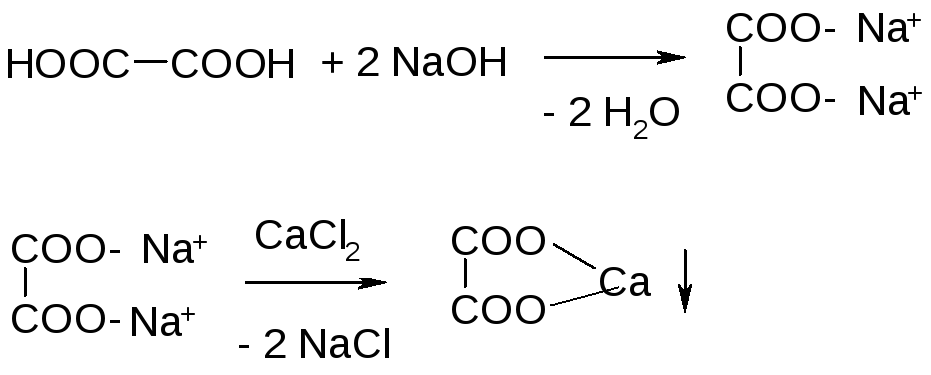
Работа № 2. Обнаружение щавелевой кислоты
Реактивы и материалы
Щавелевая кислота кристаллическая или оксалат натрия;
Раствор хлорида кальция CaCl2 1 н;
Раствор NaOH 0,1 н;
Водный раствор уксусной кислоты, 4%-ный;
Индикаторная бумажка (универсальная);
Предметное стекло;
Ход работы
В пробирку помещают несколько кристаллов щавелевой кислоты (или оксалата натрия), добавляют 0,5 мл воды, смесь нагревают до полного растворения кристаллов, охлаждают. Полученный раствор щавелевой кислоты нейтрализуют раствором NaOH до рН 6-7 (добавляют щелочь по каплям, встряхивая, значение рН контролируют индикаторной бумажкой). Раствор, полученный из оксалата натрия, нейтрализовать щелочью не нужно). Затем с помощью пипетки 1-2 капли раствора наносят на предметное стекло, добавляют 1 каплю раствора CaCl2.
Опишите наблюдаемые изменения .
Затем к полученному на стекле бесцветному осадку добавляют 2-3 капли раствора уксусной кислоты, перемешивают. Опишите наблюдаемые изменения.
Химизм реакций
Оксалат натрия в слабокислой и нейтральной среде образует с ионами Са2+ бесцветный кристаллический осадок оксалата кальция, нерастворимый в уксусной и других слабых кислотах. Под микроскопом видна характерная форма кристаллов оксалата кальция, они похожи на почтовые конверты:
Медико-биологическое значение работы
Данная методика позволяет быстро, не прибегая к сложным лабораторным тестам, обнаруживать оксалат в моче и других биологических жи
Работа № 3. Получение сложного эфира
Реактивы и материалы
Ацетат натрия СН3СООNa кристаллический или уксусная кислота ледяная;
Кислота серная конц.;
Изоамиловый спирт С5Н11ОН;
Ход работы
В сухую пробирку помещают немного (высота слоя 2 мм) порошка безводного ацетата натрия и 3 капли изоамилового спирта. Затем добавляют 2 капли концентрированной серной кислоты, осторожно нагревают на пламени спиртовки, равномерно по всему объему смеси, не до кипения, все время встряхивая пробирку. Через 1-2 мин. жидкость буреет и появляется характерный запах изоамилацетата – запах грушевой эссенции. Нюхать осторожно, пары изоамилацетата токсичны! (Порошок ацетата натрия можно заменить 3 каплями уксусной кислоты).
Чтобы освободиться от примесей, маскирующих запах эфира, готовую, уже охлажденную реакционную смесь вливают в другую пробирку с 2 мл воды. Примеси растворяются в воде, а изоамилацетат испаряется с поверхности воды, запах его ощущается более отчетливо.
По аналогичной методике, используя этиловый спирт вместо изоамилового, получают этилацетат - жидкость с характерным запахом.
Химизм реакций
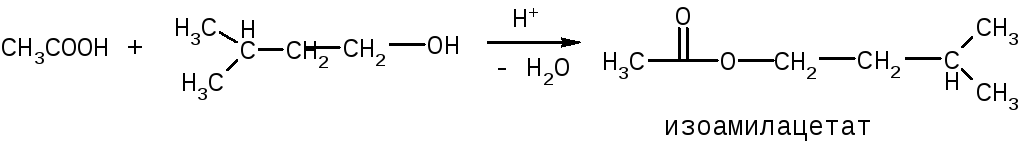
Медико-биологическое значение работы. Работа выявляет важные химические свойства карбоновой кислоты – способность образовывать сложные эфиры.
7. КОНТРОЛЬНЫЕ ВОПРОСЫ ПО ТЕМЕ ЗАНЯТИЯ смотрите задание для студентов к практическому занятию.
