
- •Предисловие
- •Оглавление
- •Глава 1
- •Глава 2
- •Глава 3
- •Глава 4
- •Глава 5
- •Глава 6
- •Глава 7
- •Глава 8
- •Глава 9
- •Основы аналитической химии
- •Способы выражения концентраций растворов
- •1.3. Объемный (титрометрический) анализ.
- •Механизм действия ионизационных индикаторов.
- •«Учение о растворах»
- •Классификация растворов.
- •2.2. Растворы неэлектролитов
- •Давление насыщенного пара растворителя.
- •2.3. Растворы электролитов.
- •2.4. Протолитическая теория кислот и оснований
- •Буферные растворы
- •Vсоли * Ncоли
- •Vкисл * Nкисл
- •3.2. Механизмы действия буферных систем
- •3.3. Буферные системы организма
- •Основы химической кинетики и термодинамики.
- •Факторы, влияющие на скорость. Катализ
- •Кинетика обратимых реакций. Химическое равновесие
- •Химическая термодинамика
- •2 Следствия закона Гесса:
- •Энтропия
- •Дисперсные системы. Получение, свойства, строение коллоидных растворов.
- •5.2. Строение коллоидных частиц
- •Методы получения коллоидных растворов
- •5.4. Свойства коллоидных растворов
- •5.5. Коагуляция коллоидных частиц
- •Правила коагуляции
- •Vзоля , л
- •Строение мицеллы слюны.
- •Глава 6 Высокомолекулярные соединения (вмс)
- •6.2. Факторы устойчивости вмс
- •Глава 7 Поверхностные явления
- •Явления, происходящие на границе раздела двух фаз.
- •Поверхностно активные и поверхностно инактивные вещества.
- •Адсорбция на подвижных и неподвижных границах
- •Адсорбция веществ из растворов на твердом адсорбенте
- •Избирательность адсорбции
- •Глава 8 Электропроводность растворов электролитов
- •Проводники второго рода, явления, связанные с перемещением ионов
- •8.2. Закон Кольрауша.
- •8.3. Электрохимия. Электрометрические методы анализа.
- •8.4. Электродные потенциалы.
- •8.5. Гальванические элементы
- •8.6. Диффузионный и мембранный потенциалы
- •8.7. Потенциометрия
- •8.8. Потенциометрический метод определения рН растворов.
- •Глава 9 Макро- и микроэлементы как химические компоненты живой природы
- •9.1. Основные принципы классификации химических элементов
- •Список использованной литературы
8.8. Потенциометрический метод определения рН растворов.
Определение рН раствора этим методом сводится к установлению потенциала (е) электрода определения, погруженного в исследуемый раствор, и основано на зависимости его величины от значения рН. Величину электродного потенциала (е) электрода определения находят по ЭДС цепи, составленной из электрода сравнения (у него потенциал известен) и электрода определения. Например, составим электродную пару из хингидронного (индикаторного) и хлорсеребряного (сравнения) электродов (см. рисунок).
Характеристики элемента:
-
Схема элемента: Ag, AgCl / Cl¯ // Pt / H+, С6Н4О2 , С6Н4О2-
Для
определения ЭДС необходимо выяснить,
какой из этих электродов будет выполнять
функцию катода, а какой – анода, т. е. на
каком из электродов будет проходить
процесс восстановления, а где будет
проходить процесс окисления. Что бы это
определить, нужно сравнить величины
электродных потенциалов, используемых
электродов, т. к. известно, что анод имеет
мѐньшую величину электродного потенциала.
Воспользуемся справочными данными
(25оС):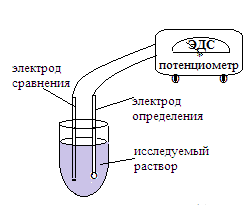
еох.г. = 0,699 В
е х.с. = 0,201 В
Для определения электродного потенциала электрода определения воспользуемся уравнением Нернста:
е х.г. = еох.г. + 0,059 lg a H+ = 0,699 + 0,059 lg a H+
Из уравнения следует, что е х.г. значительно больше, чем е х.с., поэтому хингидронный электрод будет катодом, а хлорсеребряный – анодом.
2. Электродная реакция:
На катоде: С6Н4О2 + 2Н+ + 2ē ↔ С6Н4(ОН)2 - процесс восстановления;
На аноде: Ag - ē → Ag+

Ag+ + Cl¯↔ AgCl
Ag + Cl¯- ē ↔ AgCl – суммарная реакция – процесс окисления.
Е = ек - еа = ех.г.- ех.с.
Е = 0,699 + 0,059 lg a H+ - 0,201
Е = 0,699 - 0,059 рН - 0,201
0,498 - Е
 рН
=
рН
=
0,059
Упражнения для самостоятельной работы:
-
Гальванический элемент составлен из цинкового и золотого электродов. Записать схему гальванического элемента, химическую реакцию, протекающую в нем, рассчитать стандартную ЭДС элемента.
-
Удельная электропроводность 0,5 Н раствора нитрата магния равна 4,38*10-2 ом-1*м-1. Вычислить эквивалентную электропроводность.
-
Вычислить степень диссоциации 0,3 Н раствора уксусной кислоты, если удельная электропроводность раствора 1,2*10-3 ом-1 м-1. Эквивалентная электропроводность при бесконечном разведении λ оо =350 ом-1*м2*экв-1.
-
Потенциал водородного электрода в исследуемом растворе равен -0,177 В. Чему равен рН раствора?
-
Чему равен ЭДС гальванического элемента, состоящего из двух медных электродов, погруженных в растворы CuS04, один с концентрацией 0,01 моль/л, другой с концентрацией 0,1 моль/л?
-
Электроды определения –
-
электроды, потенциал которых зависит от концентрации каких-либо ионов в растворе
-
величина электродного потенциала не зависит от концентрации протонов
-
электроды, потенциал которых точно известен, устойчив во времени и не зависит от концентрации ионов в растворе
-
Окислительно-восстановительные электроды –
-
электроды, у которых мѐньшая величина электродного потенциала
-
электроды, где все элементы полуреакции (и окисленная и восстановленная форма) находятся в растворе.
-
электроды, погруженные в раствор, служащие переносчиками электронов
-
Диффузионный потенциал
-
возникает при соприкосновении растворов разных концентраций
-
возникает при повреждении клетки и называется «потенциалом повреждения»
-
уменьшается, если растворы электролитов разных концентраций разделены мембраной.
