
- •Механика
- •1. Система отсчета. Радиус-вектор материальной точки. Закон движения материальной точки (мт).
- •2. Вектор перемещения (мт). Путь. Скорость. Ускорение.
- •3. Угловая скорость. Угловое ускорение.
- •4. Нормальное и тангенциальное ускорения.
- •5. Пространство и время в движущихся системах отсчета. Закон инерции Галилея. Инерциальные системы отсчета (исо). Преобразования Галилея и следствия из них.
- •Пример преобразования Галилея:
- •15. Уравнение Ньютона-Эйнштейна. 2-й закон Ньютона.
- •16. Момент силы. Момент импульса частицы. Момент инерции.
- •Электромагнетизм и электромагнитные волны
- •Фундаментальные свойства зарядов
- •2. Электрическое поле. Напряженность электрического поля. Принцип суперпозиции.
- •3. Потенциал электрического поля. Эквипотенциали. Связь потенциала и напряженности электрического поля.
- •Где символ частной производной подчеркивает, что дифференцирование производится только по х. Повторив аналогичные рассуждения для осей у и z, можем найти вектор ё:
- •4. Проводник в электрическом поле. Электростатическая индукция.
- •5. Атомы и молекулы в электрическом поле.
- •6. Поляризация диэлектриков. Вектор поляризации. Диэлектрическая проницаемость вещества. Электрическое смещение.
- •7. Сегнетоэлектрики. Пьезоэлектрический эффект. Обратный пьезоэлектрический эффект.
- •8. Электрическое поле заряженного проводника. Электроемкость проводника.
- •9. Конденсаторы. Поле внутри плоского конденсатора.
- •10. Энергия системы зарядов. Энергия электрического поля.
- •11. Классическая теория электропроводности. Закон Ома в дифференциальной (локальной) форме. Закон Ома для однородного проводника.
- •12. Закон Джоуля – Ленца в дифференциальной форме. Закон Джоуля-Ленца для однородного проводника.
- •18. Контур с током в магнитном поле.
- •19. Атомы и молекулы в магнитном поле. Парамагнетики.
- •20. Диамагнетики. Природа диамагнетизма.
- •21. Вектор намагниченности. Магнитная проницаемость вещества. Напряженность магнитного поля.
- •22. Ферромагнетики. Домены. Петля гистерезиса.
- •26. Явление самоиндукции. Индуктивность.
- •27. Энергия магнитного поля. Объемная плотность энергии.
- •28. Гипотеза Максвелла: магнитоэлектрическая индукция.
- •30. Свободные затухающие колебания. Период колебаний.
- •31. Вынужденные электрические колебания. Резонанс.
- •32. Возникновение электромагнитной волны. Волновое уравнение для электромагнитного поля. Плоская электромагнитная волна.
- •38. Методы получения когерентных источников (методы наблюдения интерференции).
- •Квантовая механика
- •1. Фотоэффект. Квантовый характер электромагнитного излучения. Формула Эйнштейна для фотоэффекта.
- •2. Фотоны. Энергия, масса и импульс фотона. Корпускулярно-волновой дуализм света.
- •3. Гипотеза де Бройля. Волна де Бройля. Экспериментальное подтверждение волновых свойств частиц.
- •А)Опыт к. Дэвиссона и л. Джермера (1927 г.)
- •B) Опыт Томсона и Тартаковского.
- •4. Особенности описания движения микрочастиц. Соотношения неопределенностей.
- •5. Уравнение Шрёдингера. Волновая функция.
- •6. Частица в одномерной бесконечно глубокой потенциальной яме.
- •7. Квантовый гармонический осциллятор. Энергия нулевых колебаний.
- •10. Уравнение Шредингера для атома водорода. Квантовые числа.
- •Основные квантовые числа
- •13. Строение многоэлектронного атома. Периодическая система элементов Менделеева.
- •Термодинамика и статистическая физика
- •1. Макросистема и методы ее описания. Контакты систем. Температура.
- •2. Тепловое равновесие. Уравнение состояния. Модель идеального газа.
- •3. Равновесные процессы. Изопроцессы.
- •6. Теплота. 1-е начало термодинамики.
- •7. Теплоемкость идеального газа. Соотношение Майера.
- •8. Зависимость теплоемкости многоатомного газа от температуры.
- •38. Лазеры. Процесс генерации.
- •39. Лазеры. Создание инверсной населенности.
- •40. Фермионы. Распределение Ферми-Дирака. Заполнение электронами разрешенных уровней в кристалле.
- •41. Энергетические уровни в атоме и энергетические зоны в кристалле.
- •42. Распределение электронов по квантовым состояниям в кристалле. Проводники и диэлектрики.
- •51. Деление ядер. Цепная реакция деления. Ядерные реакторы.
- •54. Квантовые числа элементарных частиц. Частицы и античастицы.
6. Теплота. 1-е начало термодинамики.
Термодинамическая система может получать и отдавать энергию и без изменения внешних параметров, т.е. без совершения работы. Такой способ передачи энергии от одной системы к другой называется теплообменом или теплопередачей. Количество энергии, переданное системе (или отданное системой) в результате теплообмена, называется количеством теплоты (или просто теплотой). Теплообмен происходит между телами, имеющими разную температуру.
При
теплообмене на границе между телами
происходит взаимодействие медленно
движущихся молекул менее нагретого
тела (тела, имеющего более низкую
температуру) с быстро движущимися
молекулами более нагретого тела. В
результате средние кинетические энергии
молекул выравниваются и скорости молекул
холодного тела увеличиваются, а горячего
уменьшаются. Теплота, таким образом,
переходит от тела с большей температурой
к телу с меньшей температурой.
Где
С- называемая теплоемкостью тела. ![]()
Уравнение выражает первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил. Выражение для элементарного процесса можно записать в виде:
В СИ количество теплоты выражается в тех же единицах, что работа и энергия, т. е. в джоулях (Дж). Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии AU=0. Тогда, согласно первому началу термодинамики,
т.
е. вечный двигатель первого рода —
периодически действующий двигатель,
который совершал бы большую работу, чем
сообщенная ему извне энергия, невозможен
(одна из формулировок первого начала
термодинамики).
7. Теплоемкость идеального газа. Соотношение Майера.
Удельная
теплоемкость вещества — величина,
равная количеству теплоты, необходимому
для нагревания 1 кг вещества на 1 К:
Единицей удельной теплоемкости является джоуль па килограмм-кельвин [Дж/(кг-К)].
Молярная
теплоемкость — величина, равная
количеству теплоты, необходимому для
нагревания 1 моль вещества на 1 К:
Единица молярной теплоемкости — джоуль на моль-кельвин [ДжДмоль • К]
Различают теплоемкости при постоянном объеме и постоянном давлении, если в процессе нагревания вещества его объем или давление поддерживается постоянным.
Если
газ нагревается при постоянном объеме,
то работа внешних сил равна нулю и
сообщаемая газу извне теплота идет
только на увеличение его внутренней
энергии,т. е. молярная теплоемкость газа
при постоянном объеме Су равна изменению
внутренней энергии 1 моль газа при
повышении его температуры на 1 К.
Если
газ нагревается при постоянном давлении,
то выражение можно записать в виде
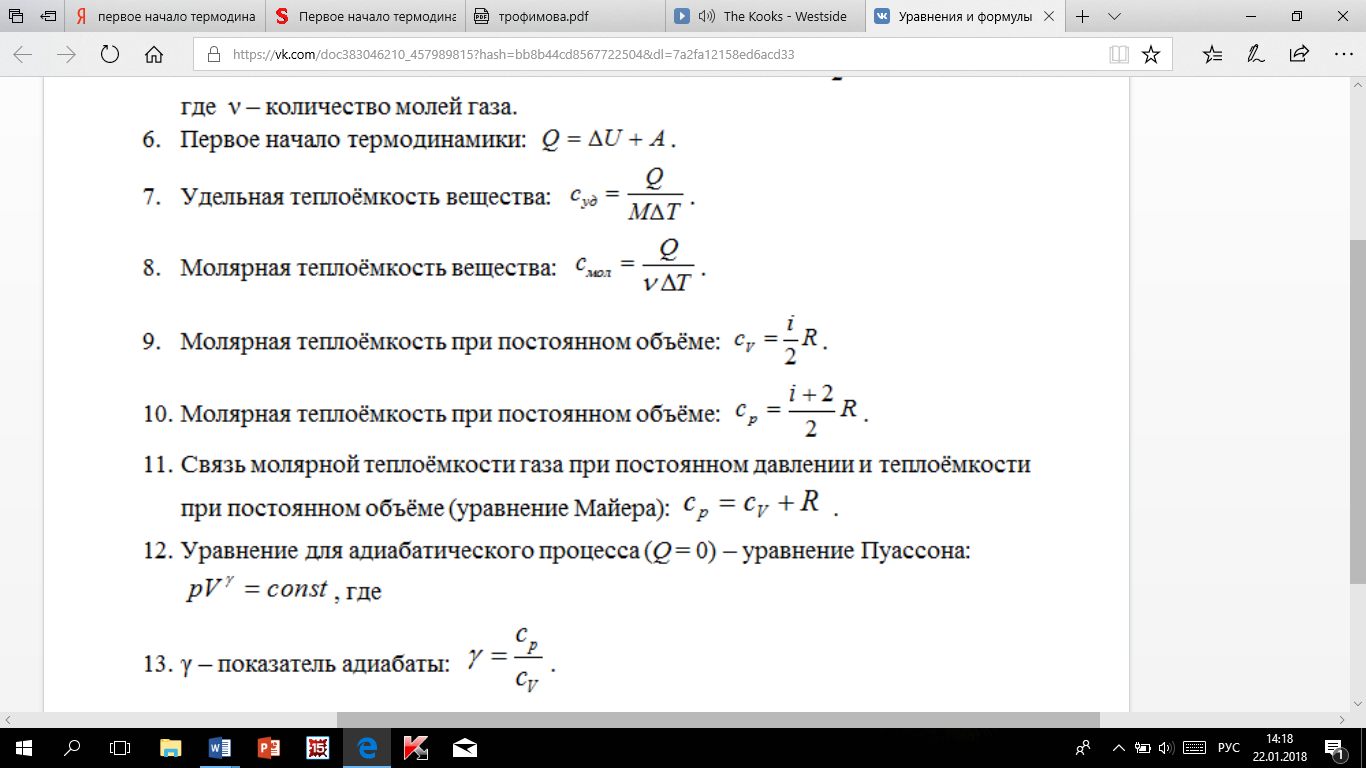
Уравнение Майера показывает, что Ср всегда больше Cv на величину молярной газовой постоянной. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа.
8. Зависимость теплоемкости многоатомного газа от температуры.
Классический закон равнораспределения энергии по степеням свободы выполняется не при всех температурах.
Теплоемкость оказывается зависящей от температуры, в то время как, она должна быть для данного газа с данным значением i величиной постоянной. Опыт показывает, что теплоемкость с понижением температуры уменьшается.
Эту зависимость можно было бы объяснить тем, что с изменением температуры изменяется число «действующих» степеней свободы молекул, т. е. какие-то движения молекул, происходящие в одной области температур, прекращаются в другой. Однако такое предположение требует, чтобы теплоемкость изменялась с температурой скачками. Ведь то или иное движение может или происходить, или не происходить; в первом случае ему соответствует энергия kT/2, во втором эта энергия и связанный с ней вклад в теплоемкость отсутствуют. Возможно, конечно, не внезапное прекращение или возникновение того или иного вида движения молекулы, а постепенное изменение его интенсивности. Но закон равнораспределения не различает этого; с любой степенью свободы связана одна и та же энергия. Между тем температурная зависимость теплоемкости, как показывает опыт, имеет плавный ход — теплоемкость изменяется постепенно. Это свидетельствует о том, что закон равномерного распределения энергии по степеням свободы не может считаться вполне верным и имеет ограниченную применимость.
9. Адиабатический процесс. Уравнение Пуассона.
Процесс, происходящий в системе без теплообмена с окружающей средой, называется адиабатическим.
Теплоемкости
![]() и
и![]() идеального
газа, вообще говоря, зависят от температуры,
однако во многих случаях они остаются
практически постоянными в широком
интервале температур. Понятно, что
постоянным будет и их отношение
идеального
газа, вообще говоря, зависят от температуры,
однако во многих случаях они остаются
практически постоянными в широком
интервале температур. Понятно, что
постоянным будет и их отношение![]() .
.


Уравнение Пуассона- является уравнением адиабаты– кривой, изображающей квазистатический адиабатический процесс.
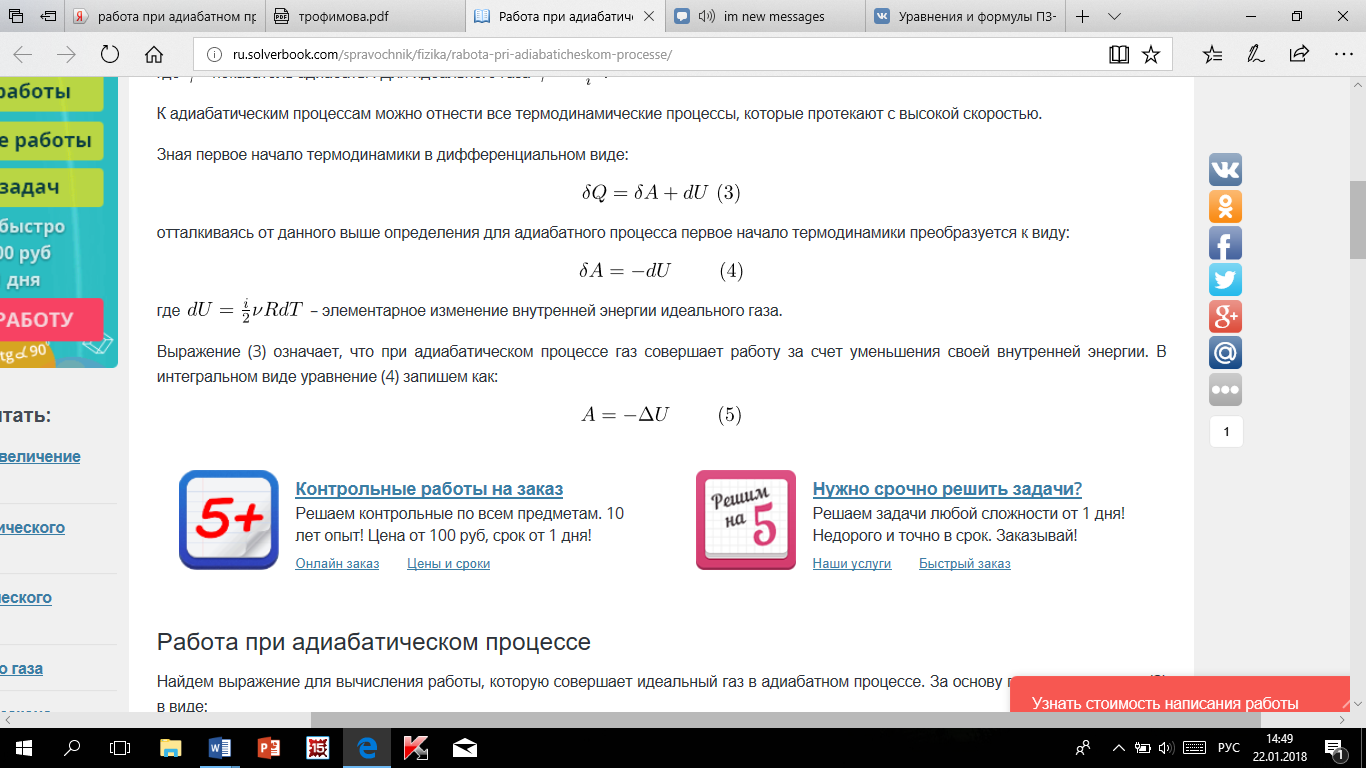
10. Работа при адиабатическом процессе.
Работа,
совершаемая газом при адиабатном
расширении 1 — 2 (определяется тонированной
площадью на рис. 85), меньше, чем при
изотермическом расширении. Это объясняется
тем, что при адиабатном расширении
происходит охлаждение газа, тогда как
при изотермическом температура
поддерживается постоянной за счет
притока извне эквивалентного количества
теплоты.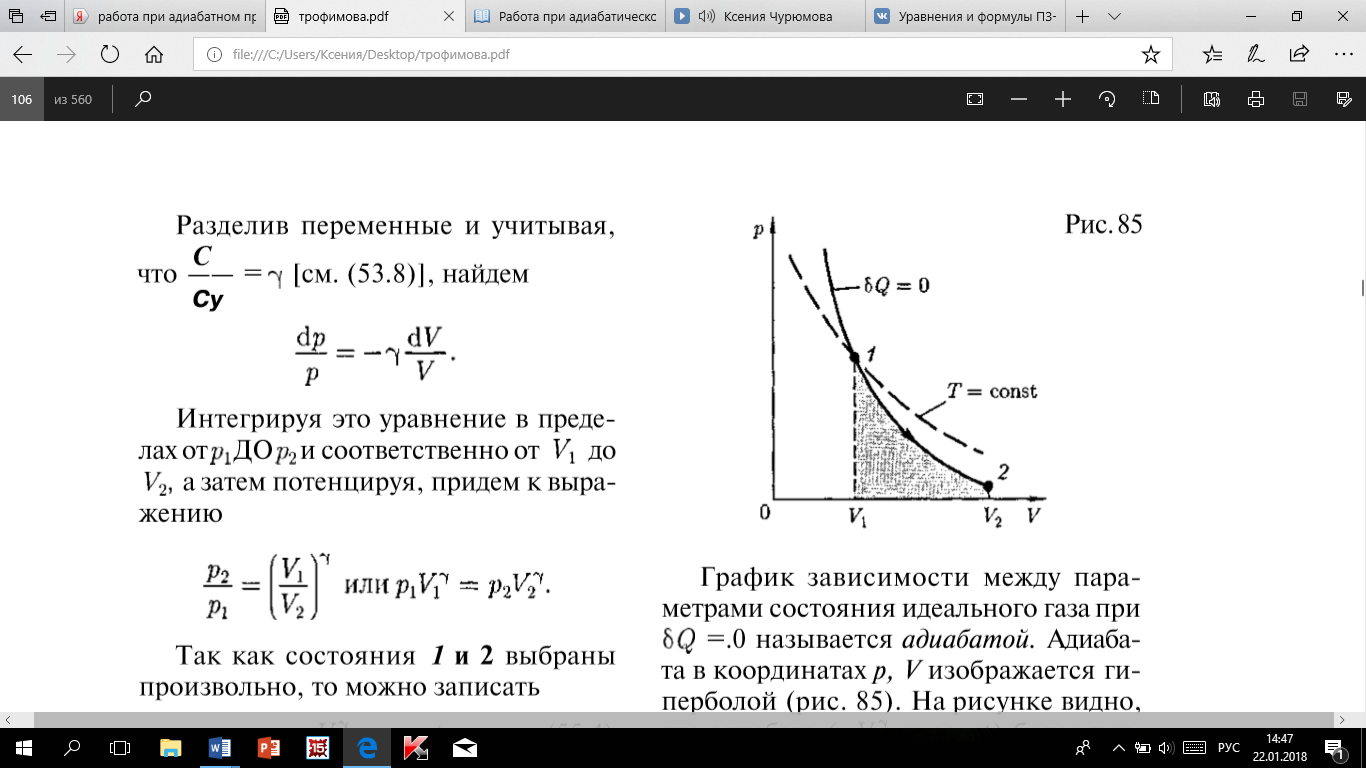
Т.к.![]()
Тогда
11. Распределение молекул по скоростям (распределение Максвелла).
С
помощью теории вероятности Максвеллу
удалось вывести формулу для относительной
частоты, с которой в газе при данной
температуре встречаются молекулы со
скоростями в определенном интервале
значений.
При получении этой формулы Максвелл основывался на следующих предположениях:
1. Газ состоит из большого числа N одинаковых молекул.
2. Температура газа постоянна.
3. Молекулы газа совершают тепловое хаотическое движение.
4. На газ не действуют силовые поля.
Почитайте 15.1 там формулки
12. Экспериментальная проверка закона распределения Максвелла.


13. Средняя, средняя квадратичная и наиболее вероятная скорости молекул.
Сопоставляя все три скорости:
1)
наиболее вероятную  ,
,
2)
среднюю 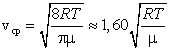 ,
,
3)
среднюю квадратичную  ,
–
,
–
видим, что наименьшей из них является наиболее вероятная, а наибольшей – средняя квадратичная. Относительное число быстрых и медленных молекул мало.
14. Барометрическая формула.
барометрическая формула
![]()
Если давление определяется в миллиметрах ртутного столба (мм рт.ст.), то барометрическая формула принимает вид:
![]()
Барометрическая формула широко используется для оценки атмосферного давления при различных условиях, хотя она дает слегка завышенные значения.
(exp- это степень).
15. Распределение Больцмана.
Распределение
Больцмана — распределение вероятностей
различных энергетических состояний
идеальной термодинамической системы
(идеальный газ атомов или молекул) в
условиях термодинамического равновесия.(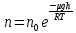 )
)

16. Макросостояние и микросостояние системы. Основной постулат статистической физики. Статистический вес.
Макросостояние системы- состояние определяемое совокупностью её макропараметров. Микросостояние системы- состояние определяемое состояние всех её частиц.
Основной постулат статистической физики- в тепловом равновесии: а)Система равное время находится в любом из доступных состояний; б)Все микросостояния системы равновероятны.
Статистический
вес- равновесной системы( )-
число всех возможных микросостояний
которыми реализуются макросостояния.
Для реальных систем:
)-
число всех возможных микросостояний
которыми реализуются макросостояния.
Для реальных систем:

17. Энтропия системы. Закон возрастания энтропии.
Энтропия является мерой неупорядоченности системы многих частиц. Чем выше степень беспорядка в координатах и скоростях частиц системы, тем больше вероятность того , что система будет находиться в состоянии беспорядка. (S=k*lnΩ - Формула Больцмана, где k- постоянная Больцмана)
Закон возрастания энтропии- в теплоизолированной системе при стационарных внешних условиях энтропия может лишь возрастать со временем, достигаемая максимума в тепловом равновесии.
18. Энтропия и температура.
С повышением температуры энтропия возрастает.

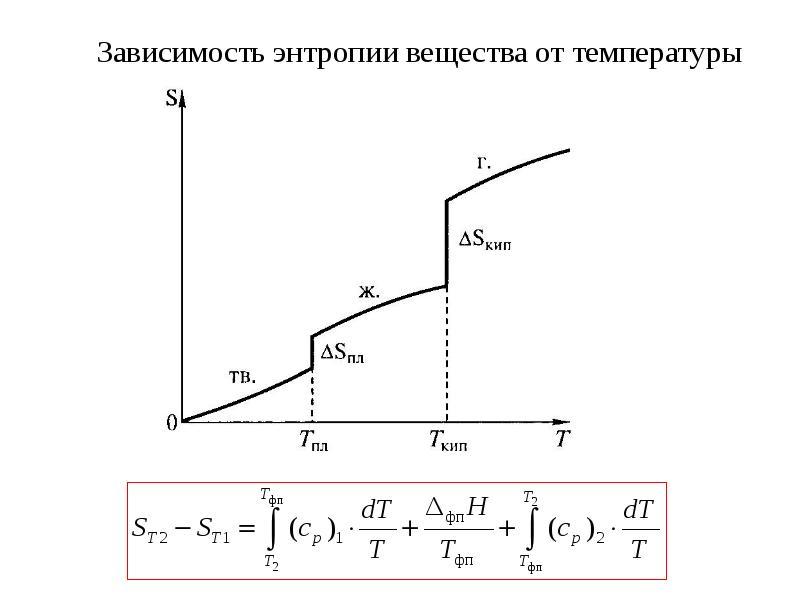
19. Энтропия и теплота.

20. Энтропия идеального газа. Изменение энтропии в изопроцессах.
Энтропия
идеального газа:
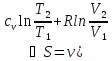 )
)
a)В
адиабатном процессе:
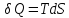
б)В
изотермическом:

в)В
изохорическом:

г)В
изобарическом :
 =
=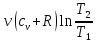
21. Циклы. Работа цикла. 2-е начало термодинамики.
Цикл Карно в координатах T—S. Пусть тепловая машина состоит из нагревателя с температурой , холодильника с температурой и рабочего тела. Цикл Карно состоит из четырёх обратимых стадий, две из которых осуществляются при постоянной температуре (изотермически), а две — при постоянной энтропии (адиабатически). Поэтому цикл Карно удобно представить в координатах T (температура) и S (энтропия).1. Изотермическое расширение ( A→Б)2. Адиабатическое расширение ( Б→В).3. Изотермическое сжатие ( В→Г).4. Адиабатическое сжатие ( Г→А).
2-е
начало термодинамики, формулировка
Клаузиуса- При тепловом контакте тел
теплота переходит от более нагретого
тела к менее нагретому. Закон возрастания
энтропии.
22. К.п.д. цикла. Цикл Карно.
К.п.д.
цикла -
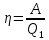
Цикл
Карно-
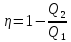
К.п.д.
цикла Карно-

23. Явления переноса. Диффузия. Закон Фика.
В термодинамической неравновесной системе возникают особые неравновесные процессы, называемые явлением переноса., в результате которых происходит перенос в пространстве энергии, массы и импульса. К явлениям переноса относятся:1)теплопроводность (перенос энергии) ; 2) диффузия (перенос массы) ;3) внутренние трение или вязкость (перенос импульса).
Диффузия – это обусловленное тепловым движением выравнивание концентрации смеси нескольких веществ. Этот процес наблюдается в газах, жидкостях и твердых телах.
Закон
Фика-
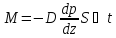
24. Теплопроводность. Закон Фурье.
Теплопроводность — способность материальных тел к переносу энергии (теплообмену) от более нагретых частей тела к менее нагретым частям тела, осуществляемому хаотически движущимися частицами тела.
Теория
теплопроводности рассматривает тело
как непрерывную среду. Согласно основному
закону теплопроводности - закону Фурье
- вектор плотности теплового потока,
передаваемого теплопроводностью,
пропорционален вектору градиента
температуры.(
 ).
Он характеризует способность вещества,
из которого состоит рассматриваемое
тело, проводить теплоту.
).
Он характеризует способность вещества,
из которого состоит рассматриваемое
тело, проводить теплоту.
25. Вязкость. Перенос импульса.
Процесс переноса импульса лежит в основе явления вязкости или внутреннего трения. Возникает это явление в тех случаях, когда на хаотическое тепловое движение молекул накладывается упорядоченное движение молекул со скоростью . Если газ или жидкость движутся в трубе, то скорости движения различных слоев газа различны. Вследствие теплового движения молекулы переходят из слоя в слой, перенося с собой импульс. При этом медленные слои ускоряются, быстрые – тормозятся.
Уравнение
переноса импульса-
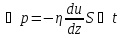
26. Модель реального газа. Уравнение Ван-дер-Ваальса
Модель реального газа, предложенная Ван-дер-Ваальсом , отличалась от модели идеального газа учетом объема самих молекул и их взаимодействия. Последний фактор несколько уменьшает давление — каждая молекула при столкновении как бы тормозится притяжением соседних.

Уравнение
Ван-дер-Ваальса-
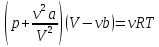 ,
где: где a и b постоянные
Ван-дер-Ваальса,
,
где: где a и b постоянные
Ван-дер-Ваальса,
 —
количество молей газа.
—
количество молей газа.
27. Конденсация реального газа. Изотермы Ван-дер-Ваальса.
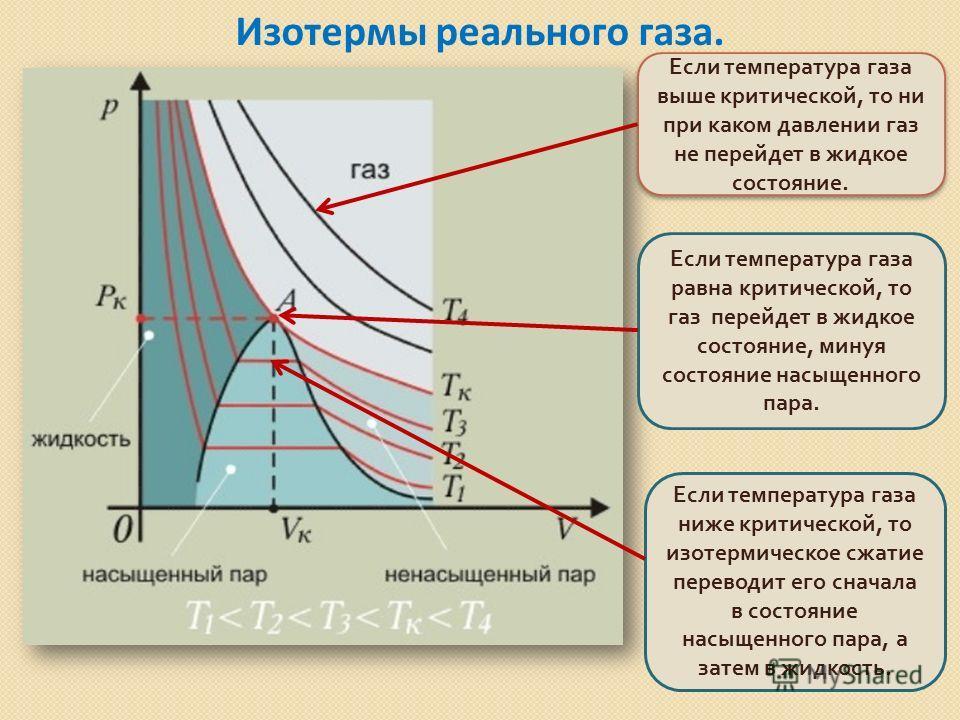
28. Дырочная модель жидкости. Время оседлой жизни. Энергия активации молекул.

29. Классическая теория теплоемкости кристаллов. Закон Дюлонга-Пти.
Согласно классической (не квантовой) теории кристалл, состоящий из N атомов, является системой с 3N колебательными степенями свободы.Напомним, что число степеней свободы- это число независимых координат, которые необходимо задать для определения положения системы в пространстве. Различают степени свободы поступательного, вращательного и колебательного движений. Поступательное и вращательное движение тела, как единого целого, в данном случае мы не учитываем, т.к. всегда можно перейти в такую систему отсчета, в которой данное твердое тело покоится (сопутствующая система отсчета).
В согласии с классической теорией на каждую степень свободы колебательного движения приходится энергия кТ (кТ/2 в виде кинетической энергии и кТ/2 в виде потенциальной). Следовательно энергия 1 моль вещества U=3NakT=3RT. Здесь Na= 6,02 10231/моль- постоянная Авогадро, k=1,38 10-23 Дж/К- постоянная Больцмана, R=Nak=8,31 Дж/(моль К)- универсальная газовая постоянная, T- температура. В свою очередь молярная теплоемкость
С=U/T=3R. (1)
Формула (1) выражает собой закон Дюлонга-Пти: молярная теплоемкость всех химически простых тел в кристаллическом состоянии одинакова, не зависит от температуры и равна 3R. Однако, как показывают эксперименты, этот закон достаточно хорошо выполняется только при высоких температурах. При низких температурах теплоемкость кристаллов убывает по закону T3и стремится к нулю при T®0 (рис.1).
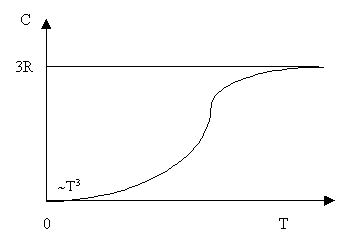 Рис.1
Рис.1
Таким образом классическая теория не позволяет правильным образом описать поведение теплоемкости твердых тел при низких температурах.
30. Диффузионный контакт систем. Химический потенциал.

31. Модели поведения частиц в системе. Типы статистик. Распределение Бозе-Эйнштейна.


В статистической механике статистика Бо́зе — Эйнштейна определяет распределение тождественных частиц с нулевым или целочисленным спином (таковыми являются, например, фотоны и атомы гелия-4) по энергетическим уровням в состоянии термодинамического равновесия. Предложена в 1924 году Шатьендранатом Бозе для описания фотонов. В 1924—1925 годах Альберт Эйнштейн обобщил её на системы атомов с целым спином.
Статистика Бозе-Эйнштейна (так же как и статистика Ферми-Дирака) связана с квантовомеханическим принципом неразличимости тождественных частиц. Статистикам Ферми — Дирака и Бозе — Эйнштейна подчиняются системы тождественных частиц, в которых нельзя пренебречь квантовыми эффектами. Квантовые эффекты проявляются при значениях концентрации частиц (N/V) ≥ nq, где nq — это т. н. квантовая концентрация, при которой среднее расстояние между частицами равно средней волне де Бройля для идеального газа при заданной температуре. При концентрации nq волновые функции частиц «касаются» друг друга, но практически не перекрываются. Статистике Ферми — Дирака подчиняются т. н. фермионы (частицы, для которых справедлив принцип запрета Паули), а статистике Бозе — Эйнштейна — бозоны. Поскольку квантовая концентрация растёт с увеличением температуры, большинство физических систем при высоких температурах подчиняется классической статистике Максвелла — Больцмана. Исключениями являются системы с очень высокой плотностью, например, белые карлики. В пределе высокой температуры или низкой концентрации частиц обе статистики переходят в классическую статистику Максвелла — Больцмана.
Бозоны, в отличие от фермионов, не подчиняются принципу запрета Паули — произвольное количество частиц может одновременно находиться в одном состоянии. Из-за этого их поведение сильно отличается от поведения фермионов при низких температурах. В случае бозонов при понижении температуры все частицы будут собираться в одном состоянии, обладающем наименьшей энергией, формируя так называемый конденсат Бозе — Эйнштейна.
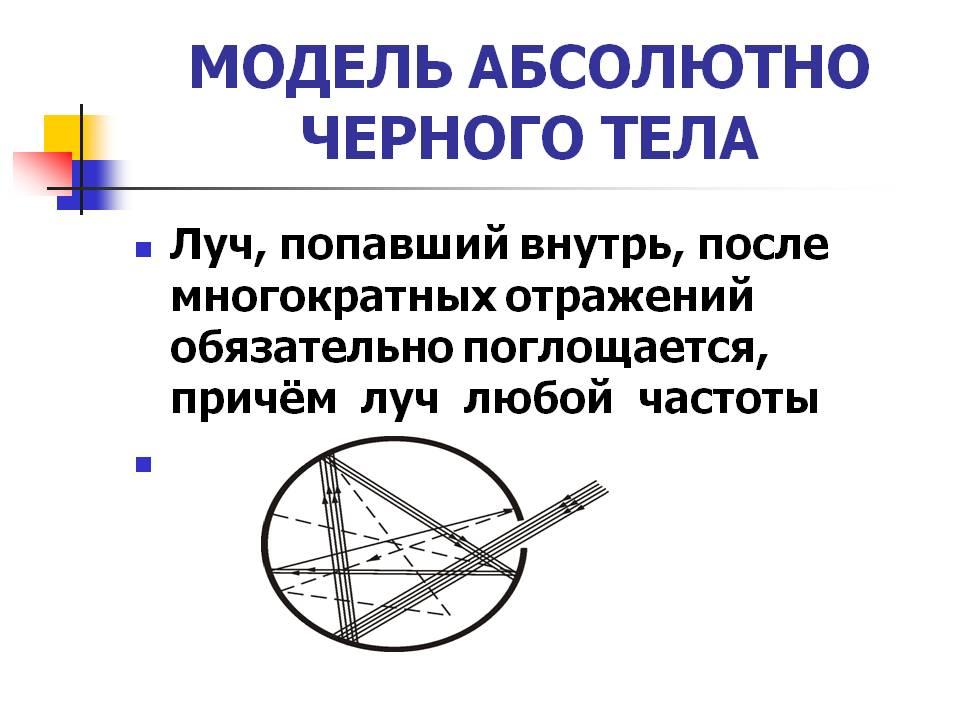
32. Модель абсолютно черного тела. Распределение Планка для фотонов в тепловом равновесии.
Абсолютно чёрное тело — физическое тело, которое при любой температуре поглощает всё падающее на него электромагнитное излучение во всех диапазонах

33. Абсолютно черное тело. Закон излучения Планка.
Абсолютно чёрное тело — физическое тело, которое при любой температуре поглощает всё падающее на него электромагнитное излучение во всех диапазонах.
Закон излучения Планка (формула Планка) - закон распределения энергии в спектре излучения равновесного при определённой температуре Т. Был открыт М. Планком в 1900 на основе гипотезы квантования энергии вещества.
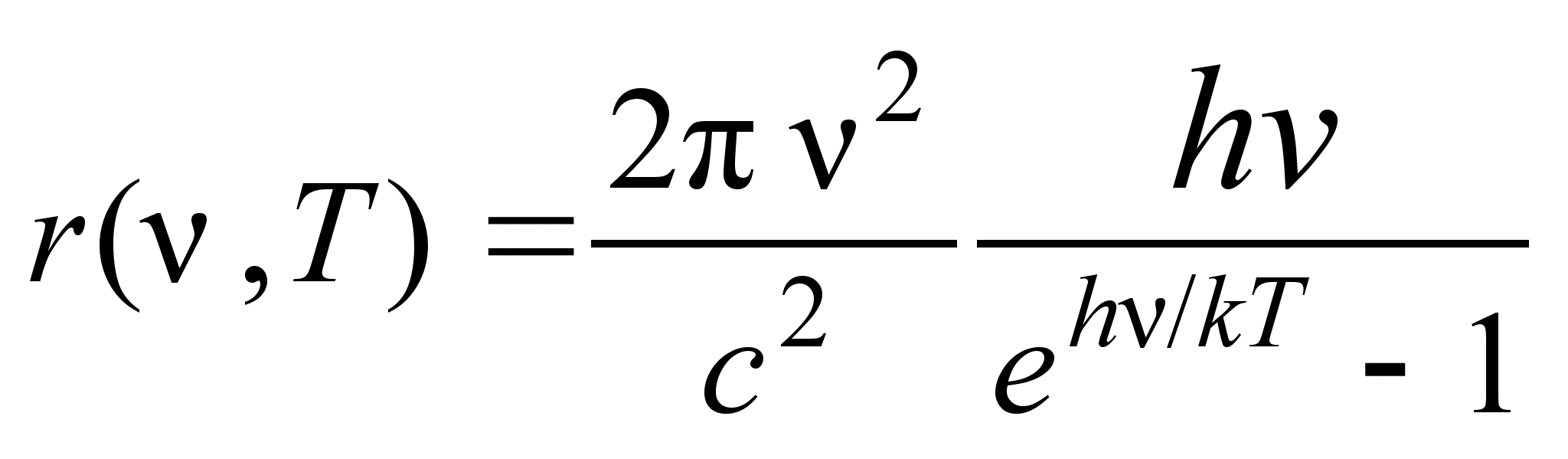
34. Абсолютно черное тело. Закон Стефана-Больцмана.
Абсолютно чёрное тело — физическое тело, которое при любой температуре поглощает всё падающее на него электромагнитное излучение во всех диапазонах.
Закон Стефана — Больцмана — интегральный закон излучения абсолютно чёрного тела. Определяет зависимость плотности мощности излучения абсолютно чёрного тела от его температуры.
В словесной форме закон может быть сформулирован следующим образом: полная объёмная плотность равновесного излучения и полная испускательная способность абсолютно чёрного тела пропорциональны четвёртой степени его температуры.
![]() ,
где
σ— постоянная Стефана — Больцмана,
которая может быть выражена через
фундаментальные константы путём
интегрирования по всем частотам формулы
Планка:
,
где
σ— постоянная Стефана — Больцмана,
которая может быть выражена через
фундаментальные константы путём
интегрирования по всем частотам формулы
Планка:
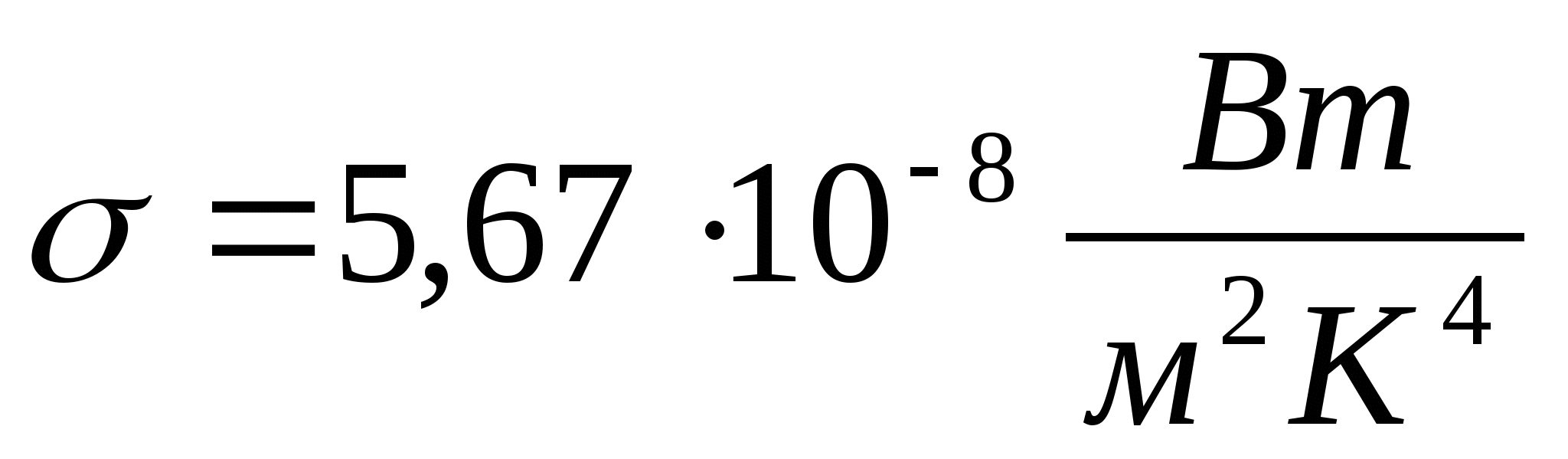
35. Абсолютно черное тело. Закон смещения Вина.
Абсолютно чёрное тело — физическое тело, которое при любой температуре поглощает всё падающее на него электромагнитное излучение во всех диапазонах.
Закон смещения Вина устанавливает зависимость длины волны, на которой поток излучения энергии чёрного тела достигает своего максимума, от температуры чёрного тела.

36. Оптическая пирометрия.
Оптическая пирометрия — это метод бесконтактного (дистанционного) измерения температуры нагретых тел. Приборы для измерения температуры бесконтактным методом называют пирометрами. С их помощью можно измерять температуру звезд. Солнца, расплавленного металла, нити накаливания ламп и т.п.
В зависимости от того, какая характеристика излучения нагретого тела измеряется, различают:
1.Цветовую температуру, определяемую по положению максимума(r0)ф функции Планка r0: T=b/m -это первый закон Вина. Цветовая температура совпадает с истинной температурой тела.
2.Яркостную температуру, измеряемую по испускательной способности:
r=ar0,Для чего надо знать коэффициент черноты тела aT, температура которого измеряется. Для выделения излучения с данной длиной волныиспользуется светофильтр.
3.Радиационную температуру, измеряемую по энергетической светимости серого тела: R =aR0 .
Яркостная и радиационная температуры не совпадают с истинной температурой тела
37. Поглощение фотонов атомами. Спонтанное и вынужденное излучение. Принцип детального равновесия.

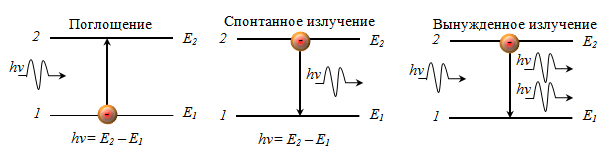
Процесс испускания фотона возбужденным атомом без каких-либо внешних воздействий называется спонтанным (самопроизвольным) излучением. Чем больше вероятность спонтанных переходов, тем меньше среднее время жизни атома в возбужденном состоянии. Т.к. спонтанные переходы взаимно не связаны, то спонтанное излучение не когерентно.
Излучение, происходящее в результате внешнего облучения называется вынужденным. Таким образом, в процесс вынужденного излучения вовлечены два фотона: первичный фотон, вызывающий испускание излучения возбужденным атомом, и вторичный фотон, испущенный атомом. Вторичные фотоны неотличимы от первичных.
